- 2021-06-30 发布 |
- 37.5 KB |
- 18页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
四川省绵阳南山中学2020届高三3月网络考试 理科综合试题(PDF版)
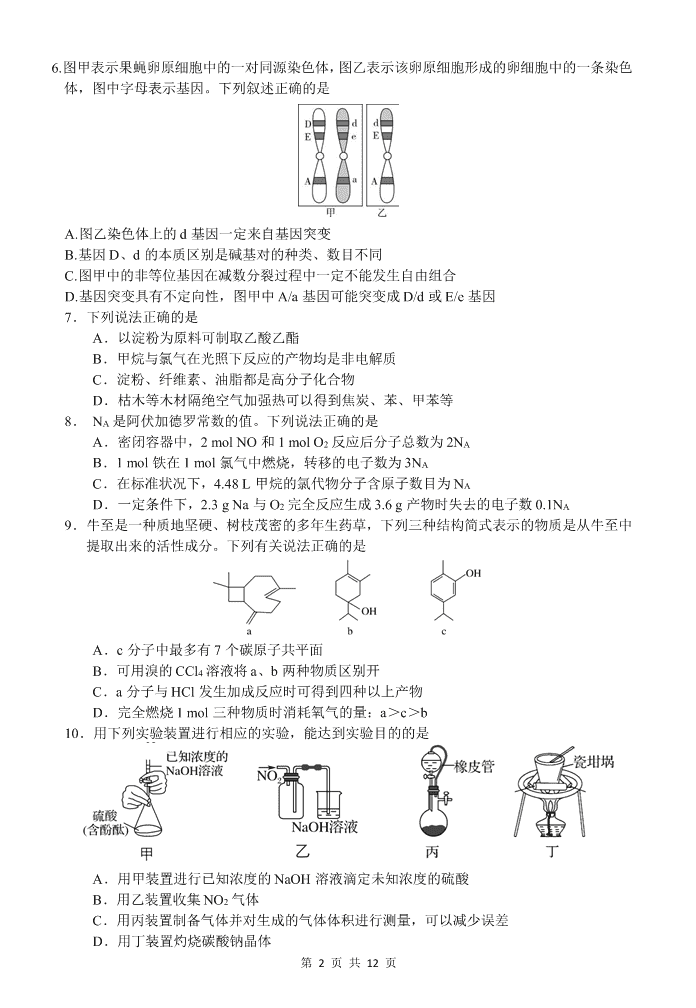
第 1 页 共 12 页 绵阳南山中学 2020 年春季高 2017 级网络统考 理综试题 注意事项: 1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。 2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如 需改动,用橡皮擦干净后,再选涂其它答案标号。回答非选择题时,将答案写在答题卡上, 写在本试卷上无效。 3.考试结束后,将本试卷和答题卡一并交回。 可能用到的相对原子质量: H 1 C 12 O 16 Na 23 S32 K39 Mn55 V51 Ba 137 一、选择题:本题共 13 个小题,每小题 6 分,共 78 分。在每小题给出的四个选项中,只有 一项是符合题目要求的。 1.下列关于生物体内水的叙述,错误的是 A.水是细胞结构的重要组成成分 B.衰老的细胞中水的含量减少 C.人体水盐平衡调节中枢位于下丘脑 D.水在动植物细胞内参与的反应完全不同 2.下列关于细胞内物质运输的叙述,正确的是 A.肝细胞中内质网合成的磷脂可转移至中心体 B.吞噬细胞中溶酶体分解产物可能被排出细胞外 C.浆细胞中内质网加工的抗体可直接转移至细胞膜 D.细菌细胞中基因指导合成的蛋白质可转移至细胞核 3.下列关于生物科学研究方法和相关实验的叙述中,错误的是 A.对比实验法:探究酵母菌细胞的呼吸方式 B.差速离心法:细胞中各种细胞器的分离和叶绿体中色素的分离 C.模型构建法:DNA 双螺旋结构的发现和研究种群数量变化规律 D.同位素标记法:研究光合作用的反应过程和噬菌体侵染细菌实验 4.下列是对某一癌症患者体内造血干细胞和癌细胞的比较,正确的是 A.造血干细胞和癌细胞的细胞周期不一定相同 B.造血干细胞和癌细胞中的基因和 mRNA 都相同 C.癌细胞的分裂能力和分化能力都比造血干细胞强 D.原癌基因在癌细胞中表达但在造血干细胞中不表达 5.切叶蚁切割收集的植物叶片,将含有消化酶的排泄物排在碎叶上,不久碎叶上会长出真菌,然 后以“培养”得到的真菌作为自己的食物来源。下列分析错误的是 A.体型大小不同的切叶蚁之间存在互利共生的关系 B.切叶蚁“培养”的真菌是分解者,能促进碳、氮循环 C.切叶蚁与其培养的真菌之间的关系是长期共同进化的结果 D.探路的切叶蚁发现合适植物后会留下“气味”,这属于化学信息 第 2 页 共 12 页 6.图甲表示果蝇卵原细胞中的一对同源染色体,图乙表示该卵原细胞形成的卵细胞中的一条染色 体,图中字母表示基因。下列叙述正确的是 A.图乙染色体上的 d 基因一定来自基因突变 B.基因 D、d 的本质区别是碱基对的种类、数目不同 C.图甲中的非等位基因在减数分裂过程中一定不能发生自由组合 D.基因突变具有不定向性,图甲中 A/a 基因可能突变成 D/d 或 E/e 基因 7.下列说法正确的是 A.以淀粉为原料可制取乙酸乙酯 B.甲烷与氯气在光照下反应的产物均是非电解质 C.淀粉、纤维素、油脂都是高分子化合物 D.枯木等木材隔绝空气加强热可以得到焦炭、苯、甲苯等 8. NA 是阿伏加德罗常数的值。下列说法正确的是 A.密闭容器中,2 mol NO 和 1 mol O2 反应后分子总数为 2NA B.1 mol 铁在 1 mol 氯气中燃烧,转移的电子数为 3NA C.在标准状况下,4.48 L 甲烷的氯代物分子含原子数目为 NA D.一定条件下,2.3 g Na 与 O2 完全反应生成 3.6 g 产物时失去的电子数 0.1NA 9.牛至是一种质地坚硬、树枝茂密的多年生药草,下列三种结构简式表示的物质是从牛至中 提取出来的活性成分。下列有关说法正确的是 A.c 分子中最多有 7 个碳原子共平面 B.可用溴的 CCl4 溶液将 a、b 两种物质区别开 C.a 分子与 HCl 发生加成反应时可得到四种以上产物 D.完全燃烧 1 mol 三种物质时消耗氧气的量:a>c>b 10.用下列实验装置进行相应的实验,能达到实验目的的是 A.用甲装置进行已知浓度的 NaOH 溶液滴定未知浓度的硫酸 B.用乙装置收集 NO2 气体 C.用丙装置制备气体并对生成的气体体积进行测量,可以减少误差 D.用丁装置灼烧碳酸钠晶体 第 3 页 共 12 页 11.中国科学家用蘸墨汁书写后的纸张作为空气电极,设计并组装了轻型、柔性、能折叠的可 充电锂空气电池如图甲,电池的工作原理如图乙。下列有关说法正确的是 A.放电时,纸张中的纤维素作为锂电池的负极 B.充电时,若阳极放出 1 mol O2,则有 4 mol e-回到电源正极 C.开关 K 闭合给锂电池充电,X 对应充电电极上的反应为 Li++e-===Li D.放电时,Li+由正极经过有机电解质溶液移向负极 12.A、B、C、D 四种短周期元素的原子序数依次增大,A 的一种核素在考古时常用来鉴定 一些文物的年代,B 的气态氢化物的水溶液呈碱性;C 为金属元素且有两种常见含氧化合 物(都含两种元素);若往 D 单质的水溶液中滴加少量紫色石蕊溶液,可观察到先变红后褪 色。下列说法中正确的是 A.C 的两种含氧化合物中阴、阳离子个数比都为 1∶2 B.最高价氧化物对应的水化物的酸性:B>D C.B 的氢化物的沸点一定高于 A 的氢化物 D.原子半径:D>A>B>C 13.25 ℃时,向 10 mL 0.1 mol·L-1 一元弱碱 XOH 溶液中逐滴滴加 0.1 mol·L-1 的 HCl 溶液, 溶液的 AG[AG=lg cH+ cOH-]变化如图所示(溶液混合时体积变化忽略不计)。下列说法不正 确的是 A.若 a=-8,则 Kb(XOH)≈10-5 B.M 点表示盐酸和 XOH 恰好完全反应 C.R 点溶液中可能存在 c(X+)+c(XOH)=c(Cl-) D.M 点到 N 点,水的电离程度先增大后减小 二、选择题:本题共 8 小题,每小题 6 分,共 48 分。在每小题给出 的四个选项中,第 14~18 题只有一项符合题目要求,第 19~21 题有多项符合题目要求。全部 选对的得 6 分,选对但不全的得 3 分,有选错的得 0 分。 14.下列说法正确的是 A. 亚里士多德提出重的物体比轻的物体下落的快,是没有事实依据凭空猜想出来的 B. 牛顿通过大量的实验验证了牛顿第一定律的正确性 C. 从金属表面逸出的光电子的最大初动能与照射光的强度无关,与照射光的频率成正比 D. 根据玻尔理论可知:当氢原子的核外电子从低能级跃迁到高能级时,需要吸收能量,电子 的轨道半径增大 第 4 页 共 12 页 15.2019 年 4 月 1 日,在中国核能可持续发展论坛上,生态环境部介绍 2019 年会有核电项目 陆续开工建设,某核电站获得核能的核反应方程为 235 1 144 89 1 92 0 56 36 0U+ n Ba Kr nx ,已知铀 核的质量为 m1,钡核的质量为 m2,氪核的质量为 m3,中子的质量为 m4,下列说法中正确的 是 A.该核电站通过核聚变获得核能 B.铀核的质子数为 143 C.在上述核反应中 x=2 D.一个铀核发生上述核反应,释放的能量为(m1–m2–m3–2m4)c2 16.如图(a)所示,一只小鸟沿着较粗的树枝从 A 缓 慢移动到 B,将该过程抽象为质点从圆弧 A 点移动 到 B 点,如图(b)。以下说法正确的是 A.树枝对小鸟的作用力减小 B.树枝对小鸟的作用力增大 C.树枝对小鸟的摩擦力减小 D.树枝对小鸟的摩擦力增大 17.在一小型交流发电机中,矩形金属线圈 a bcd 的面积为 S,匝数为 n,线圈总电阻为 r, 在磁感应强度为 B 的匀强磁场中,绕轴OO以 角速度 匀速转动(如图甲所示),产生的感 应电动势随时间的变化关系,如图乙所示,矩 形线圈与阻值为 R 的电阻构成闭合电路,下列 说法中正确的是 A.从 t3 到 t4 这段时间通过电阻 R 的电荷量为 0 () E Rr B.从 t1 到 t3 这段时间内穿过线圈磁通量的变化量为零 C.t4 时刻穿过线圈的磁通量的变化率大小为 E0 D.在 0–t4 时间内电阻 R 上产生的热量为 2 0 42() RE tRr 18.一含有理想变压器的电路如图所示,交流电源输出电压的 有效值不变,图中三个电阻 R 完全相同,电压表为理想交流 电压表,当开关 S 断开时,电压表的示数为 U0;当开关 S 闭 合时,电压表的示数为 0 37 38U .变压器原、副线圈的匝数比为 A. 5 B. 6 C. 7 D. 8 19.2019 年 10 月 1 日,在庆祝中华人民共和国成立 70 周年阅兵式上,习近平主席乘“红旗” 牌国产轿车依次检阅 15 个徒步方队和 32 个装备方队(如图甲所示)。检阅车在水平路面上的 启动过程如图乙所示,其中 Oa 为过原点的 倾斜直线,ab 段表示以额定功率 P 行驶时 的加速阶段,bc 段是与 ab 段相切的水平直 线,若检阅车的质量为 m,行驶过程中所 受阻力恒为 f,则下列说法正确的是 第 5 页 共 12 页 A.检阅车在 t1 时刻的牵引力和功率都是最大值,t2~t3 时间内其牵引力等于 f B.0~t1 时间内检阅车做变加速运动 C.0~t2 时间内的平均速度等于 2 2 v D.t1~t2 时间内检阅车克服阻力所做功为 P(t2﹣t1)+ 22 12 11 22mv mv 20.现在人们可以利用无线充电板为手机充电,如图所示为充电原理图,充电板接交流电源, 对充电板供电,充电板内的送电线圈可产生交变磁场,从而使手机内的受电线圈产生交变电 流,再经整流电路转变成直流电后对手机电池充电.若在某 段时间内,磁场垂直于受电线圈平面向上穿过线圈,其磁感 应强度均匀增加.下列说法正确的是( ) A.c 点电势高于 d 点电势 B.c 点电势低于 d 点电势 C.感应电流方向由 c→受电线圈→d D.感应电流方向由 d→受电线圈→c 21.如图,一绝缘且粗糙程度相同的竖直细杆与两个等量异种点电荷+Q、-Q 连线的中垂线重 合,细杆和+Q、-Q 均固定,A、O、B 为细杆上的三点,O 为+Q、-Q 连线的中点,AO=BO。 现有电荷量为 q、质量为 m 的小球套在杆上,从 A 点以初速度 v0 向 B 滑动,到达 B 点时速度恰好为 0。则可知 A.从 A 到 B,小球的电势能始终不变,受到的电场力先增大后减小 B.从 A 到 B,小球的加速度先减小后增大 C.小球运动到 O 点时的速度大小为 0 2 2 v D.小球从 A 到 O 与从 O 到 B,重力的冲量相等 三、非选择题:共 174 分。第 22~32 题为必考题,每个试题考生都必须作答。第 33~38 题为 选考题,考生根据要求作答。 (一)必考题:共 129 分。 22.(6 分)利用图所示装置可以做力学中的许多实验.m 为 小车质量,F 等于砝码重力。 (1)以下说法正确的是________. A.用此装置“研究匀变速直线运动”时,必须设法消除小车 和木板间的摩擦阻力的影响 B.用此装置“探究加速度 a 与力 F 和质量 m 的关系”时,每次改变砝码及砝码盘总质量之后, 不需要重新平衡摩擦力 C.在用此装置“探究加速度 a 与力 F 和质量 m 的关系”时,应使砝码盘和盘内砝码的总质量远 小于小车的质量 D.用此装置“探究做功与物体速度变化的关系”时,不需要平衡小车运动中所受摩擦力的影响 (2)在“探究加速度与力、质量的关系”时需要平衡摩擦力,正确的操作是________. A.把砝码盘的细线系在小车上,小车拖着纸带并开启打点计时器开始运动 B.不能把砝码盘的细线系在小车上,小车不用拖着纸带开始运动 C.不能把砝码盘的细线系在小车上,小车拖着纸带并开启打点计时器开始运动 D.把砝码盘的细线系在小车上,小车不用拖着纸带开始运动 (3)在利用此装置“探究加速度 a 与力 F 和质量 m 的关系”时,实验中按规范操作打出的一条纸 带的一部分如图.已知打点计时器所用交流电的频率为 50 Hz。在顺次打出的点中,每 5 个打 点间隔取 1 个计数点,分别记为 A、B、C、D、E。相邻计数点间的距离已在图中标出,则打 点计时器打下计数点 C 时,小车的瞬时速度 v=________ m/s,小车的加速度 a=________ m/s2。 第 6 页 共 12 页 (结果保留二位有效数字) 23.(9 分)为了测定一节干电池的电动势和内阻,实验室提供了下列器材: A.待测干电池(电动势约为 1.5V,内阻约几欧) B.电流表 A(量程 0~50mA,内阻 r=10Ω}) C.电压表 V(量程 0~3V,内阻约 3kΩ) D.滑动变阻器 R1(0~20Ω,10A) E.滑动变阻器 R2(0~100Ω,1A) F.定值电阻 R=2.5Ω G.开关、导线若干 (1)为了多测量几组数据且便于操作,滑动变阻器应该选择________(填选项前字母) (2)请依据以上提供的器材中选择所需器材设计测量电路,在图甲线框内画出完整的电路图. (3)根据合理电路的测量 数据,电流表 A 的示数记 为 I,电压表 V 的示数记 为 U,某同学测出了多组 数据,并已描绘出如图乙 所示关系图线.根据已描 绘出的图线,可得被测电 池的电动势为_____V,内 阻为_______Ω(结果均保 留三位有效数字). 24.(12 分)如图甲所示,放置在水平桌面上的两条光滑导轨间的距离 L=1 m,质量 m=1 kg 的 光滑导体棒放在导轨上,导体棒接入电路的电阻 r=1Ω,导轨左端与阻值 R=3 Ω 的电阻相连, 其余导线电阻不计,导轨所 在位置有磁感应强度 B=2 T 的匀强磁场,磁场的方向垂 直导轨平面向下,现在给导 体棒施加一个水平向右的恒 定拉力 F,并每隔 0.2 s 测量 一次导体棒的速度,乙图是 根据所测数据描绘出导体棒 的 v-t 图象.(设导轨足够长) 求: (1)求水平向右的恒定拉力 F; (2)t=1.2 s 时,导体棒的加速度大小; (3)在前 1.6 s 内导体棒的位移 x=8 m,试计算 1.6 s 内电阻 R 上产生的热量. 第 7 页 共 12 页 25.(20 分)如图所示,空间存在着方向竖直向上的匀强电场和方向垂直于纸面向内、磁感应强 度大小为 B 的匀强磁场,带电荷量为+q、质量为 m 的小球 Q 静置在光滑绝缘的水平高台边 缘,另一质量为 m、不带电的绝缘小球 P 以水平初速度 v0 向 Q 运动,v0= mg 3qB,小球 P、Q 正 碰过程中没有机械能损失 且电荷量不发生转移,已知 匀强电场的电场强度 E= mg q ,水平台面距地面高度 h =m2g q2B2,重力加速度为 g, 不计空气阻力。 (1)求 P、Q 两球首次发生弹性碰撞后小球 Q 的速度大小; (2)P、Q 两球首次发生碰撞后,Q 运动一段时间后会与 P 第二次发生碰撞,首次碰撞后经过多 少时间小球 P 落地?落地点与平台边缘间的水平距离多大? (3)若撤去匀强电场,并将小球 Q 重新放在平台边缘、小球 P 仍以水平初速度 v0= mg 3qB向 Q 运 动,小球 Q 的运动轨迹如图所示,已知 Q 球在最高点和最低点所受合力的大小相等。求小球 Q 在运动过程中的最大速度和第一次下降的最大距离 H。 26.(15 分)碳的氧化物对环境的影响较大,CO 是燃煤工业生产中的大气污染物,CO2 则促进了地球的温室效应。给地球生命带来了极大的威胁。 (1)已知:①甲醇的燃烧热△H=-726.4kJ·mol-1 ②H2(g)+ 1 2 O2(g)=H2O(l) △H=-285.8kJ·mol-1。 则二氧化碳和氢气合成液态甲醇,生成液态水的热化学方程式为 。 (2)二氧化碳合成 CH3OH 的热化学方程式为 CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H1, 过程中会产生副反应:CO2(g)+H2(g) CO(g)+H2O(g)△H2。图 1 是合成甲醇反应中温度对 CH3OH、CO 的产率影响曲线图,△H2 0(填“>”或“<”)。增大反应体系的压强,合成 甲醇的反应速率 (填“增大”“减小”或“ 不变”),副反应的化学平衡 (填“向正 反应方向”“向逆反应方向”或“不”)移动。 (3)以某些过渡金属氧化物作催化剂,二氧化碳与甲烷可转化为乙酸: CO2(g) +CH4(g) CH3COOH(g) △H=+36.0kJ·mol-1。不同温度下,乙酸的生成速率变化曲线 如图 2。结合反应速率,使用催化剂的最佳温度是 ℃,欲提高 CH4 的转化率,请提供 一种可行的措施: 。 第 8 页 共 12 页 (4)一定条件下,CO2 与 NH3 可合成尿素[CO(NH2)2]: CO2(g)+2NH3 CO(NH2)2(g)+H2O(g)△H。某温度下。在容积为 1L 的恒容密闭容器中,加入 一定氨碳比 3 2 n(NH ) n(CO )的 3molCO2 和 NH3 的混合气体。图 3 是有关量的变化曲线,其中表示 NH3 转化率的是曲线 (填“a”或“b”),曲线 c 表示尿素在平衡体系中的体积分数变化曲线,则 M 点的平衡常数 K= ,y= 。 27.( 14 分)二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶 受热发粘、遇冷变硬的性质。查阅资料可知 S2Cl2 具有下列性质: 物理性质 毒性 色态 挥发性 熔点 沸点 剧毒 金黄色液体 易挥发 -76℃ 138℃ 化学性质 ①300℃以上完全分解; ②S2Cl2+Cl2 2SCl2; ③遇高热或与明火接触,有引起燃烧的危险; ④受热或遇水分解放热,放出腐蚀性烟气; (1)制取少量 S2Cl2 实验室可利用硫与少量氯气在 110~140℃反应制得 S2Cl2 粗品。 ①仪器 m 的名称为___________,装置 F 中试剂的作用是__________。 ②装置连接顺序:A→_______________→E→D。 ③实验前打开 K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入 一段时间的氮气,其目的是_____________。 ④为了提高 S2Cl2 的纯度,实验的关键是控制好温度和_____________。 (2)S2Cl2 遇水强烈反应产生烟雾,该反应的化学方程式 2S2Cl2+2H2O=SO2↑+3S↓+4HCl↑ 甲同学为了验证两种气体产物,将水解生成的气体依次通过硝酸银与稀硝酸的混合溶液、品 红溶液、NaOH 溶液,该方案_________(填“可行”或“不可行”),原因是___________。 (3)某同学为了测定 S2Cl2 与水反应后生成的气体 X 在混合气体中的体积分数,设计了 如下实验方案: 混合气体V L (标准状况下) 溶液 固体m g ①W 溶液可以是____________(填标号)。 a.H2O2 溶液 b.KMnO4 溶液(硫酸酸化) c.氯水 ②该混合气体中气体 X 的体积分数为_____________(用含 V、m 的式子表示)。 过量 W 溶液 ① 过量 Ba(OH)2 溶液 ② 过滤、洗涤、干燥、称量 ③ 第 9 页 共 12 页 28.( 14 分)工业上用含三价钒(V2O3)为主的某石煤为原料(含有 Al2O3、CaO 等杂质), 钙化法焙烧制备 V2O5,其流程如下: 资料:+5 价钒在溶液中的主要存在形式与溶液 pH 的关系: pH 4~6 6~8 8~10 10~12 主要离子 VO2+ VO3— V2O74— VO43— (1)焙烧: 向石煤中加生石灰焙烧,将 V2O3 转化为 Ca(VO3)2 的化学方程式是_________。 (2)酸浸:①Ca(VO3)2 难溶于水,可溶于盐酸。若焙砂酸浸 时溶液的 pH=4,Ca(VO3)2 溶于盐酸的离子方程式是 ________。 ②酸度对钒和铝的溶解量的影响如图所示:酸浸时溶液 的酸度控 制在大约 3.2%,根据下图推测,酸浸时不选择更高酸度的原 因是________________。 (3)转沉: 将浸出液中的钒转化为 NH4VO3 固体,其流程 如下: ①浸出液中加入石灰乳的作用是_____________。 ②已知常温下 CaCO3 的溶度积常数为 Ksp1,Ca3(VO4)2 溶度积常数为 Ksp2。过滤后的 (NH4)3VO4 溶液中 VO43—的浓度为 c mol/L,该溶液中 CO32—的浓度为 mol/L ③向(NH4)3VO4 溶液中加入 NH4Cl 溶液,控制溶液的 pH=7.5。当 pH>8 时,NH4VO3 的 产量明显降低,原因是_______________。 (4)测定产品中 V2O5 的纯度:称取 ag 产品,先用硫酸溶解,得到(VO2)2SO4 溶液。再 加入 b1mLc1mol/L(NH4)2Fe(SO4)2 溶液(VO2++2H++Fe2+=VO2++Fe3++H2O) 最后用 c2mol/LKMnO4 溶液滴定过量的(NH4)2Fe(SO4)2 至终点,消耗 KMnO4 溶液的体积为 b2mL。 已知 MnO4-被还原为 Mn2+,假设杂质不参与反应。则产品中 V2O5 的质量分数是_____。(V2O5 的摩尔质量:182g/mol) 29.(10 分)ATP 合酶是一种功能复杂的蛋白质,与生物膜结合后能 催化 ATP 的合成,其作用机理如下图所示。请据图回答: (1)ATP 在细胞内的作用是__________________;分析此图可知 H+跨越该膜的运输方式是______。 (2)在真核细胞中,该酶主要分布于____________________(填生物 膜名称)。推测好氧型细菌细胞的________(填结构名称)存在该 酶,理由是____________________________。 (3)科学家发现,一种化学结构与 ATP 相似的物质——GTP(三磷酸鸟苷)也具有与 ATP 相似的 生理功能,请从化学结构的角度解释 GTP 也具有相似功能的原因:_____________________ _____________________________。 第 10 页 共 12 页 30.(10 分)石莼是一种常见的大型海藻,能将合成的酶分泌到细胞外,催化 HCO3-形成 CO2,然 后 CO2 被细胞吸收利用。如图表示将生长 状态一致的石莼分别培养在两种无机碳 (HCO3-)浓度下:2.2 mol/L(正常海水)、8.8 mol/L(高无机碳海水),然后在 20 ℃、30 ℃ 条件下分别测定其在这两种环境中的光合 速率。其中,光饱和点是指达到最大光合 速率时的最小光照强度。请回答下列问题: (1)该植物缺乏氮元素时会影响光合作用,原因是_____________________________。 (2)据图分析,在无机碳浓度为 2.2 mol/L,温度从 20 ℃升至 30 ℃时,石莼的最大光合速率 ________(填“升高”“降低”或“基本不变”),在此最大光合作用速率时,限制光合速率的环境因 素主要是_____________,判断依据是_____________________________。 (3)在无机碳浓度为 8.8 mol/L 的环境中,30 ℃条件下的光饱和点高于 20 ℃条件下的,依据本题 信息,结合光合作用过程,分析可能的原因是__________________________________________ _____________________________________________。 31.(9 分)有研究者对基因型为 EeXFY 的某动物精巢切片进行显微观察,绘制了图(Ⅰ)中三幅细胞 分裂示意图(仅表示出部分染色体);图 (Ⅱ)中细胞类型是划分依据是不同时期细胞中染色体数和 核 DNA 分子数的数量关系。回答下列问题: 甲 乙 丙 图(Ⅰ) 图(Ⅱ) (1)图(Ⅰ)中细胞甲的名称是 。若细胞乙产生的一个精细胞的基因组成 为 eXFY,则另外三个精细胞的基因组成为 。 (2)图(Ⅱ)中类型 b 的细胞对应图(Ⅰ)中的细胞有 。 图(Ⅱ)中类型 c 的细胞可能含有_____ 对同源染色体。 (3)着丝点分裂导致图(Ⅱ)中一种细胞类型转变为另一种细胞类型,其转变的具体情况有_____ ______ (用图中字母和箭头表述)。 (4)若图示动物与基因型为 EeXFXF 的个体交配,后代中与亲本表现型相同的个体所占的比例 是 。 32.(10 分)科研人员将某一长期种植单一品种茶树的茶园一分为二。对照组只种植原有单一品种 茶树,实验组均匀种植多种茶树品种,茶树密度与对照组相同。一段时间后,对两组茶园进行 相关生态调查。回答下列问题: (1)蜘蛛是茶园害虫的重要天敌,茶园游猎型蜘蛛分为地面游猎型和茶树上游猎型,影响蜘蛛 分布的主要因素是 。若要预测某种蜘蛛种群数量的变化趋势, 需要调查蜘蛛种群的 (填数量特征)。 (2)实验组蜘蛛物种数比对照组要多,据此推测,实验组茶园抵抗力稳定性更强,判断依据是 。 (3)茶园还能参与调节气候,这主要体现了茶园的 价值。 (4)调查发现,两组茶园茶树的落叶量大致相同,但一段时间后,实验组土壤中有机碳的含量 为 21.5 g/kg,对照组为 14.5 g/kg,出现这种结果的可能原因是 。 第 11 页 共 12 页 c a (二)选考题:共 45 分。请考生从 2 道物理题、2 道化学题、2 道生物题中每科任选一题作 答。如果多做,则每科按所做的第一题计分。 33.【物理——选修 3-3】( 15 分)(略) 34.【物理——选修 3-4】( 15 分) (1).(5 分)(填正确答案标号,选对一个得 2 分,选对 2 个得 4 分,选对 3 个得 5 分,每 选错一个扣 3 分,最低得分为 0 分)。 在某均匀介质中,甲、乙两波源位于 O 点和 Q 点,分别产生向右和向左传播的同性质简 谐横波,某时刻两波波形如图中实线和虚线所示,此时,甲波传播到 x=24m 处,乙波传播到 x=12m 处,已知甲波波源的振动周期为 0.4s,下列说法正确的是________。 A.甲波波源的起振方向为 y 轴正方向 B.甲波的波速大小为 20m/s C.乙波的周期为 0.6s D.甲波波源比乙波波源早振动 0.3s E.从图示时刻开始再经 0.6s,x=12m 处 的质点再次到达平衡位置 (2).(10)如图所示,真空中的半圆形透明介质,O1 为圆心,O O1 为 其对称轴,一束单色光沿平行于对称轴的方向射到圆弧面上,经两次折射 后由直径面离开介质。已知第一次折射的入射角和第二次折射的折射角均 为 60°,光在真空中的速度大小为 c,求: (i)透明介质的折射率 n; (ⅱ)单色光在介质中传播的时间 t. 35.【化学——选修 3:物质结构与性质】(15 分)第 23 号元素钒在地壳中的含量大约为 0.009%,在过渡元素中仅次于 Fe、Ti、Mn、Zn,排第五位。我国四川攀枝花地区蕴藏着极其 丰富的钒钛磁铁矿。 (1)钒在周期表中的位置为__________,电子占据的最高能层的轨道形状为__________。 (2)在地壳中含量最高的五种过渡金属元素 Fe、Ti、Mn、Zn、V 中,基态原子核外单 电子数最多的是__________。 (3)过渡金属可形成许多羰基配合物,即 CO 作为配体形成的配合物。 ①CO 的等电子体有 N2、CN-、__________(任写一个)等。 ②CO 作配体时,配位原子是 C 而不是 O,其原因是__________。 (4)过渡金属配合物常满足“18 电子规则”,即中心原子的价电子数加上配体提供的电子 数之和等于 18,如[Fe(CO)5]、[Mn(CO)5]-等都满足这个规则。 ①下列钒配合物中,钒原子满足 18 电子规则的是__________。 A.[V(H2O)6]2+ B.[V(CN)6]4- C.[V(CO)6]- D.[V(O2)4]3- ②化合物 的熔点为 138 ℃,其晶体类型为__________;已知该化合物满足 18 电子规则,其配体“ ”中的大 π 键可表示为__________。 (5)VCl2(熔点 1027 ℃)和 VBr2(熔点 827 ℃)均为六方晶胞,结构如图所示。 ①VCl2 和 VBr2 两者熔点差异的原因是__________。 ②设晶体中阴、阳离子半径分别为 r-和 r+,该晶体的空间利用率为 __________(用含 a、c、r+和 r-的式子表示)。 第 12 页 共 12 页 36.【化学——选修 5:有机化学基础】(15 分) 药物中间体 Q、医用材料 PVA 的合成路线如下。 已知: (1)A 的分子式是 C6H6,A→B 的反应类型是_______。 (2)B→C 是硝化反应,试剂 a 是_______。 (3)C→D 为取代反应,其化学方程式是_______。 (4)F 含有的官能团是________。 (5)F 的含有碳碳双键和酯基的同分异构体有_____种(含顺反异构体,不含 F),其中 核磁共振氢谱有 3 组吸收峰,且能发生银镜反应的结构简式是___. (6)G→X 的化学方程式是________。 (7)W 能发生聚合反应,形成的高分子结构简式是________。 (8)将下列 E +W→Q 的流程图补充完整(在虚线框内写出物质的结构简式):_________ 37.【生物——选修 1:生物技术实践】(15 分) 急性肠胃炎是由细菌通过消化道进入人体导致的。因此检验饮用水的细菌含量是有效监控 疾病发生的必要措施,请回答下列与检验饮用水有关的问题: (1)配制牛肉膏蛋白胨固体培养基的基本步骤:计算→称量→溶化→灭菌→ 。 (2)检验大肠杆菌的含量时,通常将水样进行一系列的梯度稀释,然后将不同稀释度的水样用 涂布器分别涂布到琼脂固体培养基的表面进行培养,记录菌落数量,这种接种方法称 为 。 (3)用该方法统计样本菌落数时是否需要设置对照组 ,为什么? 。 (4)如分别取 0.1 mL 已稀释 102 倍的水样分别涂布到三个琼脂固体培养基的表面进行培养,培 养基记录到大肠杆菌的菌落数分别为 52、55、58,则每升原水样中大肠杆菌数 为 。 与用显微镜直接计数法相比,此计数方法测得的细菌数目较 (填“多”或 “少”)。 (5)已知大肠杆菌能发酵乳糖并产酸产气,现提供足量的已灭菌的乳糖蛋白胨培养液和具塞试 管,应如何判断待检水样中是否含有大肠杆菌?请写出大致的实验思路。 。 38.【生物——选修 3:现代生物科技专题】( 15 分) 南山中学 2020 年春季级高 2017 级网络统考 生物答案 2017 级 班 学生 选择题 1 2 3 4 5 6 得分 答 案 D B B A A C 29.(10 分,除特殊标注外,每空 2 分) (1)生命活动的直接能源物质 协助扩散(1 分) (2)线粒体内膜、类囊体薄膜 细胞膜 (1 分) 该酶与生物膜结合后能催化 ATP 的合成,而好氧型细菌的膜结构只有细胞膜 (3)含有两个高能磷酸键,远离鸟苷的高能磷酸键容易水解断裂,释放能量 30.(10 分,除特殊标注外,每空 2 分) (1)氮是叶绿素和多种酶的组成元素 (2)升高(1 分) 无机碳浓度(或 CO2 浓度) 升高无机碳浓度后,石莼的最大光合速率升高 (3)随着温度升高,酶活性升高,催化 HCO3 -形成 CO2 多,叶绿体固定 CO2 产生的 C3 更多,需要光反 应产物 ATP、[H]多,所以光照强度要求更高(3 分) 31. (9 分,除特殊标注外,每空 1 分) (1)次级精母细胞 E、E、eXFY (2)乙和丙 0 或 n (2 分) (3)b→a、d→c (2 分) (4)3/4 (2 分) 32. (10 分,每空 2 分) (1)食物条件和栖息空间 年龄组成(年龄结构) (2)实验组茶园动植物种类多,食物网更复杂,自我调节能力更强,抵抗力稳定性更强 (3)间接 (4)实验组茶树落叶种类更多,(但长期种植单一品种茶树)土壤中分解者种类单一,有机碳分解 速率较慢 37. (15 分,除特殊标注外,每空 2 分) (1)倒平板 (2)稀释涂布平板法 (3)需要 因为需要判断培养基是否被杂菌污染(培养基灭菌是否合格) (4)5.5×107 少 (5)通过无菌操作向试管内注入一定量待检水样,再注入已灭菌的乳糖蛋白胨培养液将试管充满, 塞上塞子,混匀后置于 37 ℃恒温箱培养 24 h。若试管内有气泡生成,则说明水样中有大肠杆菌。 (3 分)(也可以用 PH 试纸检测 PH 变化) 绵阳南山中学 2020 年春季高 2017 级入学考试化学 参考答案 题号 7 8 9 10 11 12 13 答案 A D C C C A B 26.(15 分) (1)CO2(g)+ 3H2(g)=CH3OH(l)+H2O(1)△H=-131.0 kJ·mol-1(2 分) (2)>(1 分) 增大(1 分) 向逆反应方向(2 分) (3)250(1 分) 增大反应体系的压强或增大 CO2 的浓度或使 CH3COOH 液化抽离等 (答案合理即可,2 分) (4)b 20 36.4(各 2 分) 27.(14 分)(1)①三颈烧瓶(1 分); 除去 Cl2 中混有的 HCl 杂质 (1 分) ②FCB(1 分) ③将装置内的氯气排入 D 内吸收以免污染空气,并将 B 中残留的 S2Cl2 排入 E 中 收集(2 分) ④滴入浓盐酸的速率(或 B 中通入氯气的量) (2 分) (2) 不可行 (1 分) 二氧化硫被硝酸氧化成硫酸根,既难于检验二氧化硫又干扰氯化氢检验(2 分)(3) ① ac (2 分) ② 22.4m 233V ×100% (2 分) 28(14 分)(1)CaO+O2+V2O3 = 高温 Ca(VO3)2 (2 分) (2)① Ca(VO3)2+4H+=2 2VO+ +Ca2++2H2O (2 分) ②酸度大于 3.2%时,钒的溶解量增大不明显,而铝的溶解量增大程度更大 (2 分) (3)①调节溶液的 pH,并提供 Ca2+,形成 Ca3(VO4)2 沉淀 (2 分) ② 2 31 2 SP SP CK K· (2 分) ③当 pH>8 时,钒的主要存在形式不是 - 3VO (2 分) (4) ( )1 1 2 291 b c -5b c 100%1000a ´ (2 分) 35.(15 分)(1)第四周期第 VB 族(1 分) 球形(1 分)(2)Mn (1 分) (3) ①NO+、 (1 分) ②C 的电负性小于 O,对孤电子对吸引能力弱,给出电子对更容易(2 分) (4) ①C(2 分) ②分子晶体(1 分); (2 分) (5) ①两者均为离子晶体,Cl- 半径小于 Br-半径,VCl2 中晶格能大于 VBr2,故 VCl2 熔点高于 VBr2(2 分) ② (2 分) 36.(15 分)(1)取代反应(1 分) (2)浓硫酸、浓硝酸(1 分) (3) (2 分) (4) 碳碳双键、酯基 (1 分) (5)5(2 分); CH2=C(CH3)OOCH(2 分) (6) (2 分) (7) (2 分) (8) (1 分) (1 分)查看更多