- 2021-05-14 发布 |
- 37.5 KB |
- 15页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学化学电源考点的一轮复习案例参考
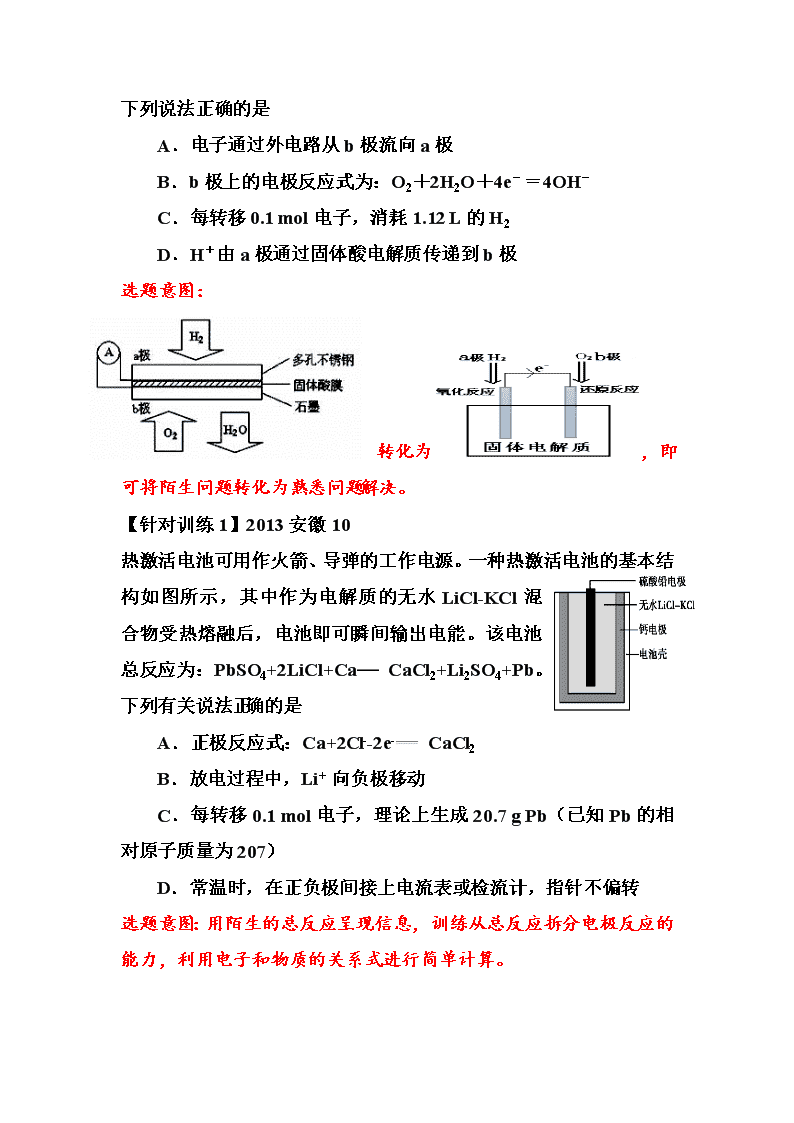
全国卷“化学电源”考点的一轮复习案例参考 片段1:原电池概念复习和模型建立 【学生思考与交流】 反应 Zn + Cu2+==Zn2+ + Cu 1、电化学装置 请用最简单的电化学装置实现以上反应,画出装置图并作必要的标注。 2、基本概念 (1)在图中标出正、负极,并写出电极方程式: (2)在图中标出电子、电流、离子的移动方向。 3、问题拓展 (1)反应一段时间后,正极增重12.8g,则电路中共转移了多少电子?(相对原子质量:Cu 64 Zn 65) (2)请将上述装置改造成含盐桥的双池原电池,画出装置图并简述改进后的好处。 【归纳与梳理】 1、 电池反应的拆分: 2、 电池装置的一般模型: 【应用与强化】利用模型解决陌生化学电源的分析和判断 【例1】2013海南04 Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为:2AgCl+Mg=Mg2++2Ag+2Cl-。有关该电池的说法正确的是 A.Mg为电池的正极 B.负极反应为AgCl+e-=Ag+Cl- C.不能被KCl溶液激活 D.可用于海上应急照明供电 选题意图:用陌生的总反应呈现信息,训练从总反应拆分电极反应的能力。 【例2】2015国乙11 微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是 A.正极反应中有CO2生成 B.微生物促进了反应中电子的转移 C.质子通过交换膜从负极区移向正极区 D.电池总反应为C6H12O6 + 6O2 ═ 6CO2 + 6H2O 选题意图:用图示呈现反应物,学生需先找出隐含的总反应:C6H12O6 + 6O2 ═ 6CO2 + 6H2O再进行判断,质子交换膜限定了粒子的迁移方向和提示了电解质环境。 【例3】2010安徽11 某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2+O2=2H2 O,下列说法正确的是 A.电子通过外电路从b极流向a极 B.b极上的电极反应式为:O2+2H2O+4e-=4OH- C.每转移0.1 mol电子,消耗1.12 L的H2 D.H+由a极通过固体酸电解质传递到b极 选题意图: 转化为,即可将陌生问题转化为熟悉问题解决。 【针对训练1】2013安徽10 热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca CaCl2+Li2SO4+Pb。下列有关说法正确的是 A.正极反应式:Ca+2Cl--2e- CaCl2 B.放电过程中,Li+ 向负极移动 C.每转移0.1 mol电子,理论上生成20.7 g Pb(已知Pb的相对原子质量为207) D.常温时,在正负极间接上电流表或检流计,指针不偏转 选题意图:用陌生的总反应呈现信息,训练从总反应拆分电极反应的能力,利用电子和物质的关系式进行简单计算。 【针对训练2】2013江苏09 Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是 A.Mg电极是该电池的正极 B.H2O2在石墨电极上发生氧化反应 C.石墨电极附近溶液的pH增大 D.溶液中Cl-向正极移动 选题意图:用图示呈现信息,从物质化合价的变化判断反应和正负极,套用原电池模型解题。 【针对训练3】2011福建11 研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。关于该电池的下列说法不正确的是 A.水既是氧化剂又是溶剂 B.放电时正极上有氢气生成 C.放电时OH-向正极移动 D.总反应为:2Li+2H2O===2LiOH+H2↑ 选题意图:结合题干信息得到氧化还原反应2Li+2H2O===2LiOH+H2↑,即为电池总反应,套用原电池模型即可迅速选出答案。 【针对训练4】2013国甲11 “ZEBRA”蓄电池的结构如图所示,电极材料多孔Ni/NiCl2和金属钠之间由钠离子导体制作的陶瓷管相隔。下列关于该电池的叙述错误的是 A.电池反应中有NaCl生成 B.电池的总反应是金属钠还原三价铝离子 C.正极反应为:NiCl2 + 2e-= Ni + 2Cl- D.钠离子通过钠离子导体在两电极间移动 选题意图:根据图示呈现的多种物质,可寻找到Na→Na+、NiCl2→Ni两组有价态变化的的电极反应,套用相关概念即可迅速做出判断。 【小结】 1、新颖的情景像“纸老虎”,透过现象看本质,考查的内容离不开对氧化还原反应的分析和原电池模型的套用; 2、对陌生的装置学会进行适当的转化方便分析。 片段2:电极反应的书写方法 【学生思考与交流】 反应 H2+O2=2H2O 1、电化学装置 2、电极反应式 负极: 正极: 3、问题拓展 (1)若电解质溶液改为KOH溶液,对电极反应有影响吗? (2) 若电解质改为能传导O2-的固态电解质,电极反应又有何不同? 【归纳提升】电极反应式书写的方法和注意事项 方法一:直接书写,相加验证 方法二:先写较易的,总式-正/负极 特别注意:电极反应中出现的微粒应在电解质中能稳定存在。 【巩固与强化】 【例1】2011国标27 在直接以甲醇为燃料的燃料电池中,电解质溶液为酸性,负极的反应式为 、正极的反应式为 。 思考:若电解质溶液改为碱性,正、负极反应式会有什么变化? 答案:CH3OH +H2O-6e-= CO2 +6H+;3/2O2 +6H+ +6e-= 3H2O 电解质溶液改为碱性,负极:2CH3OH +16OH--12e-= 2CO32-+12H2O;正极:3O2 +6H2O +12e-= 12OH- 选题意图:书写较为复杂的燃料电池的电极反应,让学生体会两种不同的书写方法,采用总反应-正极反应的方式较易得出负极反应;增加了碱性电解质溶液的思考题,促使学生体会电解质环境对书写电极反应和总反应的影响。 【例2】2012海南13 (4)肼(N2H4)—空气燃料电池是一种碱性电池,该电池放电时, 负极的反应式为 (已知产物无毒无害) 。 选题意图:反应物比较陌生,产物根据信息和价态变化可推断为N2,训练学生用氧化还原知识直接书写电极反应的能力。 【例3】某化学兴趣小组构想将NO转化为HNO3,装置如右图,电极为多孔惰性材料。则负极的电极反应式是 。 选题意图:用图示呈现信息,学生要结合质子交换膜的作用和氮元素价态的变化书写陌生的电极反应。 【针对训练1】甲烷—空气燃料电池(电解质溶液为KOH溶液)是一种常见的电源,负极反应式为 。 【针对训练2】铝—空气燃料电池通常以NaOH溶液为电解液,负极反应式为 。 【针对训练3】2012国标26 (4)与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为________,该电池总反应的离子方程式为_____。 【针对训练4】2015四川11 (5) FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li + FeS2 = Fe + 2Li2S,正极反应式是 。 【针对训练5】2012江苏20 (3)铝电池性能优越,AlAgO电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为 。 【针对训练6】2015广东32 (5)一种可超快充电的新型铝电池,充放电时AlCl4-和Al2Cl7-两种离子在Al电极上相互转化,其它离子不参与电极反应,放电时负极Al的电极反应式为 。 片段3:可充电电池 【学生思考与交流】以铅蓄电池为例,反应为Pb+PbO2+2H2SO42PbSO4+2H2O 放电 充电 电极 电极反应式 电极反应式 连接方式 铅蓄电池标“—”一端 极 接外电源 的 极 铅蓄电池标“ + ”一端 极 接外电源 的 极 【小结】充电电池放电时的正负极和充电时的阴阳极有何对应关系?其电极方程式又有何关系? 【意图说明】通过对典型可充电电池——铅酸蓄电池的深入分析,使学生能够清晰了解充电和放电时总反应和电极反应之间的联系,学会从反应类型的角度来加深理解而不是死记硬背。 【例1】2011国标11 铁镍蓄电池又称爱迪生电池,放电时的总反应为Fe+Ni2O3+3H2O===Fe(OH)2+2Ni(OH)2下列有关该电池的说法不正确的是 A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe B.电池放电时,负极反应为Fe+2OH--2e-===Fe(OH)2 C.电池充电过程中,阴极附近溶液的pH降低 D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-===Ni2O3+3H2O 选题意图:所给反应陌生的,但一套用铅酸蓄电池的概念又可以转化为熟悉的问题。 【例2】2009浙江12 市场上经常见到的标记为Li-ion的电池称为“锂离子电 池”。它的负极材料是金属锂和碳的复合材料(碳作为金锂的载体),电解质为一种能传导Li+的高分子材料。这种锂离子电池的电池反应式为: Li+2Li0.35NiO22Li0.85NiO2,下列说法不正确的是 A.放电时,负极的电极反应式:Li-e-=Li+ B.充电时,Li0.85NiO2既发生氧化反应又发生还原反应 C.该电池不能用水溶液作为电解质 D.放电过程中Li+向负极移动 选题意图:反应陌生,化学式中出现非整数下标,但可从熟悉的Li元素入手判断价态变化,放电时Li元素价态升高,Ni元素价态降低。 【例3】2014天津06 已知:锂离子电池的总反应为:LixC+Li1-xCoO2C+LiCoO2,锂硫电池的总反应2Li+SLi2S。有关上述两种电池说法正确的是 A.锂离子电池放电时,Li+向负极迁移 B.锂硫电池充电时,锂电极发生还原反应 C.理论上两种电池的比能量相同 D.下图表示用锂离子电池给锂硫电池充电 选题意图:反应陌生,题干和图示呈现多种信息,学生套用可充电电池的相关知识解题。分析锂离子电池时,引导学生从容易判断的Li元素的价态变化入手,推断C和Co元素的价态变化。选项C中涉及比能量的概念,可引导学生回顾选修4课本P74的表述。 【针对训练1】2008江苏05 镍镉(Ni-Cd)充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充放电按下式进行:Cd + 2NiOOH + 2H2OCd(OH)2 (s)+ 2Ni(OH)2(s),有关该电池的说法正确的是 A.充电时阳极反应:Ni(OH)2 -e— + OH- ==NiOOH + H2O B.充电时该电池的负极质量增加 C.放电时负极附近溶液的碱性不变 D.放电时电解质溶液中的OH-向正极移动 【针对训练2】2008广东16 LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为FePO4+LiLiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。下列有关LiFePO4电池说法正确的是(双选) A.可加入硫酸以提高电解质的导电性 B.放电时电池内部Li+向负极移动 C.充电过程中,电池正极材料的质量减少 D.放电时电池正极反应:FePO4+Li++e-===LiFePO4 【针对训练3】2014 浙江11 镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中的总反应方程式是:Ni(OH)2 + M = NiOOH + MH 已知:6NiOOH + NH3 + H2O + OH-=6 Ni(OH)2 + NO2- 下列说法正确的是 A.NiMH 电池放电过程中,正极的电极反应式为:NiOOH + H2 O + e-= Ni(OH)2 + OH- B.充电过程中OH-离子从阳极向阴极迁移 C.充电过程中阴极的电极反应式:H2O + M + e-= MH + OH-,H2O中的H被M还原 D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液 【针对训练4】2011海南06 一种充电电池放电时的电极反应为 H2+2OH—-2e-=2H2O; NiO(OH)+H2O+e-=Ni(OH)2+OH- 当为电池充电时,与外电源正极连接的电极上发生的反应是 A.H2O的还原 B.NiO(OH)的还原 C.H2的氧化 D. Ni(OH) 2的氧化 【针对训练5】2014国甲12 2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。下列叙述错误的是 A.a为电池的正极 B.电池充电反应为LiMn2O4=Li1-xMn2Ox+xLi C.放电时,a极锂的化合价发生变化 D.放电时,溶液中Li+从b向a迁移 片段4:电化学的综合计算 这类题目是全国卷与广东卷最不相同的地方,学生通过物理的学习已经具备以下知识:电量、电功的计算公式,不同单位之间的换算,为帮助学生解决这类题目,化学教师要做的工作是促使学生搭建反应物、生成物、转移电子数与电量之间的关系,其余的交给学生自行解决。 【例题】2015国甲26 酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是由碳粉、MnO2、ZnCl2和NH4Cl等组成的糊状填充物。该电池放电过程产生MnOOH,回收处理该废电池可以得到多种化工原料, 回答下列问题: (1)该电池的正极反应式为 ,电池反应的离子方程式为: 。 (2)维持电流强度为 0.5A,电池工作5分钟,理论上消耗锌 g。(已知F= 96500C·mol-1) 答案:(1)MnO2+e—+H+=MnOOH;Zn+2MnO2+2H+=Zn2++2MnOOH(注:式中Zn2+可写为Zn(NH3)42+、Zn(NH3)2Cl2等,H+可写为NH4+) (2) 0.05g 【小结】通过法拉第常数F=96500 C·mol-1建立电子的n(物质的量)与电量的联系,就可以求电功,或者由电功或电量反过来求电子的物质的量,再进一步结合电极反应方程式,求得对应物质的质量或物质的量。 【针对训练1】2012海南16 新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2 ,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。 回答下列问题: (1)甲烷燃料电池正极、负极的电极反应分别为 、 。 (2)闭合K开关后,a、b电极上均有气体产生.其中b电极上得到的是 ,电解氯化钠溶液的总反应方程式为 ; (3)若每个电池甲烷通入量为1 L(标准状况),且反应完全,则理论上通过电解池的电量为 (法拉第常数F=9.65×l04C.mol-1, 列式计算),最多能产生的氯气体积为 L(标准状况)。 答案:(1)O2+2H2O +4e—=4OH—,CH4+10OH--8e—=CO32-+ 7H2O; (2)H2;2NaCl+2H2O2NaOH+ H2↑+ Cl2↑; (3)(1L/22.4L.mol-1)×8×9.65× 104C.mol-1 =3.45×104C;4。 【针对训练2】2013国乙28 (5)二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度等于甲醇直接燃料电池(5.93kW•h•kg-1)。若电解质为酸性,二甲醚直接燃料电池的负极反应为 ,一个二甲醚分子经过电化学氧化,可以产生 个电子的能量;该电池的理论输出电压为1.20V,能量密度E = (列式计算。能量密度=电池输出电能/燃料质量,1 kW•h = 3.6×106J)。 答案:(5)CH3OCH3 + 3H2O = 2CO2 + 12H+ + 12e- 12 查看更多