- 2021-11-07 发布 |
- 37.5 KB |
- 6页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
呼和浩特专版2020中考化学复习方案阶段测试03C金属和金属材料试题
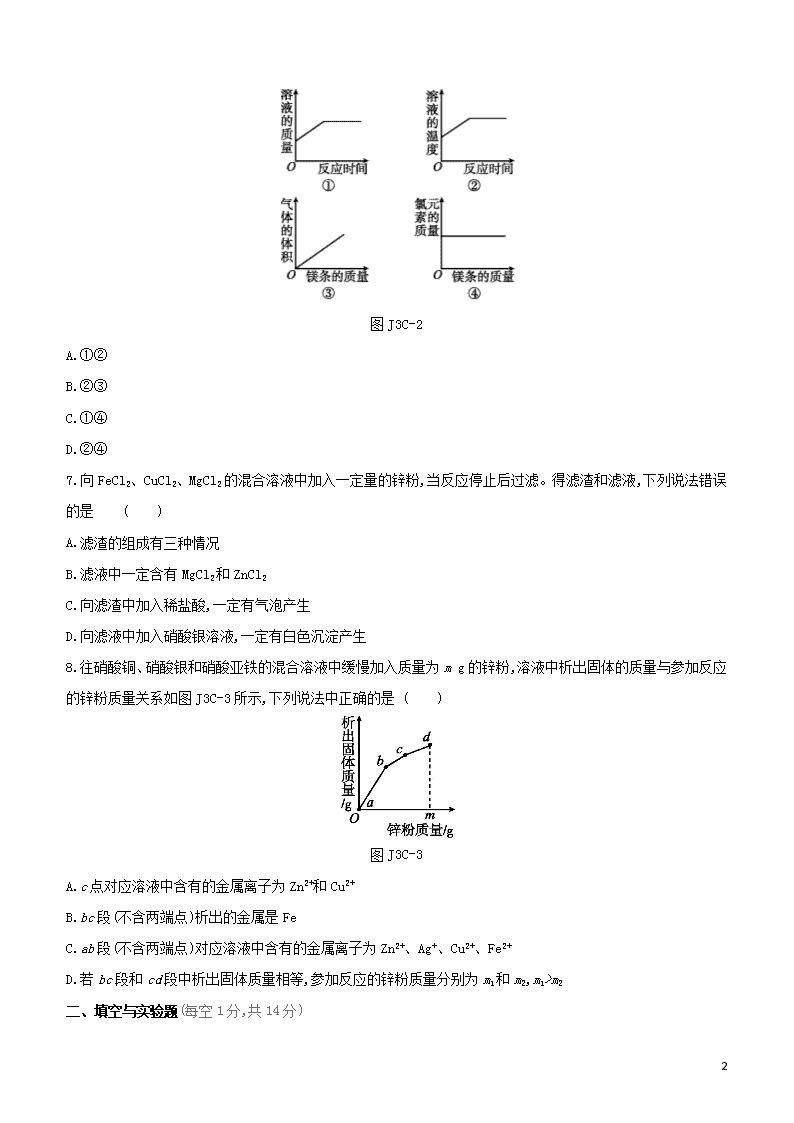
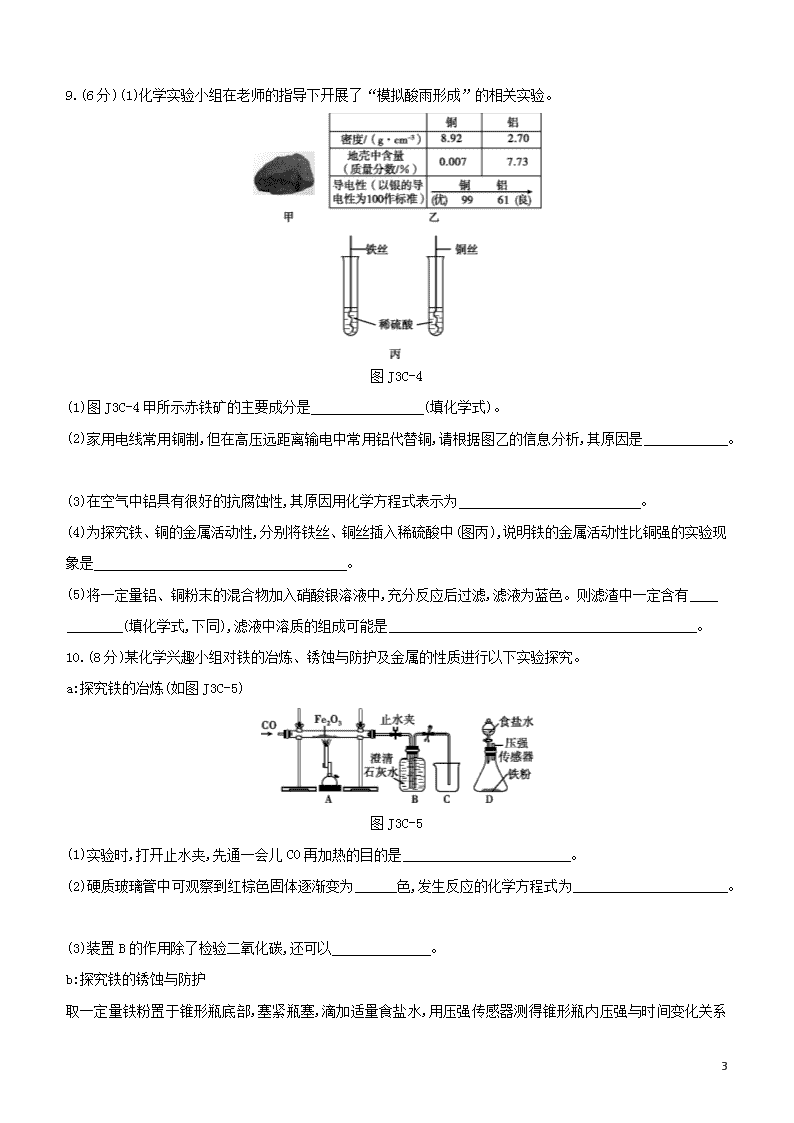
阶段测试(三)C 金属和金属材料 时间:30分钟 满分:50分 可能用到的相对原子质量:Fe—56 Cu—64 Zn—65 Ag—108 一、选择题(每题4分,共32分) 1.铜能被加工成7 μm厚的超薄铜箔,说明铜具有良好的 ( ) A.导电性 B.导热性 C.延展性 D.耐酸性 2.下列有关“金属之最”的描述中,属于金属物理性质的是 ( ) A.钙是人体中含量最多的金属元素 B.铁是世界年产量最高的金属 C.铝是地壳中含量最多的金属元素 D.银是最好的导电导热金属 3. 黄铜是铜与锌的合金,下列关于黄铜的说法正确的是 ( ) A.比纯铜耐腐蚀 B.加热不与空气反应 C.硬度小于纯铜 D.可以完全溶解在稀盐酸中 4.小明笔记中有一处错误,你认为是图J3C-1中的哪一处 ( ) 图J3C-1 A.a处 B.b处 C.c处 D.d处 5.某同学在探究X、Y、Z三种金属的活动性顺序时,做了如下实验:①把X和Y分别放入稀硫酸中,X表面产生大量气泡,Y表面无明显现象;②将Y放入Z的硝酸盐溶液中,Y表面有Z析出。下列金属活动性由强到弱的顺序正确的是 ( ) A.Z>Y>X B.X>Z>Y C.X>Y>Z D.Y>Z>X 6.常温下向一定质量的稀盐酸中逐渐加入镁,充分反应(忽略挥发)。下列图像正确的是 ( ) 6 图J3C-2 A.①② B.②③ C.①④ D.②④ 7.向FeCl2、CuCl2、MgCl2的混合溶液中加入一定量的锌粉,当反应停止后过滤。得滤渣和滤液,下列说法错误的是 ( ) A.滤渣的组成有三种情况 B.滤液中一定含有MgCl2和ZnCl2 C.向滤渣中加入稀盐酸,一定有气泡产生 D.向滤液中加入硝酸银溶液,一定有白色沉淀产生 8.往硝酸铜、硝酸银和硝酸亚铁的混合溶液中缓慢加入质量为m g的锌粉,溶液中析出固体的质量与参加反应的锌粉质量关系如图J3C-3所示,下列说法中正确的是 ( ) 图J3C-3 A.c点对应溶液中含有的金属离子为Zn2+和Cu2+ B.bc段(不含两端点)析出的金属是Fe C.ab段(不含两端点)对应溶液中含有的金属离子为Zn2+、Ag+、Cu2+、Fe2+ D.若bc段和cd段中析出固体质量相等,参加反应的锌粉质量分别为m1和m2,m1>m2 二、填空与实验题(每空1分,共14分) 6 9.(6分)(1)化学实验小组在老师的指导下开展了“模拟酸雨形成”的相关实验。 图J3C-4 (1)图J3C-4甲所示赤铁矿的主要成分是 (填化学式)。 (2)家用电线常用铜制,但在高压远距离输电中常用铝代替铜,请根据图乙的信息分析,其原因是 。 (3)在空气中铝具有很好的抗腐蚀性,其原因用化学方程式表示为 。 (4)为探究铁、铜的金属活动性,分别将铁丝、铜丝插入稀硫酸中(图丙),说明铁的金属活动性比铜强的实验现象是 。 (5)将一定量铝、铜粉末的混合物加入硝酸银溶液中,充分反应后过滤,滤液为蓝色。则滤渣中一定含有 (填化学式,下同),滤液中溶质的组成可能是 。 10.(8分)某化学兴趣小组对铁的冶炼、锈蚀与防护及金属的性质进行以下实验探究。 a:探究铁的冶炼(如图J3C-5) 图J3C-5 (1)实验时,打开止水夹,先通一会儿CO再加热的目的是 。 (2)硬质玻璃管中可观察到红棕色固体逐渐变为 色,发生反应的化学方程式为 。 (3)装置B的作用除了检验二氧化碳,还可以 。 b:探究铁的锈蚀与防护 取一定量铁粉置于锥形瓶底部,塞紧瓶塞,滴加适量食盐水,用压强传感器测得锥形瓶内压强与时间变化关系 6 如图J3C-6所示: 图J3C-6 (1)实验中食盐水的作用是 。 (2)锥形瓶内压强下降的原因是 。 (3)自行车钢圈当今多采用铝合金,是利用了铝合金的 (写1条即可)。 c:探究铁、铜的活动性强弱 将形状、大小相同的铁、铜分别放入装有等质量等浓度的X溶液的2支试管中,通过观察现象即能得出实验结论。则X溶液可能是 。 A.稀硫酸 B.硫酸铜溶液 C.硫酸锌溶液 三、实验题(每空1分,共4分) 11.化学兴趣小组同学将一枚洁净的铁钉放入食盐水中(如图J3C-7所示,装置气密性良好),一段时间后,发现装置中右侧导管中的液面升高,铁钉生锈,试管底部有黑色固体物质。 图J3C-7 提出问题导管中液体为何升高?黑色固体物质是什么? 猜想与假设该黑色固体可能含有①Fe、②Fe2O3、③FeCl3、④C四种物质。 猜想分析(1)影响右侧导管中液面升高的原因是 。 (2)不可能含有氯化铁,理由是 。 (3)一定含有碳,理由是 。 实验验证检验黑色固体中是否含有铁的实验方法是 。 6 【参考答案】 1.C [解析]铜属于金属单质,金属单质一般都具有良好的延展性,故能被加工成7 μm厚的超薄铜箔。 2.D 3.A [解析]合金比组成它的纯金属耐腐蚀性强;黄铜中铜、锌在空气中加热均能与氧气发生反应;合金的硬度大于组成它的纯金属,因此,黄铜的硬度大于纯铜;黄铜中铜与稀盐酸不反应,锌与稀盐酸反应生成氯化锌和氢气,故黄铜能部分溶解在稀盐酸中。 4.B [解析]一氧化碳是还原剂,发生的是氧化反应,不是还原反应。 5.C [解析]①把X和Y分别放入稀硫酸中,X表面产生大量气泡,Y表面无现象,说明X在氢前,Y在氢后;②把Y放入Z的硝酸盐溶液中,Y表面有Z析出,说明了Y排在Z的前边,即三种金属的活动性顺序为X>Y>Z。 6.C [解析]常温下向一定质量的稀盐酸中逐渐加入镁,则镁与盐酸反应生成氯化镁和氢气,溶液的质量不断增加,直至盐酸反应完全,溶液的质量不再增加;金属与酸的反应是放热反应,溶液的温度逐渐升高,当反应完,会恢复到原温度;当盐酸反应完后,气体的体积不再增大;化学反应前后元素的质量不变,故氯元素的质量不变。 7.C [解析]向FeCl2、CuCl2、MgCl2的混合溶液中加入一定量的锌粉,如果锌粉少量,只能置换出铜,滤渣为铜,如果锌粉再多一点能置换出铁和铜,滤渣为铁和铜的混合物,如果锌粉过量,滤渣为铁、铜、锌的混合物;镁的金属活动性大于锌,所以锌不能置换出镁,溶液中必有MgCl2,由于锌的金属活动性大于铜和铁,因此锌一定能置换铜和铁,故滤液中一定有生成的ZnCl2;如果锌粉少量,只能置换出铜,滤渣为铜,则向滤渣中加入稀盐酸,不会有气泡产生;不论金属锌如何置换其他金属,溶液中的氯离子始终存在,因此向滤液中加入硝酸银溶液,一定有白色沉淀氯化银产生。 8.C [解析]本题主要考查金属活动性顺序及其应用。四种金属的活动性:锌>铁>铜>银,活动性强的金属可以把活动性弱的金属从其盐溶液中置换出来,在反应中,最不活泼的金属最先析出,以此类推,最活泼的金属留在溶液中,所以由图示可知,ab段(不含两端点)析出的金属是银,bc段(不含两端点)析出的金属是铜,cd段(不含两端点)析出的金属是铁,所以c点时金属铜完全析出,溶液中含有的金属离子为Zn2+和Fe2+;ab段(不含两端点)析出的金属是银,溶液含有的金属离子有Zn2+、Ag+、Cu2+、Fe2+; Zn+Fe(NO3)2Zn(NO3)2+Fe 65 56 Zn+Cu(NO3)2Zn(NO3)2+Cu 65 64 由化学方程式中等质量的锌完全反应置换出铜的质量多于铁可知,当置换出相等质量的铜和铁时消耗的锌的质量是铁多于铜,所以m1查看更多
相关文章
- 当前文档收益归属上传用户