- 2021-11-06 发布 |
- 37.5 KB |
- 5页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
九年级化学下册第八单元金属和金属材料课题2金属的化学性质第1课时金属的化学性质课堂练习(附解析新人教版)
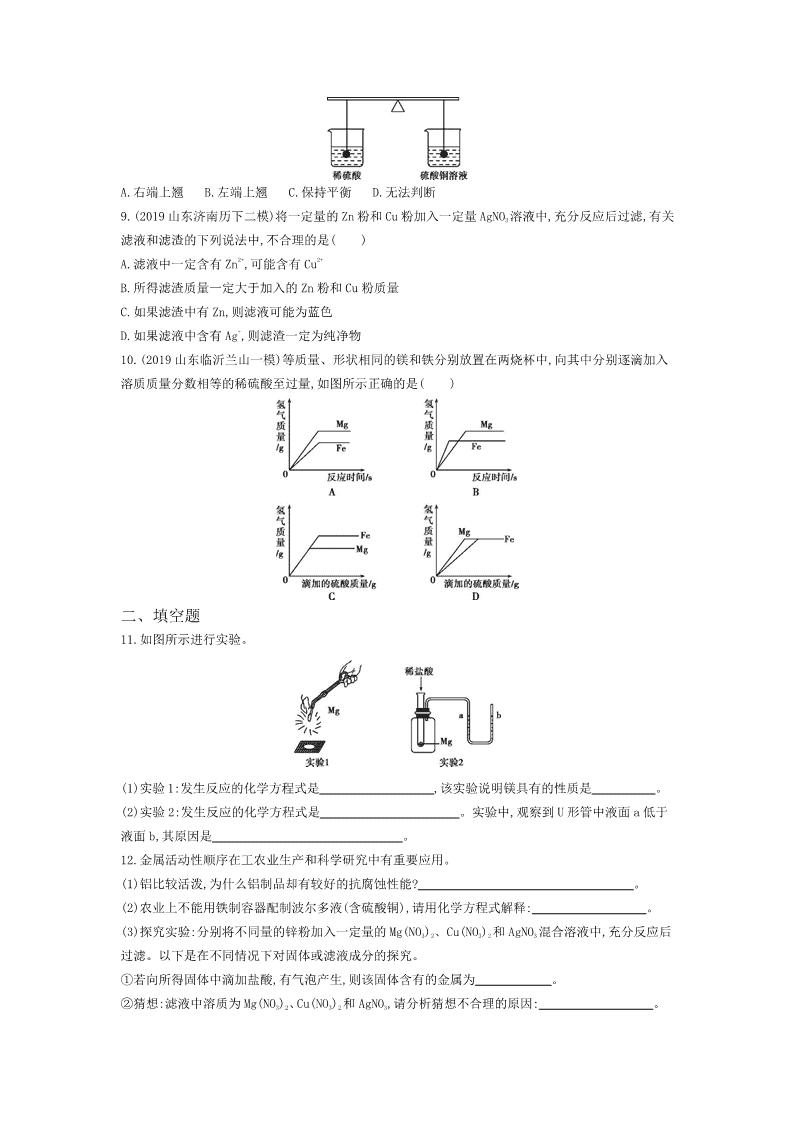
初中化学·人教版·九年级下册——第八单元 金属和金属材料 课题 2 金属的化学性质 第 1 课时 金属的化学性质 测试时间:35 分钟 一、选择题 1.(2019 江苏扬州江都一模)下列物质不能由金属与稀盐酸直接反应得到的是( ) A.氯化镁 B.氯化银 C.氯化亚铁 D.氯化锌 2.下列反应属于置换反应的是( ) A.CO+CuO Cu+CO2 B.H2CO3 CO2↑+H2O C.CH4+2O2 CO2+2H2O D.C+H2O(气) CO+H2 3.下列关于金属与氧气反应的说法中正确的是 ( ) A.所有的金属在常温下都能与氧气反应 B.金属与氧气反应都必须点燃或加热 C.镁只有点燃时才与空气中的氧气反应 D.“真金不怕火炼”说明即使在高温下金也不与氧气反应 4.下列关于金属的说法中,错误的是( ) A.铜有良好的导电性,常用于制作导线 B.不是所有的金属都能与稀盐酸反应 C.铁与稀盐酸反应生成氯化铁和氢气 D.不能用铁桶盛放硫酸铜溶液 5.已调平的托盘天平两边各放一个等质量的烧杯,向烧杯中倒入质量相等、溶质质量分数也相等的足 量的稀硫酸,然后在左边的烧杯中放入一定质量的铁粉,同时在右边的烧杯中放入等质量的锌粉,在反 应过程中天平指针的偏转情况为( ) A.先左后右 B.先右后左 C.不偏转 D.无法确定 6.(2019 湖南邵阳新宁模拟)下列关于实验现象的描述不正确的是( ) A.镁条在空气中燃烧,发出耀眼的白光 B.细铁丝在氧气里剧烈燃烧,火星四射,生成黑色固体物质 C.将铝丝插入硫酸铜溶液中,溶液的颜色由蓝色逐渐变浅甚至变为无色 D.将铜丝放入一定量的稀盐酸中,产生大量的气泡 7.(2019 河南平顶山二模)由两种金属组成的混合物共 40 g,与足量稀盐酸充分反应后,共放出 2 g 氢 气。则原混合物的组成不可能是( ) A.Zn 和 Fe B.Fe 和 Mg C.Zn 和 Mg D.Al 和 Cu 8.如图所示,在等臂杠杆两端各系一个等质量的铁球,调平后将它们分别浸没在稀H2SO4和 CuSO4溶液中, 一段时间后,杠杆将会( ) A.右端上翘 B.左端上翘 C.保持平衡 D.无法判断 9.(2019 山东济南历下二模)将一定量的 Zn 粉和 Cu 粉加入一定量 AgNO3 溶液中,充分反应后过滤,有关 滤液和滤渣的下列说法中,不合理的是( ) A.滤液中一定含有 Zn2+,可能含有 Cu2+ B.所得滤渣质量一定大于加入的 Zn 粉和 Cu 粉质量 C.如果滤渣中有 Zn,则滤液可能为蓝色 D.如果滤液中含有 Ag+,则滤渣一定为纯净物 10.(2019 山东临沂兰山一模)等质量、形状相同的镁和铁分别放置在两烧杯中,向其中分别逐滴加入 溶质质量分数相等的稀硫酸至过量,如图所示正确的是( ) 二、填空题 11.如图所示进行实验。 (1)实验 1:发生反应的化学方程式是 ,该实验说明镁具有的性质是 。 (2)实验 2:发生反应的化学方程式是 。实验中,观察到 U 形管中液面 a 低于 液面 b,其原因是 。 12.金属活动性顺序在工农业生产和科学研究中有重要应用。 (1)铝比较活泼,为什么铝制品却有较好的抗腐蚀性能? 。 (2)农业上不能用铁制容器配制波尔多液(含硫酸铜),请用化学方程式解释: 。 (3)探究实验:分别将不同量的锌粉加入一定量的 Mg(NO3)2、Cu(NO3)2 和 AgNO3 混合溶液中,充分反应后 过滤。以下是在不同情况下对固体或滤液成分的探究。 ①若向所得固体中滴加盐酸,有气泡产生,则该固体含有的金属为 。 ②猜想:滤液中溶质为 Mg(NO3)2、Cu(NO3)2 和 AgNO3,请分析猜想不合理的原因: 。 13.据图答题: 图 A 图 B (1)根据如图 A 所示回答:滤渣中一定有的金属是 ,滤渣与稀硫酸反应的化学方程式 为 。 (2)把某稀硫酸分为等体积的两份,放入两个烧杯中,分别加入等质量的锌、铁两种金属,反应后金属都 没有剩余,产生氢气的质量随反应时间变化曲线如图 B。下列说法正确的是 。(填字母序号) A.甲是铁,乙是锌 B.铁消耗硫酸的质量比锌大 C.参加反应的锌的质量小于铁的质量 D.充分反应后,稀硫酸一定都有剩余 三、计算题 14.为测定某黄铜(铜锌合金)中铜的质量分数,某同学取 20 g 黄铜样品放入盛有 200 g 稀盐酸的烧杯 中,恰好完全反应,测得烧杯中剩余物质的总质量为 219.8 g,试计算: (1)生成氢气的质量为 g; (2)该黄铜样品中铜的质量分数。(写出计算过程) 答案 一、选择题 1.答案 B 镁能与盐酸发生置换反应生成氯化镁和氢气;银活动性排在氢的后面,不能与盐酸反应生 成氯化银;铁能与盐酸发生置换反应生成氯化亚铁和氢气;锌能与盐酸发生置换反应生成氯化锌和氢 气。 2.答案 D 置换反应是一种单质与一种化合物反应生成另一种单质与另一种化合物的反应,故选 D。 3.答案 D 镁、铝等较活泼的金属在常温下能与氧气反应,铜等金属在点燃或加热条件下才能与氧气 反应,金即使在高温下也不能与氧气反应,只有 D 说法正确。 4.答案 C 铜有良好的导电性,常用于制作导线;在金属活动性顺序中,位于氢前面的金属能置换出 酸中的氢,不是所有的金属都能与稀盐酸反应;铁与稀盐酸反应生成氯化亚铁和氢气;铁能与硫酸铜溶 液发生置换反应,不能用铁桶盛放硫酸铜溶液。 5.答案 A 由于硫酸足量,故金属都将反应完全。锌比铁的金属活动性强,故开始反应的一段时间内, 锌产生氢气的速率较快,铁产生氢气的速率较慢,此时天平左盘质量较大;等质量的铁比锌生成氢气的 质量大,反应完毕后,天平左盘质量较小,所以天平指针的偏转情况是先左后右。 6.答案 D 镁条在空气中燃烧,发出耀眼的白光;细铁丝在氧气里剧烈燃烧,火星四射,生成一种黑色 固体物质;将铝丝插入硫酸铜溶液中,铝与硫酸铜反应生成硫酸铝和铜,溶液的颜色由蓝色逐渐变浅甚 至变为无色;铜的金属活动性比氢弱,不能与稀盐酸反应,无明显变化。 7.答案 A 锌、铁分别和稀盐酸完全反应生成 2 g 氢气,消耗锌的质量是 65 g,消耗铁的质量是 56 g;40 g 锌、铁的混合物和稀盐酸完全反应生成氢气质量小于 2 g,因此混合物不可能是锌、铁。镁和 稀盐酸反应生成 2 g 氢气,消耗镁的质量是 24 g,40 g 铁、镁混合物和稀盐酸完全反应可能生成 2 g 氢气,因此金属混合物可能是铁、镁。40 g 锌、镁混合物和稀盐酸完全反应可能生成 2 g 氢气,因此 金属混合物可能是锌、镁。铜不能和盐酸反应,18 g 铝和盐酸完全反应生成 2 g 氢气,40 g 铝、铜混 合物和稀盐酸完全反应可能生成 2 g 氢气,因此混合物可能是铝、铜。 8.答案 B 铁和稀硫酸反应生成硫酸亚铁和氢气,随着反应进行,铁球质量减小,溶液密度增大,浮力 增大;铁和硫酸铜反应生成硫酸亚铁和铜,生成的铜附着在铁球表面,铁球质量增大,溶液密度减小,浮 力减小,因此一段时间后,杠杆将会左端上翘。 9.答案 C 将一定量的 Zn 粉和 Cu 粉加入一定量 AgNO3 溶液中,锌先和硝酸银反应生成硝酸锌和银, 铜后和硝酸银反应生成硝酸铜和银。滤液中一定含有锌和硝酸银反应生成的硝酸锌,因此滤液中含有 Zn2+,当铜和硝酸银反应时溶液中含有铜离子,因此可能含有 Cu2+;锌先和硝酸银反应生成硝酸锌和银, 铜后和硝酸银反应生成硝酸铜和银,反应后滤渣质量增大;如果滤渣中有 Zn,说明硝酸银不足,即铜没 有和硝酸银反应,则滤液中不含有硝酸铜,滤液一定不是蓝色;如果滤液中含有 Ag+,则锌、铜完全反应, 滤渣中只有银,为纯净物。 10.答案 A 镁比铁活泼,和稀硫酸反应速率较快,反应需要时间短,等质量、形状相同的镁和铁,最终 镁和稀硫酸反应生成的氢气多,A 正确,B 不正确,C 不正确;反应的稀硫酸质量相等时,生成氢气质量相 等,等质量、形状相同的镁和铁与足量稀硫酸反应,最终镁和稀硫酸反应生成的氢气多,D 不正确。 二、填空题 11.答案 (1)2Mg+O2 2MgO 可燃性 (2)Mg+2HCl MgCl2+H2↑ 该反应过程中放出热量,集 气瓶内温度升高,压强变大 解析 (1)实验 1 中,镁燃烧生成氧化镁,说明镁具有可燃性。(2)实验 2 中镁和稀盐酸反应生成氯化镁 和氢气,实验中,观察到 U 形管中液面 a 低于液面 b,其原因是该反应过程中放出热量,集气瓶内温度升 高,压强变大。 12.答案 (1)铝在常温下与空气中的氧气发生化学反应,在铝的表面生成了一层致密的氧化铝薄膜, 从而阻止了内部的铝被进一步氧化 (2)Fe+CuSO4 FeSO4+Cu (3)①锌、铜、银 ②锌可与硝酸银、 硝酸铜反应,所以滤液中一定含有硝酸锌 解析 (1)通常情况下铝制品耐腐蚀,这是因为铝在常温下与空气中的氧气发生化学反应,在铝的表面 生成了一层致密的氧化铝薄膜,从而阻止了内部的铝被进一步氧化。(2)铁和硫酸铜发生置换反应生成 铜和硫酸亚铁。(3)锌会置换出硝酸铜、硝酸银中的铜、银,不会置换出硝酸镁中的镁,所以若向所得 固体中滴加盐酸有气泡产生,则该固体含有的金属为锌、铜、银;锌可与硝酸银、硝酸铜反应,所以滤 液中一定含有硝酸锌。 13.答案 (1)铜和铁 Fe+H2SO4 FeSO4+H2↑ (2)AB 解析 (1)在金属活动性顺序中,铁排在铜的前面,铁能与硫酸铜反应生成硫酸亚铁和铜,故滤渣中一 定含有铜,由流程图可知,在滤渣中加入稀硫酸有气体产生,则一定含有铁,铁能与稀硫酸反应生成硫 酸亚铁和氢气。(2)由题图可知,在相同的时间内,乙产生的氢气质量比甲多,故乙是锌,甲是铁,故 A 正 确;由图像可知,铁反应生成的氢气多,则相同质量的锌和铁,铁消耗稀硫酸的质量大,故 B 正确;反应 后金属都没有剩余,说明金属全部参加反应,故消耗的铁和锌的质量相等,故 C 错误;分析可知,铁消耗 的硫酸的质量大于锌消耗的硫酸的质量,有可能是与铁反应的硫酸恰好完全反应,故 D 错误。 三、计算题 14.答案 (1)0.2 (2)设黄铜样品中锌的质量为 x Zn+2HCl ZnCl2+H2↑ 65 2 x 0.2 g 65 2 = � 0 . 2 g x=6.5 g 黄铜样品中铜的质量分数为 20 g - 6 . 5 g 20 g ×100%=67.5% 答:该黄铜样品中铜的质量分数为 67.5%。 解析 根据质量守恒定律可得,生成氢气的质量为 200 g+20 g-219.8 g=0.2 g;结合锌与稀盐酸反应 的化学方程式和生成氢气的质量即可计算出锌的质量,进而求得黄铜样品中铜的质量分数。查看更多