- 2021-08-24 发布 |
- 37.5 KB |
- 6页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020版高中化学 第3章 自然界中的元素
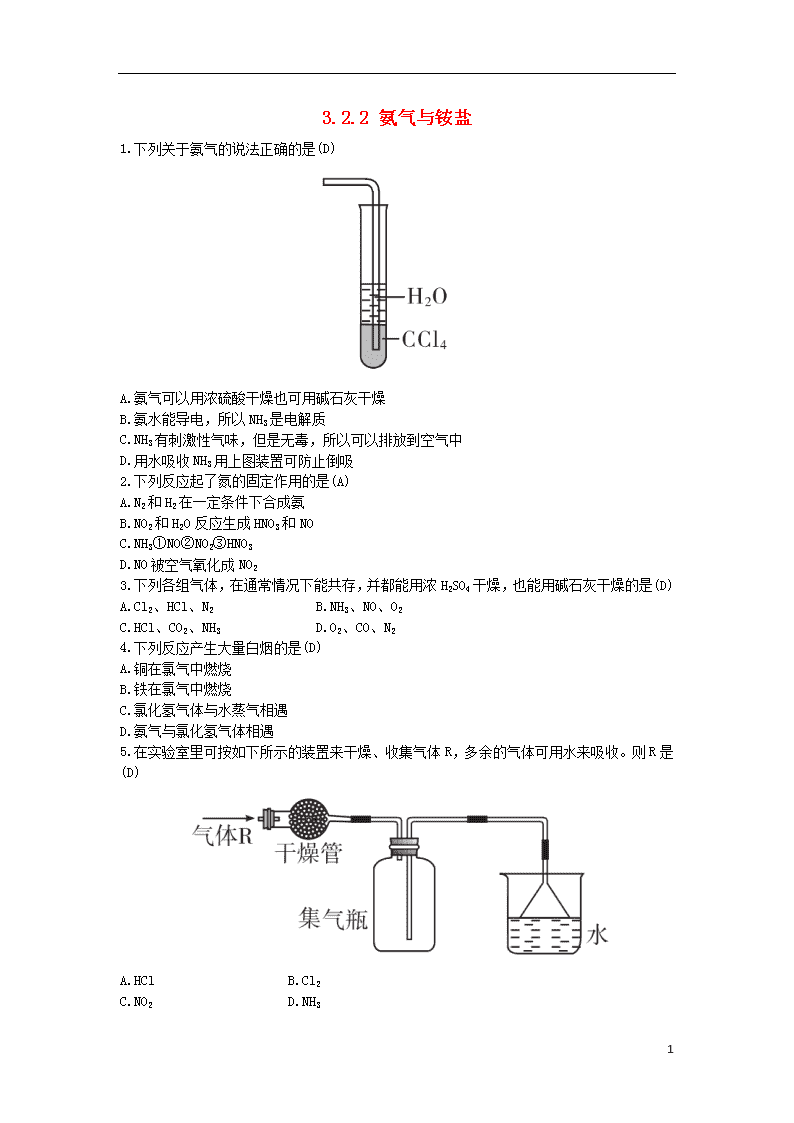
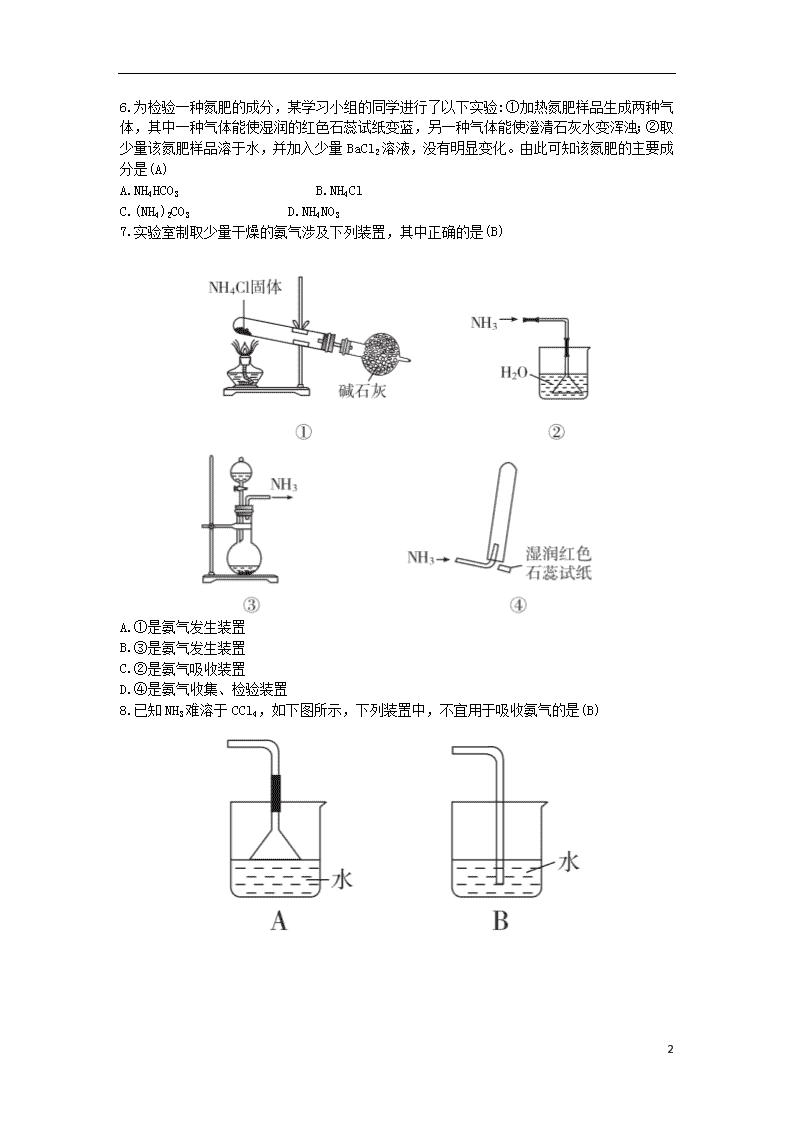
3.2.2 氨气与铵盐 1.下列关于氨气的说法正确的是(D) A.氨气可以用浓硫酸干燥也可用碱石灰干燥 B.氨水能导电,所以NH3是电解质 C.NH3有刺激性气味,但是无毒,所以可以排放到空气中 D.用水吸收NH3用上图装置可防止倒吸 2.下列反应起了氮的固定作用的是(A) A.N2和H2在一定条件下合成氨 B.NO2和H2O反应生成HNO3和NO C.NH3①NO②NO2③HNO3 D.NO被空气氧化成NO2 3.下列各组气体,在通常情况下能共存,并都能用浓H2SO4干燥,也能用碱石灰干燥的是(D) A.Cl2、HCl、N2 B.NH3、NO、O2 C.HCl、CO2、NH3 D.O2、CO、N2 4.下列反应产生大量白烟的是(D) A.铜在氯气中燃烧 B.铁在氯气中燃烧 C.氯化氢气体与水蒸气相遇 D.氨气与氯化氢气体相遇 5.在实验室里可按如下所示的装置来干燥、收集气体R,多余的气体可用水来吸收。则R是(D) A.HCl B.Cl2 C.NO2 D.NH3 6 6.为检验一种氮肥的成分,某学习小组的同学进行了以下实验:①加热氮肥样品生成两种气体,其中一种气体能使湿润的红色石蕊试纸变蓝,另一种气体能使澄清石灰水变浑浊;②取少量该氮肥样品溶于水,并加入少量BaCl2溶液,没有明显变化。由此可知该氮肥的主要成分是(A) A.NH4HCO3 B.NH4Cl C.(NH4)2CO3 D.NH4NO3 7.实验室制取少量干燥的氨气涉及下列装置,其中正确的是(B) A.①是氨气发生装置 B.③是氨气发生装置 C.②是氨气吸收装置 D.④是氨气收集、检验装置 8.已知NH3难溶于CCl4,如下图所示,下列装置中,不宜用于吸收氨气的是(B) 6 9.检验某固体样品中是否含有NH+4的方法是:先取少量固体于试管中,然后(D) A.加热,用湿润的红色石蕊试纸在试管口检验 B.加入弱碱溶液,加热,滴入酚酞试剂 C.加水溶解,用红色石蕊试纸检测溶液酸碱性 D.加入烧碱溶液,加热,用湿润的红色石蕊试纸在试管口检验 10.管道工人曾经用浓氨水检验氯气管道是否漏气。反应原理为 2NH3+3Cl2 6HCl+N2,若管道漏气,现象是在漏气处有白烟生成,原因是(用方程式表示)NH3+HClNH4Cl,总反应为8NH3+3Cl2 6NH4Cl+N2,该反应中氧化剂是Cl2,还原剂是NH3,若有2 mol N2生成,发生氧化反应的NH3的物质的量是4 mol,转移的电子数是12NA。 11.喷泉是一种常见的自然现象,其产生原因是存在压强差。 (1)图甲为化学教学中所用的喷泉实验装置。在烧瓶中充满干燥气体,胶头滴管及烧杯中盛有液体。 ①下列组合中不可能形成喷泉的是(B) A.HCl和H2O B.O2和H2O C.NH3和H2O D.CO2和NaOH溶液 E.NO2和H2O ②用①中A组合做喷泉实验时,若烧瓶中充满HCl气体,则在标准状况下,做完实验后烧瓶中c(HCl)=1/22.4 mol·L-1(设溶质不扩散)。 (2)某学生积极思考产生喷泉的其他办法,并设计了如图乙所示的装置。 ①在图乙的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是(D) 6 A.Cu与稀盐酸 B.NaHCO3与NaOH溶液 C.CaCO3与稀硫酸 D.NH4HCO3与稀盐酸 ②在图乙锥形瓶外放一水槽,锥形瓶中加入酒精,水槽中加入水后,再加入足量的下列物质,结果也产生喷泉。水槽中加入的物质可以是(A) A.浓硫酸B.食盐 C.硝酸钾D.硫酸铜 ③比较图甲和图乙两套装置,从产生喷泉的原理来分析,图甲减小上部烧瓶内气体压强;图乙增大下部锥形瓶内气体压强。(均填“增大”或“减小”) (3)常见的人造喷泉及火山爆发的原理与上述图乙(填“图甲”或“图乙”)装置的原理相似。 12.氨气是一种重要化合物,在工农业生产、生活中有着重要应用。 (1)下列装置可用于实验室制取少量氨气的是bd(填序号)。 (2)“氨的催化氧化”是工业生产硝酸的重要步骤。某化学课外活动小组设计了如下装置模拟该实验过程,并用水吸收制取硝酸(固定装置略去): 6 ①A装置的分液漏斗中盛放浓氨水,则烧瓶中盛放的药品应该是Na2O2; ②C装置中发生反应的化学方程式为4NH3+5O24NO+6H2O; ③反应后,装置E中除存在较多的H+外,还可能存在的一种阳离子是 ,试设计实验证明这种离子的存在:取E中少许溶液于一支洁净的试管中,滴加氢氧化钠浓溶液,加热,若产生能使湿润的红色石蕊试纸变蓝色的气体,证明E中含有; ④下列哪些装置可以同时起到装置D和E的作用b(填代号)。 (3)若将氯气和氨气在集气瓶中混合,会出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一,请写出反应的化学方程式: 3Cl2+8NH3 6 NH4Cl+N2(不必配平)。 解析:(2)①过氧化钠和水反应:2Na2O2+2H2O 4NaOH+O2↑,该反应能提供氧气,同时为放热反应,放出大量热量,使浓氨水中的氨气逸出。 ②氨催化氧化的产物是一氧化氮和水,是工业生产硝酸获得一氧化氮的一步反应,化学方程式为4NH3+5O2 4NO+6H2O。 ③ 6 的检验操作:取E中少许溶液于一支洁净的试管中,滴加氢氧化钠浓溶液,加热,若产生能使湿润的红色石蕊试纸变蓝色的气体,证明E中含有。 ④装置D和E的作用为既防止倒吸,又能吸收二氧化氮,b装置符合。 (3)氯气和氨气相遇,有浓厚的白烟并在容器内壁凝结,同时生成空气的主要成分之一,由此可写出反应的化学方程式。 6查看更多