- 2021-08-24 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高中化学必修1第4章 第4节 第2课时
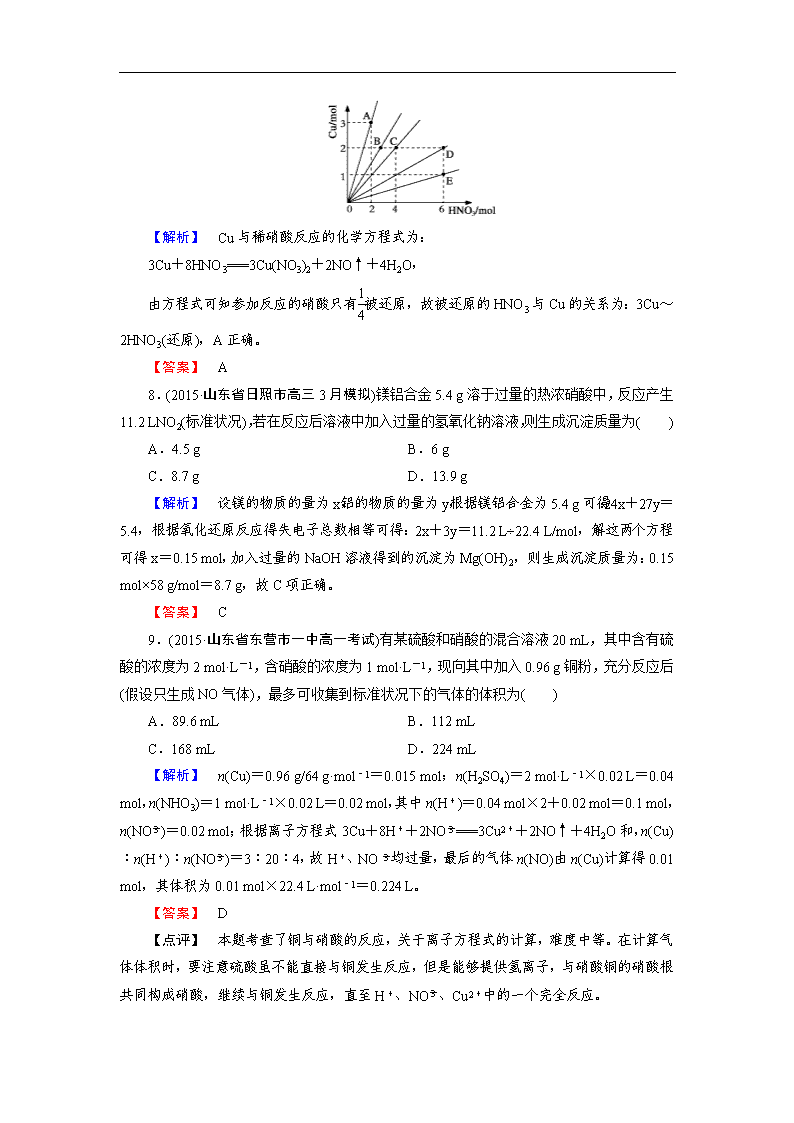
第四章 第四节 第2课时 一、选择题 1.(2015·天津市和平区高一期末)下列关于浓硫酸,浓硝酸的叙述正确的是( ) A.加热条件下,均能与碳反应 B.长期露置在空气中,浓度均会升高 C.常温下均不能用铁质容器贮存 D.常温下均能与铜片迅速反应 【解析】 A.C+2H2SO4(浓)CO2↑+2SO2↑+2H2O,C+4HNO3(浓)===CO2↑+4NO2↑+2H2O,说法正确;B.浓硫酸吸收空气中的水分,而浓度降低;浓硝酸具有挥发性,浓度降低,错误;C.铁在常温下遇浓硫酸、浓硝酸发生钝化铁容器可盛放浓硫酸和浓硝酸,错误;D.铜与浓硫酸加热时才能反应,常温下不反应,错误。 【答案】 A 2.(2015·广东省东莞市高一期末)由下列实验事实得出结论错误的是( ) A.将蔗糖加入浓硫酸后变黑,说明浓硫酸具有脱水性 B.浓硫酸可用作气体干燥剂,说明浓硫酸具有吸水性 C.铜与浓硫酸共热有刺激性气味气体放出,说明浓硫酸具有强氧化性 D.常温下浓硫酸可以用铝罐储存,说明铝与冷的浓硫酸不反应 【解析】 A.浓硫酸具有脱水性,可使蔗糖碳化而变黑,A正确;B.浓硫酸具有吸水性,可用作干燥剂,B正确;C.铜与浓硫酸共热有刺激性气味气体放出,该气体为二氧化硫,为硫酸还原生成,说明反应中浓硫酸起到强氧化性作用,C正确;D.浓硫酸具有强氧化性,可与铝在常温下发生钝化,在表面生成一层致密的氧化物膜,阻碍反应的继续进行,则常温下浓硫酸可以用铝罐储存,D错误,答案选D。 【答案】 D 3.(2015·山东省青岛市高三期末)下述四个反应中,酸所体现的性质与其他三者明显不同的是( ) A.浓盐酸与二氧化锰共热制氯气 B.浓硫酸与铜片加热 C.浓硝酸与铜反应 D.稀硝酸与铜反应 【解析】 浓盐酸与二氧化锰的反应中,浓盐酸体现酸性和还原性;浓硫酸与Cu加热反应生成硫酸铜和二氧化硫、水,浓硫酸体现酸性和氧化性;硝酸与Cu反应生成硝酸铜、水和氮的氧化物,体现硝酸的氧化性和酸性;所以酸所体现的性质与其他三者不同的是A,答案选A。 【答案】 A 4.(2015·广东省揭阳市一中高一期末)(双选)将铜片投入到稀硫酸中,铜片不溶,加入下列试剂后,可使铜片溶解的是( ) A.稀盐酸 B.Na2SO4晶体 C.KNO3晶体 D.FeCl3晶体 【解析】 因为3Cu+8H++2NO===3Cu2++2NO↑4H2O;Fe+2Fe3+===3Fe2+,所以CD正确。 【答案】 CD 5.(2015·松原市扶余县一中高一期中)锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。当生成a mol硝酸锌时,被还原的硝酸的物质的量为( ) A.a mol B.1/2a mol C.1/4a mol D.2a mol 【解析】 根据题意知,锌和稀硝酸反应方程式为4Zn+10HNO3===4Zn(NO3)2+NH4NO3+3H2O,生成a mol硝酸锌时转移电子的物质的量=a mol×(2-0)=2a mol,根据氧化还原反应中得失电子守恒得,被还原的硝酸的物质的量==0.25a,故答案选C。 【答案】 C 6.(2015·经典习题选萃)把SO2通入Fe(NO3)3溶液中,溶液由黄色变为浅绿色,但立即又变为黄色,此时若滴入BaCl2溶液,则会产生白色沉淀。在上述一系列变化过程中,最终被还原的是( ) A.SO2 B.NO C.Fe3+ D.Fe2+ 【解析】 SO2通入Fe(NO3)3溶液中发生下列反应:SO2+2Fe3++2H2O===2Fe2++4H++SO,3Fe2++4H++NO===3Fe3++NO↑+2H2O。此时在滴入BaCl2溶液生成不溶于稀硝酸的BaSO4白色沉淀。所以上述反应中Fe3+先被SO2还原成Fe2+,Fe2+又将NO还原为NO。 【答案】 B 7.如图表示Cu与HNO3反应的量的关系,问哪一点表示铜与稀HNO3反应中被还原的HNO3与Cu的量的关系( ) 【解析】 Cu与稀硝酸反应的化学方程式为: 3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O, 由方程式可知参加反应的硝酸只有被还原,故被还原的HNO3与Cu的关系为:3Cu~2HNO3(还原),A正确。 【答案】 A 8.(2015·山东省日照市高三3月模拟)镁铝合金5.4 g溶于过量的热浓硝酸中,反应产生11.2 LNO2(标准状况),若在反应后溶液中加入过量的氢氧化钠溶液,则生成沉淀质量为( ) A.4.5 g B.6 g C.8.7 g D.13.9 g 【解析】 设镁的物质的量为x,铝的物质的量为y,根据镁铝合金为5.4 g可得:24x+27y=5.4,根据氧化还原反应得失电子总数相等可得:2x+3y=11.2 L÷22.4 L/mol,解这两个方程可得x=0.15 mol,加入过量的NaOH溶液得到的沉淀为Mg(OH)2,则生成沉淀质量为:0.15 mol×58 g/mol=8.7 g,故C项正确。 【答案】 C 9.(2015·山东省东营市一中高一考试)有某硫酸和硝酸的混合溶液20 mL,其中含有硫酸的浓度为2 mol·L-1,含硝酸的浓度为1 mol·L-1,现向其中加入0.96 g铜粉,充分反应后(假设只生成NO气体),最多可收集到标准状况下的气体的体积为( ) A.89.6 mL B.112 mL C.168 mL D.224 mL 【解析】 n(Cu)=0.96 g/64 g·mol-1=0.015 mol;n(H2SO4)=2 mol·L-1×0.02 L=0.04 mol,n(NHO3)=1 mol·L-1×0.02 L=0.02 mol,其中n(H+)=0.04 mol×2+0.02 mol=0.1 mol,n(NO)=0.02 mol;根据离子方程式3Cu+8H++2NO===3Cu2++2NO↑+4H2O和,n(Cu)︰n(H+)︰n(NO)=3︰20︰4,故H+、NO均过量,最后的气体n(NO)由n(Cu)计算得0.01 mol,其体积为0.01 mol×22.4 L·mol-1=0.224 L。 【答案】 D 【点评】 本题考查了铜与硝酸的反应,关于离子方程式的计算,难度中等。在计算气体体积时,要注意硫酸虽不能直接与铜发生反应,但是能够提供氢离子,与硝酸铜的硝酸根共同构成硝酸,继续与铜发生反应,直至H+、NO、Cu2+中的一个完全反应。 10.(2014·江西南昌一模)镁、铝、铁合金投入到300 mL硝酸溶液中,金属恰好溶解,转化成Mg2+、Al3+和Fe3+;硝酸全部被还原为NO,且在标准状况下,体积为6.72 L,当加入300 mL某浓度NaOH溶液,金属阳离子恰好全部沉淀,干燥后测得质量为27.2 g。下列有关推断正确的是( ) A.参加反应的HNO3物质的量为0.9 mol B.参加反应的金属质量为11.9 g C.HNO3物质的量浓度为3 mol/L D.NaOH物质的量浓度为6 mol/L 【解析】 本题考查了金属的性质及相关计算,意在考查考生对金属性质的理解及计算能力。标准状况下6.72 L NO为0.3 mol,则反应转移的电子为0.9 mol,因参加反应的硝酸一部分生成NO(0.3 mol),另外一部分与阳离子形成盐,形成盐的NO的物质的量与反应中金属失去电子的物质的量相同,即0.9 mol,故参加反应的硝酸为1.2 mol,故硝酸的浓度为1.2 mol÷0.3 L=4 mol/L,A项和C项错误;生成沉淀消耗的OH-的物质的量与反应中金属失去电子的物质的量相同,即0.9 mol,故参加反应的金属质量为27.2 g-0.9 mol×17 g·mol-1=11.9 g,B项正确;NaOH物质的量浓度为0.9 mol÷0.3 L=3 mol/L,D项错误。 【答案】 B 二、非选择题 11.(2015·宁德市高三期末)用如图所示装置做“铜与浓硝酸反应”的实验。 (1)从试剂瓶中取出一小块铜片放入试管中,需用的仪器是________。 (2)棉花应蘸________溶液(填化学式)。 (3)试管中除了溶液变成绿色外,还会出现的现象是________(填序号)。 A.有红棕色气体生成,上下颜色相同 B.有红棕色气体生成,上部颜色较浅 C.有红棕色气体生成,下部颜色较浅 (4)实验结束后,对试管内残留物的处理方法是________________。 【解析】 (1)铜片为块状固体,需要镊子取出。(2)铜与浓硝酸反应生成有毒、能污染空气的NO2气体,NO2能被NaOH溶液吸收,所以棉花蘸NaOH溶液,除去生成的NO2气体。(3)NO2为红棕色气体,试管上部NO2浓度相对较小,所以上部颜色较浅,故B项正确。(4)试管中含有毒、能污染空气的NO2 气体,所以实验结束后,对试管内残留物的处理方法是:将试管倒扣在装有氢氧化钠溶液的烧杯中,取出固体清洗并回收。或将试管移到通风橱中,取下棉花,往试管中加入氢氧化钠溶液,取出固体清洗并回收。 【答案】 (1)镊子 (2)NaOH (3)B (4)将试管倒扣在装有氢氧化钠溶液的烧杯中,取出固体清洗并回收。或将试管移到通风橱中,取下棉花,往试管中加入氢氧化钠溶液,取出固体清洗并回收。 12.(2015·山东省枣庄市一中高一期末)某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置进行了有关实验: (1)B是用来收集实验中产生的气体的装置,但未将导管画全,请直接在原图上把导管补充完整。 (2)实验中他们取6.4 g铜片和12 mL 18 mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。 ①请写出铜跟浓硫酸反应的化学方程式:__________________________________ ②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是:_____________。 ③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是:________(填写字母编号)。 A.铁粉 B.氯化钡溶液 C.银粉 D.碳酸氢钠溶液 (3)为定量测定余酸的物质的量浓度,某位同学进行了如下设计: 先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度。他认为测定SO2的量的方法有多种,请问下列实验方案中可行的是________(填写字母编号)。其中计算结果余酸物质的量浓度比实际偏高的是________(填写字母编号) A.将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,结束反应后再次称量 B.将装置A产生的气体缓缓通入足量用稀硫酸酸化的高锰酸钾溶液,再加入足量氯化钡溶液,过滤、洗涤、干燥、称量沉淀 C.用排水法测定装置A产生气体的体积(已折算成标准状况) D.将装置A产生的气体缓缓通入足量氢氧化钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀 E.将装置A产生的气体缓缓通入足量硝酸酸化的硝酸钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀(已知:硝酸具有强氧化性) 若A项不可行,请写出改进的方法:________(若A项可行该空写“不用改进”) 【解析】 (1)收集气体时,导管长进短出,故图为;(2)铜和浓硫酸反应,体现了浓硫酸的强氧化性,产物为二氧化硫、硫酸铜和水,反应方程式为Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O;反应结束时,有一定量的余酸但未能使铜片完全溶解,是因为在反应的过程中,会生成水,使浓硫酸转变为稀硫酸,而稀硫酸与铜不再发生反应,反应停止;如想证明产物中有余酸,那么向生成物中加入铁粉或者碳酸氢钠,若有气泡生成,则说明产物中有余酸;(3)测定余酸的物质的量浓度,可将装置A产生的气体缓缓通入足量硝酸酸化的硝酸钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀的质量即可;计算结果余酸物质的量浓度比实际偏高的是用排水法测定装置A产生气体的体积时,因二氧化硫会与水反应;A项将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,结束反应后再次称量,会使结果产生误差,应先将气体通入浓硫酸干燥后,再用碱石灰吸收气体。 【答案】 (1) (2)①Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O ②随着反应进行,硫酸被消耗,且产物有水生成,所以浓硫酸变成稀硫酸,反应会停止。 ③AD (3)E;C;A产生的气体先经浓硫酸干燥,后用碱石灰吸收 13.(2015·经典习题选萃)将红热的固体单质M放入浓硝酸中,剧烈反应,产生混合气体A,A在常温下不与空气接触时,发生如图所示的变化。 A是________,B是________,C是________,D是________(填化学式)。 【解析】 固体单质M为碳,它与浓硝酸反应产生的气体A为NO2和CO2的混合气体。通过水时,反应生成HNO3,剩余气体为NO和CO2。气体再通过石灰水时CO2被吸收,可生成白色沉淀CaCO3,气体B为NO。单质C与稀硝酸反应,产生蓝色溶液D和气体NO,则D为Cu(NO3)2,C为单质铜。 【答案】 NO2、CO2 NO Cu Cu(NO3)2 14.(2015·经典习题选萃)铜是重要的工业原材料,现有Cu、Cu2O组成的混合物,某研究性学习小组为了探究其组成情况,取35.2 g混合物加入0.5 L 3.4 mol/L的稀硝酸,固体物质完全反应,生成4.48 L(标准状况)的NO。向所得溶液中加入a L 2.0 mol/L的NaOH溶液,恰好使溶液中的Cu2+沉淀完全。 (1)Cu2O与稀硝酸反应的化学方程式为________________________________________ ________________________________________________________________________。 (2)混合物中,n(Cu)=________;n(Cu2O)=________。 (3)所加NaOH溶液的体积a=________L。 【解析】 (2)设混合物中有x mol Cu、y mol Cu2O。 3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O 3 2 x x 3Cu2O+14HNO3(稀)===6Cu(NO3)2+2NO↑+7H2O 3 2 y y 由题意可得 解得 (3)由N元素守恒知:加入的0.5 L 3.4 mol/L的HNO3除有0.2 mol NO气体放出外,其余N元素恰好和NaOH作用得到NaNO3。 所以n(NaOH)=0.5 L×3.4 mol/L-0.2 mol=1.5 mol。 因此NaOH溶液的体积为:a==0.75 L。 【答案】 (1)3Cu2O+14HNO3===6Cu(NO3)2+2NO↑+7H2O (2)0.1 mol 0.2 mol (3)0.75 L 查看更多