2020届高考化学二轮复习自我检测三含解析
自我检测(三)
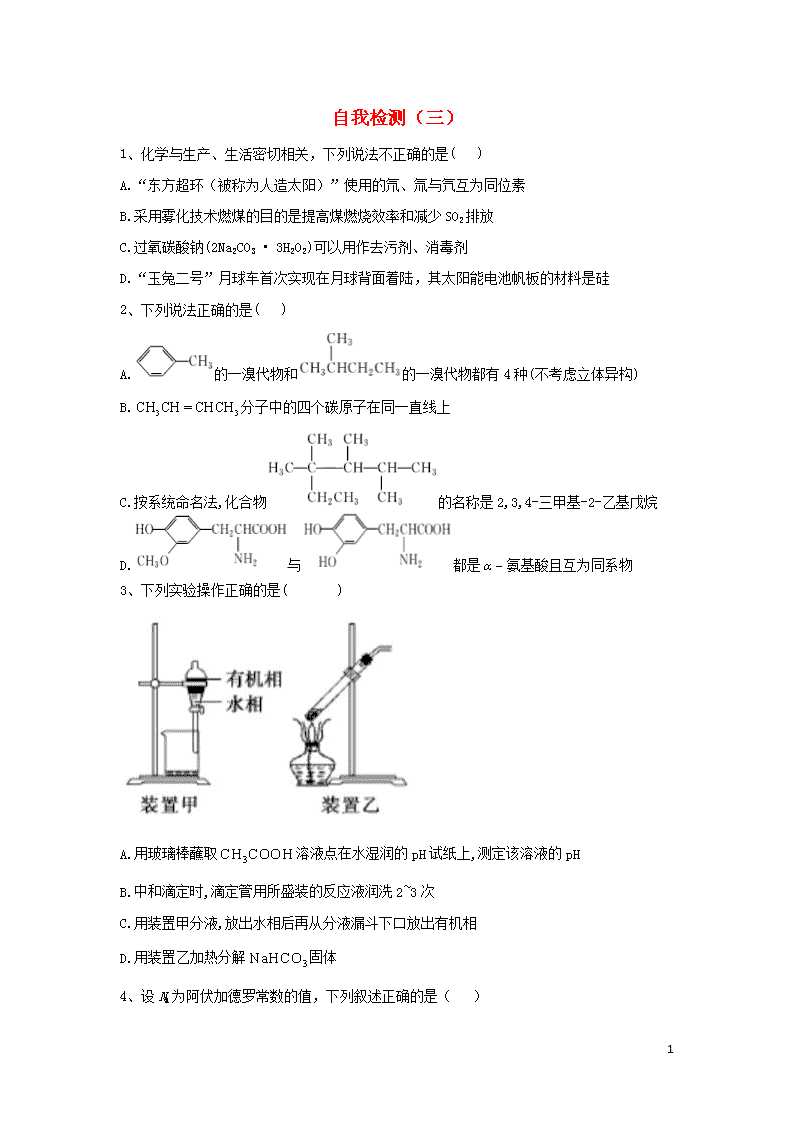
1、化学与生产、生活密切相关,下列说法不正确的是( )
A.“东方超环(被称为人造太阳)”使用的氘、氚与氕互为同位素
B.采用雾化技术燃煤的目的是提高煤燃烧效率和减少SO2排放
C.过氧碳酸钠(2Na2CO3 • 3H2O2)可以用作去污剂、消毒剂
D.“玉兔二号”月球车首次实现在月球背面着陆,其太阳能电池帆板的材料是硅
2、下列说法正确的是( )
A.的一溴代物和的一溴代物都有4种(不考虑立体异构)
B.分子中的四个碳原子在同一直线上
C.按系统命名法,化合物的名称是2,3,4-三甲基-2-乙基戊烷
D.与都是氨基酸且互为同系物
3、下列实验操作正确的是( )
A.用玻璃棒蘸取溶液点在水湿润的pH试纸上,测定该溶液的pH
B.中和滴定时,滴定管用所盛装的反应液润洗2~3次
C.用装置甲分液,放出水相后再从分液漏斗下口放出有机相
D.用装置乙加热分解固体
4、设NA为阿伏加德罗常数的值,下列叙述正确的是( )
15
A.25℃,1L pH=9的CH3COONa溶液中,发生电离的水分子数为1×10-9 NA
B.标准状况下,22.4L NO与11.2L O2混合后气体的分子数为NA
C.标准状况下,22.4L己烷中共价键数目为19NA
D.过量铜与含0.4mol HNO3的浓硝酸反应,电子转移数大于0.2 NA
5、短周期元素甲、乙、丙、丁的原子序数依次增大,甲和丁的原子核外均有两个未成对电子,乙、丙、丁最高价氧化物对应的水化物两两之间能相互反应。下列说法错误的是( )
A.元素丙的单质可用于冶炼金属
B.甲与丁形成的分子中有非极性分子
C.简单离子半径:丁>乙>丙
D.甲与乙形成的化合物均有强氧化性
6、利用如图所示的电化学装置可将废水中的尿素转化为对环境无害的物质。下列有关说法错误的是
A.该装置既可以处理废水,还可以通过a、b输出电能
B.M极的电极反应式:
C.该电化学装置工作时,质子从N极移向M极
D.相同条件下,M极生成的气体与N极消耗的气体体积比为4: 3
7、25℃时Fe(OH)2和Cu(OH)2的饱和溶液中,令pM=-lgc(M),M代表Fe2 +或Cu2+,pM与溶液阳的关系如 图所示[不考虑O2等氧化剂对Fe(OH)2的影响]。下列说法正确的是 ( )
A.该温度下的溶度积常数KspCu( OH)2 ]
,故该点对应溶液是Cu(OH)2过饱和溶液,故D 错误。
8答案及解析:
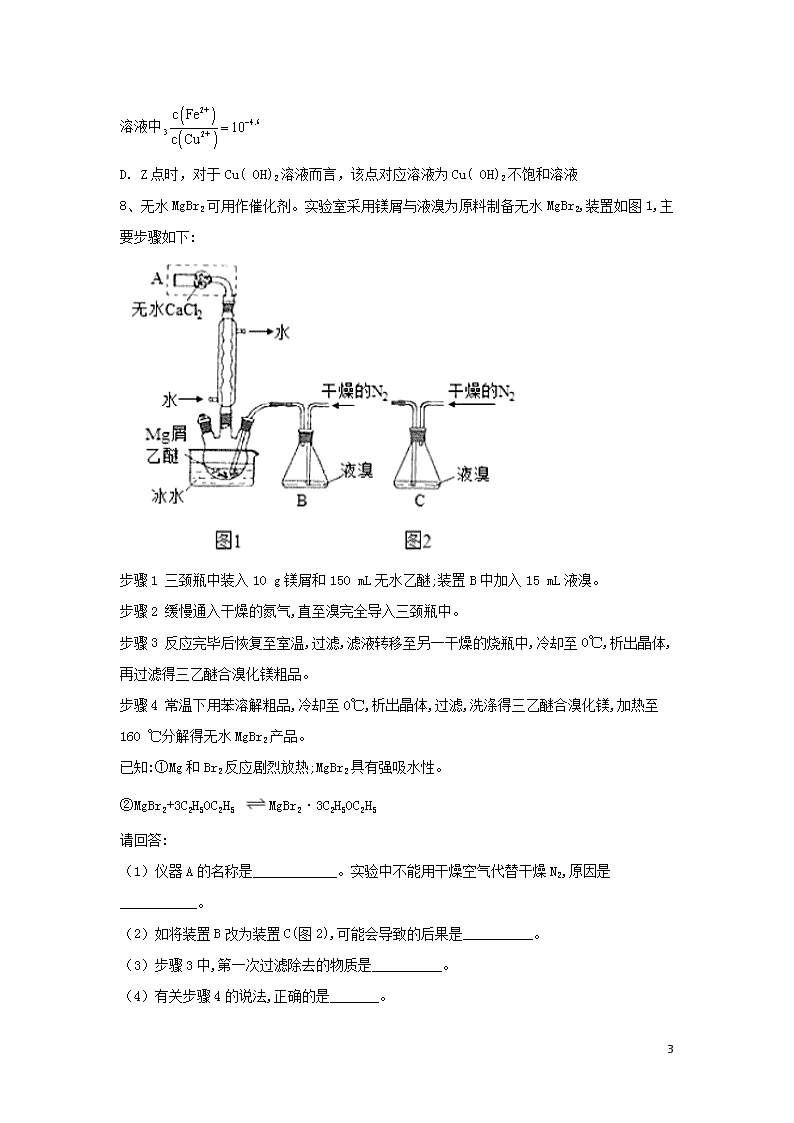
答案:(1)干燥管; 防止镁屑与氧气反应,生成的MgO阻碍Mg和Br2的反应
(2)会将液溴快速压入三颈瓶,反应过快大量放热而存在安全隐患
(3)镁屑; (4)BD; (5)①从滴定管上口加入少量待测液,倾斜着转动滴定管,使液体润湿内壁,然后从下部放出,重复2-3次
②97.5%
解析:(1)仪器A为干燥管。本实验要用镁屑和液溴反应生成无水溴化镁,所以装置中不能有能与镁反应的气体,例如氧气,所以不能用干燥的空气代替干燥的氮气。故答案为:防止镁屑与氧气反应,生成MgO的阻碍Mg和Br2的反应。
(2)将装置B改为装C,当干燥的氮气通入,会使气压变大,将液溴快速压入三颈瓶,反应过快大量放热而存在安全隐患。而装置B是利用干燥的氮气将溴蒸气带入三颈烧瓶中, 反应可以控制,防止太快.
(3)步骤3过滤出去的是不溶于水的镁屑。
(4)A、95%的乙醇中含有水,溴化镁有强烈的吸水性,错误;B、加入苯的目的是除去乙醚和溴,洗涤晶体用0℃的苯,可以减少产品的溶解, 正确;C、加热至160℃的主要目的是分解三乙醚合溴化镁得到溴化镁,不是为了除去苯,错误;D、该步骤是为了除去乙醚和溴,故正确。故选BD。
(5)①滴定前润洗滴定管是需要从滴定管上口加入少量待测液,倾斜着转动滴定管,使液体润湿内壁,然后从下部放出,重复2-3次。
②根据方程式分析,溴化镁的物质的量为0.0500×0.02650=0.001325mol,则溴化镁的的物质的质量为0.001325×184=0.2438g,溴化镁的产品的纯度.
9答案及解析:
15
答案:(1);
(2) ①② ; 2︰3 ;
(3)
(4)①
②参与正极反应,通过隔膜向正极定向移动形成闭合回路;
减少1mol
③ ; 降低
解析:
10答案及解析:
答案:(1)-99; +41
(2)(或); a; 反应①为放热反应,平衡常数数值应随温度升高变小
(3)减小; 升高温度时,反应①为放热反应,平衡向左移动,使得体系中CO的量增大;反应③为吸热反应,平衡向右移动,又使产生CO的量增大,总结果,随温度升高,使CO的转化率降低; 相同温度下,由于反应①为气体分子数减小的反应,加压有利于提升CO的转化率;而反应③为气体分子数不变的反应,产生CO的量不受压强影响。故增大压强时,有利于CO的转化率升高。
解析:(1) 由反应①代入求得。由盖斯定律,。
(2)反应①的K表达式为。因反应①为放热反应,所以平衡常数应随温度升高而变小,所以选a。
(3)升高温度,反应①平衡向左移动,使体系中n(CO)增大;反应③为吸热反应,平衡向右移动,又使产生n(CO)增大总结果是随温度升高,CO的转化率降低。
因为相同温度下,由于反应①为气体分子数减小的反应,加压
15
有利于增大CO的转化率;反应③为气体分子数不变的反应,压强改变对平衡不产生影响。所以压强增大,CO转化率升高,在图2中,同一温度下,CO转化率高的对应压强大,则。
11答案及解析:
答案:(1)D; C; (2)Li+核电荷数较大
(3)正四面体, sp3 , AB
(4)520; 498; 2908; (5)
解析:(1)分析:(1)根据处于基态时能量低,处于激发态时能量高判断;
(2)根据原子核对最外层电子的吸引力判断;
(3)根据价层电子对互斥理论分析;根据物质的组成微粒判断化学键;
(4)第一电离能是气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,据此计算;根据氧气转化为氧原子时的能量变化计算键能;晶格能是气态离子形成1摩尔离子晶体释放的能量,据此解答;
(5)根据晶胞中含有的离子个数,结合密度的定义计算。
根据核外电子排布规律可知Li的基态核外电子排布式为1s22s1,则D中能量最低;选项C中有2个电子处于2p能级上,能量最高;
(2)由于锂的核电荷数较大,原子核对最外层电子的吸引力较大,因此Li+半径小于H-;
(3)LiAlH4中的阴离子是AlH4-,中心原子铝原子含有的价层电子对数是4,且不存在孤对电子,所以空间构型是正四面体,中心原子的杂化轨道类型是sp3杂化;阴阳离子间存在离子键,Al与H之间还有共价单键,不存在双键和氢键,答案选AB;
(4)根据示意图可知Li原子的第一电离能是1040 kJ/mol÷2=520 kJ/mol;0.5mol氧气转化为氧原子时吸热是249 kJ,所以O=O键能是249 kJ/mol×2=498 kJ/mol;根据晶格能的定义结合示意图可知Li2O的晶格能是2908 kJ/mol;
(5)根据晶胞结构可知锂全部在晶胞中,共计是8个,根据化学式可知氧原子个数是4个,则Li2O的密度是。
点睛:本题考查核外电子排布,轨道杂化类型的判断,分子构型,电离能、晶格能,化学键类型,晶胞的计算等知识,保持了往年知识点比较分散的特点,立足课本进行适当拓展,但整体难度不大。难点仍然是晶胞的有关判断与计算,晶胞中原子的数目往往采用均摊法:
15
①位于晶胞顶点的原子为8个晶胞共用,对一个晶胞的贡献为1/8;
②位于晶胞面心的原子为2个晶胞共用,对一个晶胞的贡献为1/2;
③位于晶胞棱心的原子为4个晶胞共用,对一个晶胞的贡献为1/4;
④位于晶胞体心的原子为1个晶胞共用,对一个晶胞的贡献为1。
12答案及解析:
答案:Ⅰ. CD
Ⅱ. (1) 取代反应 (2)浓,浓 (3)2:1 (4) 4 1:1:1:1 (5)羧基 羟基 (6)
解析: Ⅰ. A. 含2种H,个数比为1:1,故A不选;
B. 含3种H,故B不选;
C. 含2种H,且数目比为3:2,故C选;
D. 含2种H,且数目比为3:2,故D选;
故选:CD。
Ⅱ. (1)X的结构简式为;水杨酸中羧基和甲醇发生酯化反应生成X,所以由水杨酸制备X的反应类型为酯化反应或取代反应,故答案为:;酯化反应或取代反应;
(2)X中H原子被硝基取代,所以由X制备Y的反应试剂为浓硫酸作催化剂、X和浓硝酸发生取代反应得到Y,故答案为:浓硫酸、浓硝酸;
(3)Z为,工业上常采用廉价的CO2,与Z反应制备奥沙拉秦,酚钠和H2CO3以1:1反应,一个Z化学式中含有2个酚-ONa,所以1molZ需要2molH2CO3,根据C原子守恒知,通入的CO2与Z的物质的量之比至少应为2:1,故答案为:2:1;
(4)根据结构简式确定奥沙拉秦的分子式为
15
,有4种氢原子,则其核磁共振氢谱为4组峰,峰面积比为1:1:1:1,故答案为:;4;1:1:1:1;
(5)若将奥沙拉秦用HCl酸化后,-COONa、酚-ONa都和稀盐酸反应,分别生成-COOH、-OH,反应后的分子中含氧官能团的名称为羧基、羟基,故答案为:羧基、羟基;
(6)W是水杨酸的同分异构体,可以发生银镜反应,说明含有酯基;W经碱催化水解后再酸化可以得到对苯二酚,W中含有1个酚羟基和1个酯基且两个取代基为对位,W的结构简式为,故答案为:。
15