2020届高考化学二轮复习自我检测四含解析
自我检测(四)
1、化学与生活密切相关。下列说法错误的是( )
A.泡沫灭火器可用于一般的起火,也适用于电器起火
B.疫苗一般应冷藏存放,以避免蛋白质变性
C.家庭装修时用水性漆替代传统的油性漆,有利于健康及环境
D.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
2、下列实验设计正确的是( )
A.将通入溴水中证明具有漂白性
B.将铁屑放入稀中证明比活泼
C.将澄清石灰水滴入某溶液证明其中存在
D.将乙烯通入酸性溶液证明乙烯具有还原性
3、胆矾(CuSO4•5H2O)高温时发生反应:2CuSO4•5H2O 2CuO + 2SO2↑+ O2↑+ 10H2O。下列装置能达到实验目的的是( )
A.
B.
C.
16
D.
4、设NA表示阿伏加德罗常数,下列叙述正确的是( )
A.标准状况下,11.2L CHCl3所含的原子总数为2.5NA
B.1L 0.1mol·L-1硫酸钠溶液中含有的氧原子数为0.4NA
C.常温常压下,44g C3H8中含有的共价键总数为10NA
D.78g Na2O2固体中含有阴、阳离子总数为4NA
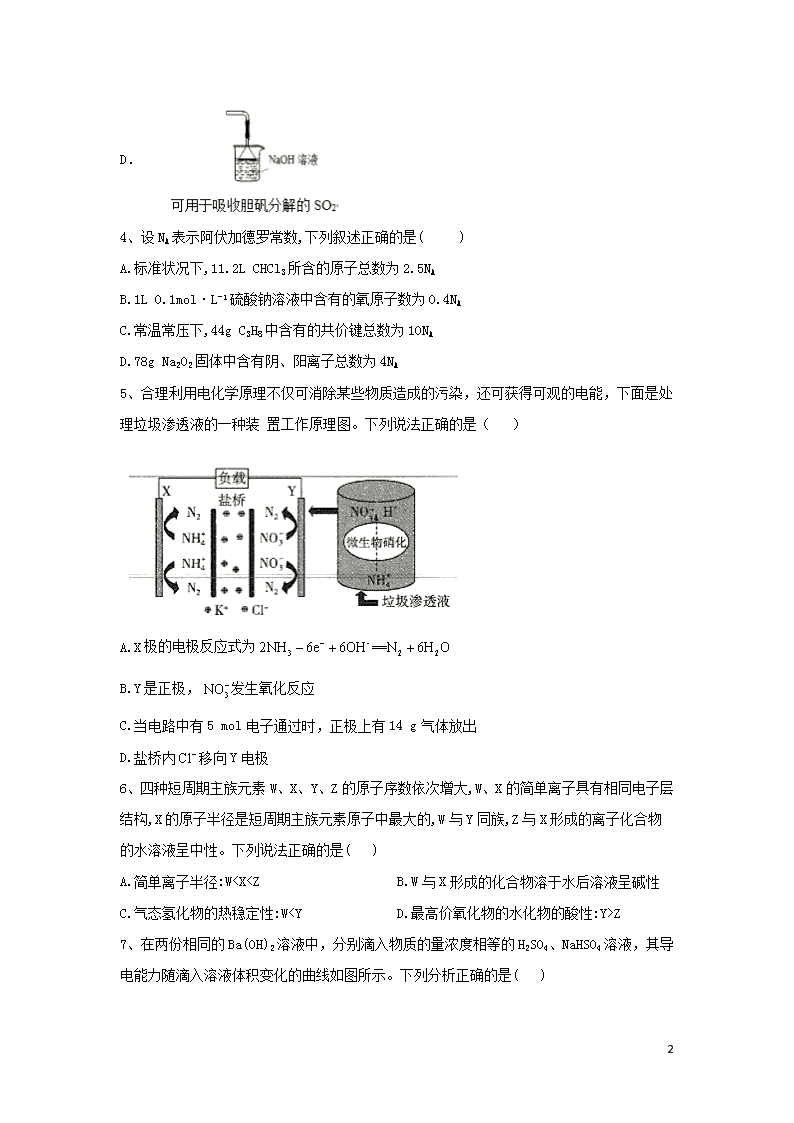
5、合理利用电化学原理不仅可消除某些物质造成的污染,还可获得可观的电能,下面是处理垃圾渗透液的一种装 置工作原理图。下列说法正确的是( )
A.X极的电极反应式为
B.Y是正极,发生氧化反应
C.当电路中有5 mol电子通过时,正极上有14 g气体放出
D.盐桥内移向Y电极
6、四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是( )
A.简单离子半径:W
Z
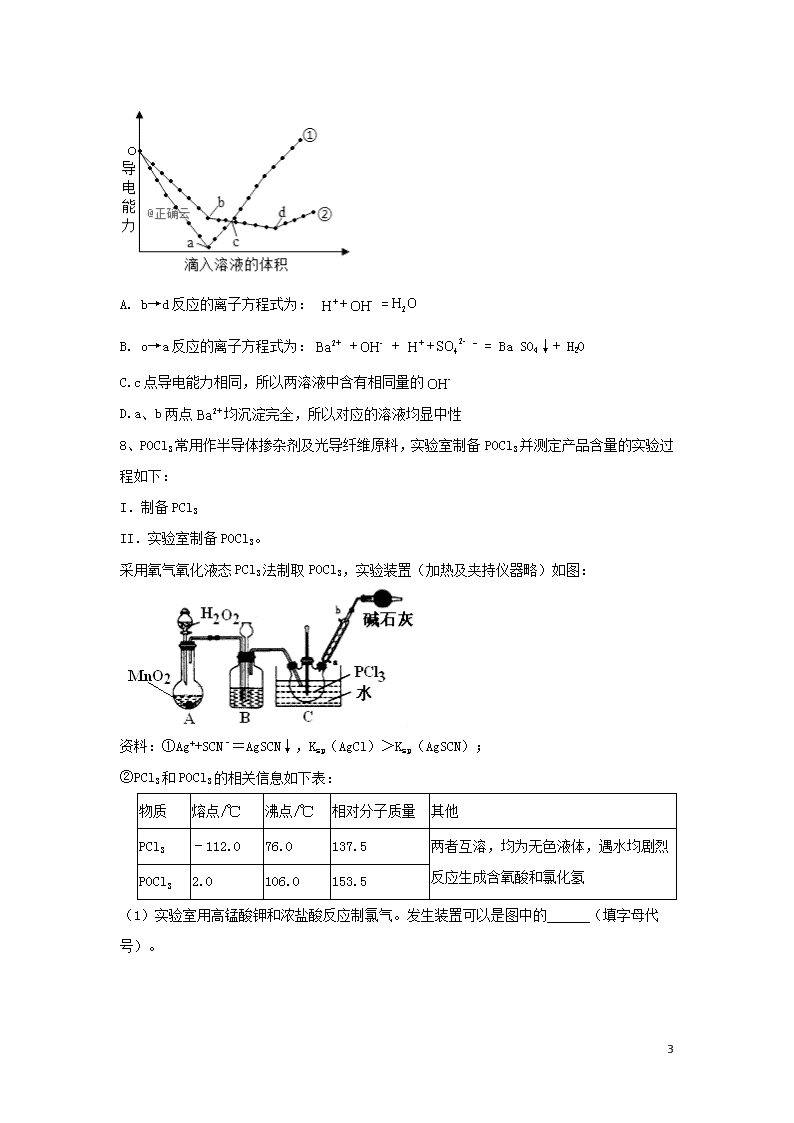
7、在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析正确的是( )
16
A. b→d反应的离子方程式为: + =
B. o→a反应的离子方程式为: + + + - = Ba SO4↓+ H2O
C.c点导电能力相同,所以两溶液中含有相同量的
D.a、b两点均沉淀完全,所以对应的溶液均显中性
8、POCl3常用作半导体掺杂剂及光导纤维原料,实验室制备POCl3并测定产品含量的实验过程如下:
I.制备PCl3
II.实验室制备POCl3。
采用氧气氧化液态PCl3法制取POCl3,实验装置(加热及夹持仪器略)如图:
资料:①Ag++SCN﹣=AgSCN↓,Ksp(AgCl)>Ksp(AgSCN);
②PCl3和POCl3的相关信息如下表:
物质
熔点/℃
沸点/℃
相对分子质量
其他
PCl3
﹣112.0
76.0
137.5
两者互溶,均为无色液体,遇水均剧烈反应生成含氧酸和氯化氢
POCl3
2.0
106.0
153.5
(1)实验室用高锰酸钾和浓盐酸反应制氯气。发生装置可以是图中的 (填字母代号)。
16
(2)检查装置C气密性并装入药品后,先关闭K1,打开K2通入干燥的CO2,一段时间后,关闭K2,加热曲颈瓶同时打开K1通入干燥氯气,反应立即进行。图中碱石灰的作用是_________________________。
(3)POCl3在潮湿空气中会剧烈“发烟”,反应的化学方程式为______________________。
(4)反应温度要控制在60~65℃,原因是:_____________________。
(5)通过佛尔哈德法可以测定产品中Cl元素含量,实验步骤如下:
a、准确称取15.0g POCl3产品,置于盛有60.00mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00mL溶液。
b、取10.00mL溶液于锥形瓶中,加入10.00mL 3.2mol•L﹣1 AgNO3标准溶液。
c、加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
d、以NH4Fe(SO4)2为指示剂,用0.2mol•L﹣1 NH4SCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去10.00mL NH4SCN溶液。
①步骤d中达到滴定终点的现象是_______________________。
②产品中Cl元素的质量分数为__________(保留3位有效数字)。
9、某混合物浆液含和少量。考虑到胶体的吸附作用使不易完全被水浸出,某研究小组利用设计的电解分离装置(如图),使浆液分离成固体混合物和含铬元素溶液,并冋收利用。回答I和II中的问题:
16
I.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为__________,B→C的反应条件为__________,C→Al的制备方法称为__________。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化;加热有生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生。由此判断影响该反应有效进行的因素有__________(填序号)
a.温度 b.的浓度 c.溶液的酸度
(3)0.1mol 与焦炭、完全反应,生成一种还原性气体和一种易水解成的液态化合物,放热4.28kJ,该反应的热化学方程式为___________________________。
II.含铬元素溶液的分离和利用
用惰性电极电解时,能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是__________;阴极室生成的物质为__________(写化学式)。
10、采用N2O5为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用,回答下列问题:
(1)1840年Devil用干燥的氯气通过干燥的硝酸银,得到N2O5,该反应的氧化产物是一种气体,其分子式为__________
(2)F.Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:
其中NO2二聚为N2O4的反应可以迅速达到平衡,体系的总压强p随时间t的变化如下表所示(t=∞时,N2O5(g)完全分解):
t/min
0
40
80
160
260
1300
1700
∞
P/kPa
35.8
40.3
42.5
45.9
49.2
61.2
62.3
63.1
16
①已知:
2N2O5(g)=2N2O4(g)+O2(g) △H1=-4.4KJ·mol-1
2NO2(g)=N2O4(g) △H2=-55.3KJ·mol-1
则反应的△H=__________KJ·mol-1
②研究表明,N2O5(g)分解的反应速率。t=62min时,测得体系中,则此时的__________KPa,V=__________KPa·min-1。
③若提高反应温度至35℃,则N2O5(g)完全分解后体系压强P∞(35℃)__________63.1kPa(填“大于”“等于”或“小于”),原因是__________。
④25℃时N2O4(g)2NO2(g)反应的平衡常数Kp=__________KPa (Kp为以分压表示的平衡常数,计算结果保留1位小数)。
(3)对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:
第一步N2O5NO3+NO2 快速平衡
第二步NO2+NO3→NO+NO2+O2 慢反应
第三步NO+NO3→2NO2 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是__________(填标号)
A.v(第一步的逆反应)>v(第二步反应)
B.反应的中间产物只有NO3
C.第二步中NO2与NO3的碰撞仅部分有效
D.第三步反应活化能较高
11、碳是地球上组成生命的最基本元素之一,可以和杂化轨道成共价键,具有很强的结合能力,与其它元素结合成不计其数的无机物和有机化合物,构成了丰富多彩的世界。碳及其化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)基态碳原子核外有__________种运动状态不同的电子,其价电子排布图为 。
(2)光气的分子式为,又称碳酰氯,是一种重要的含碳化合物,判断其分子立体构型为 ,其碳原子杂化轨道类型为 杂化。
(3)碳酸盐在一定温度下会发生分解,实验证明碳酸盐的阳离子不同,分解温度不同,如下表所示:
16
碳酸盐
SrCO3
热分解温度/
402
900
1172
1360
阳离子半径/pm
66
99
112
135
试解释为什么随着阳离子半径的增大,碳酸盐的分解温度逐步升高?
(4)碳的一种同素异形体,又名足球烯,是一种高度对称的球碳分子。立方烷(分子式:,结构是立方体:)是比约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与的复合型分子晶体,该晶体的晶胞结构如下图所示,立方烷分子填充在晶体的分子间空隙中。则该复合型分子晶体的组成用二者的分子式可表示为
(5)碳的另一种同素异形体——石墨,其晶体结构如上图所示,虚线勾勒出的是其晶胞。则石墨晶胞含碳原子个数为 个。已知石墨的密度为,C-C键长为rcm,阿伏加德罗常数的值为,计算石墨晶体的层间距为 cm。
12、某研究小组按下列路线合成药物胃复安:
已知:;
16
请回答:
(1)化合物A的结构简式__________
(2)下列说法不正确的是__________
A.化合物B能发生加成反应
B.化合物D能与FeCl3溶液发生显色反应
C.化合物E具有碱性
D.胃复安的分子式是C13H22ClN3O2
(3)设计化合物C经两步反应转变为D的合成路线(用流程图表示,试剂任选)__________
(4)写出D+E→F的化学方程式__________
(5)写出化合物E可能的同分异构体的结构简式__________,须同时符合:
①1H-NMR谱表明分子中有3种氢原子,IR谱显示有N-H键存在;
②分子中没有同一个碳上连两个氮()的结构。
答案以及解析
1答案及解析:
答案:A
解析:A.泡沫灭火器中加入的主要是碳酸氢钠和硫酸铝溶液,两者混合的时候发生双水解反应,生成大量的二氧化碳气体泡沫,该泡沫喷出进行灭火。但是,喷出的二氧化碳气体泡沫中一定含水,形成电解质溶液,具有一定的导电能力,可能导致触电或电器短路,A错误。
B.疫苗是指用各类病原微生物制作的用于预防接种的生物制品。由于疫苗对温度比较敏感,温度较高时,会因为蛋白质变性,而失去活性,所以疫苗一般应该冷藏保存,B正确。
C.油性漆是指用有机物作为溶剂或分散剂的油漆;水性漆是指用水作为溶剂或分散剂的油漆,使用水性漆可以减少有机物的挥发对人体健康和室内环境造成的影响,C正确。
D.电热水器内胆连接一个镁棒,就形成了原电池,因为镁棒比较活泼所以应该是原电池的负极,从而对正极的热水器内胆(多为不锈钢或铜制)起到了保护作用,这种保护方法为:牺牲阳极的阴极保护法,D正确。
2答案及解析:
答案:D
16
解析:A. 使溴水褪色是证明具有还原性,错误;B.铁屑放入稀中不产生,而是产生,错误;C.澄清石灰水滴入溶液中也会产生白色沉淀,错误;D.乙烯使酸性溶液褪色,是发生了氧化反应,体现了乙烯的还原性,正确。故选D。
3答案及解析:
答案:D
解析:
4答案及解析:
答案:C
解析:A. 标况下CHCl3为液体,不能使用气体摩尔体积,故A错误;
B. 硫酸钠溶液中,硫酸钠、水分子都含氧原子,所以1L 0.1mol⋅L−1硫酸钠溶液中含有的氧原子数远远大于0.4NA,故B错误;
C. 1个C4H8中含有8个C−H键,2个C−C键,则56g C4H8 (烯烃)物质的量为:,含有的共价单键总数为10NA,故C正确;
D. 过氧化钠阴离子为过氧根离子,则78g Na2O2固体物质的量为1mol,含有2mol钠离子,1mol过氧根离子,共含有阴、阳离子总数为3NA,故D错误;
故选:C。
5答案及解析:
答案:C
解析:A项,由题图知,在X极上转化为,X极上不 可能有大参与反应,错误B项,由题图知,Y极上得 到电子转化为,此过程中发生了还原反应,Y是正极,错误,C项, 正极(Y极)上的电极反应式 为,当电路中有5 mol电子通过时,正极上得到5 mol电子,有 0.5 mol放出,质量为14 g,正确,.D项,原电池中阴离子移向负 极(X极),错误。
6答案及解析:
答案:B
16
解析:四种短周期主族元素的原子序数依次增大,X的原子半径是短周期主族元素原子中最大的,则X为Na元素;Z与X(Na)形成的离子化合物的水溶液呈中性,则Z为Cl元素;因W与X的简单离子电子层结构相同,且W与Y同族,则W可能为N(或O)元素、Y可能为P(或S)元素。
A项,Na+与N3-(或O2-)电子层结构相同,核电荷数越大,离子半径越小,电子层数越多离子半径越大,故离子半径:Na+Y。D项,最高价氧化物对应的水化物中HClO4是最强的无机酸。
7答案及解析:
答案:A
解析:
8答案及解析:
答案:(1)A;
(2)吸收尾气,并防止空气中的水蒸气进入蒸馏烧瓶;
(3)POCl3+3H2O=H3PO4+3HCl;
(4)温度过低,反应速度太慢,温度过高,PCl3易挥发,利用率低;
(5)①溶液由无色变为红色且30s内不再变色; ②71.0%
解析:
9答案及解析:
答案:I.(1);加热(或煅烧);电解法
(2)ac
(3)
II.在直流电源作用下,通过阴离子交换膜向阳极室移动,脱离浆液;和;NaOH和
解析:I.(1)NaOH是离子化合物,其电子式为;固体混合物中有和,加入NaOH溶液,转化为易溶于水的不能溶于NaOH溶液,
16
转化为易溶于水的不能溶于NaOH溶液,故固体D为,溶液A中含有,向溶液A中通入后生成的沉淀B为,受热分解生成(固体C),工业上常用电解熔融的制备金属铝。
(2)固体D为。与浓盐酸混合,不加热无变化,加热有生成,说明该反应能否有效进行与温度有关;反应停止后,固体有剩余,滴加硫酸又产生,说明该反应能否有效进行与溶液的酸度有关。
(3)通过分析可知反应生成的还原性气体为CO,易水解成的液态化合物为,故反应的热化学方程式为。
II.依据离子交换膜的性质和电解池的工作原理,在直流电源作用下,通过阴离子交换膜向阳极室移动,脱离浆液;在电解过程中,在阳极室失去电子生成,溶液的酸性增强,通过阴离子交换膜移向阳极室的有部分转化为,故分离后含铬元素的粒子是和;在阴极室得到电子生成,溶液中的浓度增大,混合物浆液中的通过阳离子交换膜移向阴极室,故阴极室生成的物质为NaOH和。
10答案及解析:
答案:(1)O2; (2)①+53.1
②30 6×10-2
③大于 温度提高,体积不变,总压强提高;NO2二聚为放热反应,温度提高,平衡左移,体系物质的量增加,总压强提高
④13.4
(3)AC
解析:(1)分析:(1)根据还原剂失去电子转化为氧化产物判断;
(2)①根据盖斯定律计算;
②根据压强之比是物质的量之比计算;
③根据温度对压强和平衡状态的影响分析;
16
④根据五氧化二氮完全分解时的压强计算出二氧化氮、氧气的压强,然后再根据二氧化氮转化的方程式计算平衡时二氧化氮、四氧化二氮的压强。
(3)根据三步反应的特点分析判断。
氯气在反应中得到电子作氧化剂,硝酸银中只有氧元素化合价会升高,所以氧化产物是氧气,分子式为O2;
(2)①已知:ⅰ、2N2O5(g)=2N2O4(g)+O2(g) △H1=-4.4kJ/molⅱ、2NO2(g)=N2O4(g) △H2=-55.3kJ/mol根据盖斯定律可知ⅰ÷2-ⅱ即得到N2O5(g)=2NO2(g)+1/2O2(g) △H1=+53.1kJ/mol;②根据方程式可知氧气与消耗五氧化二氮的物质的量之比是1:2,又因为压强之比是物质的量之比,所以消耗五氧化二氮减少的压强是2.9kPa×2=5.8kPa,则此时五氧化二氮的压强是35.8kPa-5.8kPa=30.0kPa,因此此时反应速率v=2.0×10-3×30=6.0×10-2(kPa·min-1);③由于温度升高,容器容积不变,总压强提高,且二氧化氮二聚为放热反应,温度提高,平衡左移,体系物质的量增加,总压强提高,所以若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)大于63.1 kPa。④根据表中数据可知五氧化二氮完全分解时的压强是63.1kPa,根据方程式可知完全分解时最初生成的二氧化氮的压强是35.8kPa×2=71.6 kPa,氧气是35.8kPa÷2=17.9 kPa,总压强应该是71.6 kPa+17.9 kPa=89.5 kPa,平衡后压强减少了89.5 kPa-63.1kPa=26.4kPa,所以根据方程式2NO2(g) N2O4(g)可知平衡时四氧化二氮对应的压强是26.4kPa,二氧化氮对应的压强是71.6 kPa-26.4kPa×2=18.8kPa,则反应的平衡常数。
(3)A、第一步反应快,所以第一步的逆反应速率大于第二步的逆反应速率,A正确;
B、根据第二步和第三步可知中间产物还有NO,B错误;
C、根据第二步反应生成物中有NO2可知NO2与NO3的碰撞仅部分有效,C正确;
D、第三步反应快,所以第三步反应的活化能较低,D错误。答案选AC。
点睛:
本题主要是考查化学反应原理,侧重于化学反应速率与化学平衡的有关分析与计算,题目难度较大。试题设计新颖,陌生感强,计算量较大,对学生的要求较高。压强和平衡常数的计算是解答的难点,注意从阿伏加德罗定律的角度去理解压强与气体物质的量之间的关系,注意结合反应的方程式和表中数据的灵活应用。也可以直接把压强看作是物质的量利用三段式计算。
16
11答案及解析:
答案:(1)6;
(2)平面三角形; sp2
(3)碳酸盐分解实际过程是晶体中阳离子结合碳酸根离子中氧离子,使碳酸根离子分解为二氧化碳的过程,阳离子所带电荷相同时,阳离子半径越小,其结合氧离子能力越强,对应的碳酸盐就越容易分解
(4)C8H8·C60
(5)4 ;
解析:(1)碳原子核外有6个电子,原子核外没有运动状态相同的电子,即有6种运动状态不同的电子,碳原子价电子排布式为2s22p2,根据泡利原理与洪特规则,价电子排布图为,故答案为:6;;
(2)光气的分子式为COCl2,其分子中C原子形成3个σ键,没有孤对电子,空间结构为平面三角形,杂化轨道数目为3,C原子采取sp2杂化,故答案为:平面三角形;sp2;
(3)碳酸盐分解实际过程是晶体中阳离子结合碳酸根离子中氧离子,使碳酸根离子分解为二氧化碳的过程,阳离子所带电荷相同时,阳离子半径越小,其结合氧离子能力越强,对应的碳酸盐就越容易分解,故答案为:碳酸盐分解实际过程是晶体中阳离子结合碳酸根离子中氧离子,使碳酸根离子分解为二氧化碳的过程,阳离子所带电荷相同时,阳离子半径越小,其结合氧离子能力越强,对应的碳酸盐就越容易分解;
(4)晶胞中C60数目为,立方烷分子填充在原C60晶体的分子间空隙中,位于晶胞的棱心和体心,所以晶胞中立方烷数目,则化学式为C8H8·C60,故答案为:C8H8·C60;
(5)由图可知石墨的晶胞结构为,设晶胞的底边长为acm,晶胞的高为h cm,层间距为d cm,则h=2d,底面图为,
16
则,可得,则底面面积为。根据石墨的晶胞结构,底面图为,欲使角度为60°的顶点排列为无隙并置的结构,每层需要6个(360°÷60°=6),上下两层一共需要12个,所以角度为60°的顶点处原子的占有率为1/12,欲使该顶点对应的侧棱排列成无隙并置的结构只需要一层,所以侧棱处原子的占有率为1/6。欲使角度为120°的顶点排列为无隙并置的结构,每层需要3个(360°÷120°=3),上下两层一共需要6个,所以角度为120°的顶点处原子的占有率为1/6,欲使该顶点对应的侧棱排列成无隙并置的结构只需要一层,所以侧棱处原子的占有率为1/3。所以,晶胞中C原子数目为,晶胞质量为g,则:ρg.cm-3=g÷[(r)2×Sin60°×2d]cm3,整理可得,故答案为:4;。
12答案及解析:
答案:(1)
(2)BD; (3)
(4)
(5)
解析:(1)由以上分析可知A为,故答案为:;
(2)A.化合物B含有苯环,能与氢气发生加成反应,故A正确;
B.化合物D不含酚羟基,不能与FeCl3溶液发生显色反应,故B错误;
16
C.化合物E含有氨基,具有碱性,故C正确;
D.胃复安的分子式是C14H22ClN3O2,故D错误。
故答案为:BD;
(3)C为,经两步合成,由题给信息可知,可先引入甲基,在发生取代反应引入氯原子,反应的流程为,
故答案为:;
(4)D+E→F的化学方程式为+(C2H5)2NCH2CH2NH2→+CH3OH,故答案为:+(C2H5)2NCH2CH2NH2→+CH3OH;
(5)E为(C2H5)2NCH2CH2NH2,对应的同分异构体①1H-NMR谱表明分子中有3种氢原子,IR谱显示有N-H键存在;②分子中没有同一个碳上连两个( )氮的结构结构,则可能的结构为,
故答案为:。
16
16