- 2021-07-06 发布 |
- 37.5 KB |
- 15页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学二轮复习自我检测九含解析
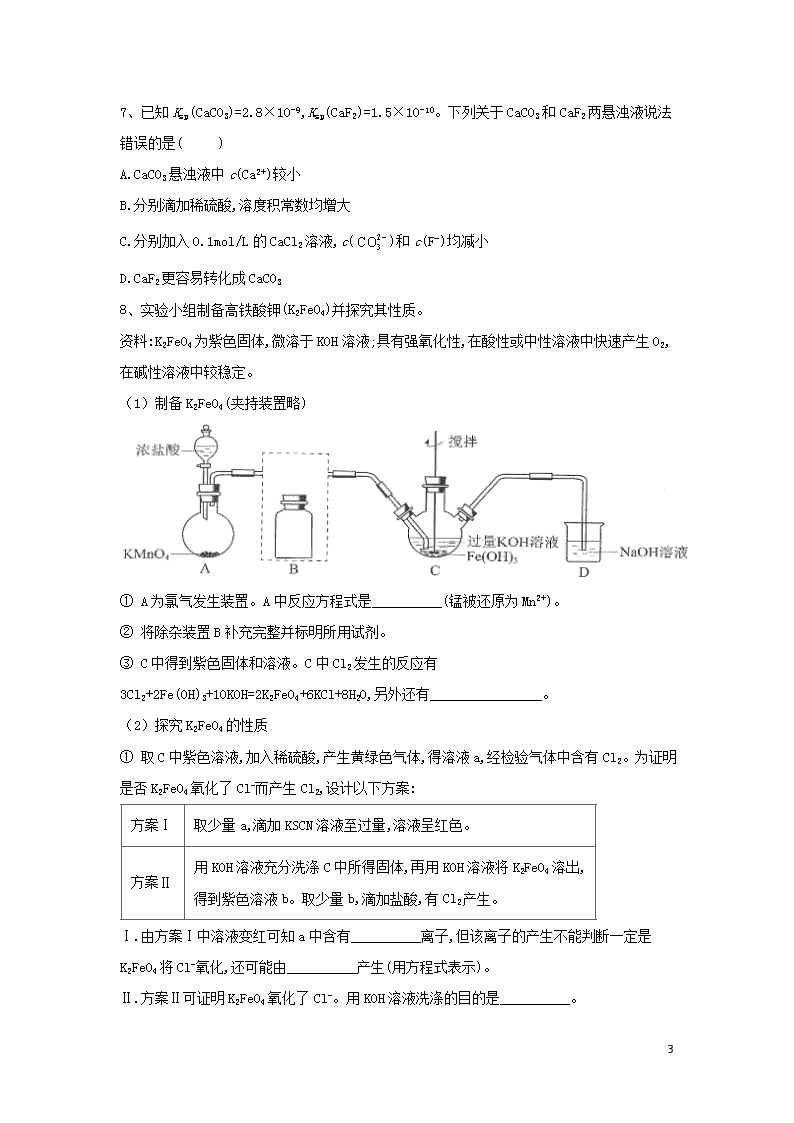
自我检测(九) 1、“化学是人类进步的关键”。下列说法不正确的是 ( ) A.PM2.5是指空气中直径≤2.5μm的固体颗粒或液滴的总称 B.根据分散质粒子的直径大小,分散系可分为溶液、浊液和胶体,浊液的分散质粒子大小介于溶液与胶体之间 C.科学家发现一种新细菌的DNA链中有砷(As)元素,该As元素最有可能取代了普通DNA链中的P元素 D.和CO2反应生成可降解聚合物,该反应符合绿色化学的原则 2、1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃ ,反应装置如图。下列对该实验的描述错误的是( ) A.不能用水浴加热 B.长玻璃管起冷凝回流作用 C.提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤 D.加入过量乙酸可以提高1-丁醇的转化率 3、短周期主族元素X、Y、Z、W的原子序数依次增大,甲、乙分别是X、W两元素对应的单质,丙、丁是由这些元素组成的二元化合物,戊是Z的最高价氧化物对应的水化物,且25℃时0.1 mol/L 戊溶液的pH为13,工业上通过电解丙和丁的混合物来制取甲、乙、戊。下列说法不正确的是( ) A.原子半径:Z>W>Y>X B.Z分别与X、Y、W形成的化合物中一定没有共价键 C.元素Y与X、Z都能组成两种化合物 D.乙与戊的水溶液反应后所得溶液具有漂白性 15 4、磷酸亚铁锂()电池(如图所示)是新能源汽车的动力电池之一。M电极是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导的高分子材料,隔膜只允许通过,电池的总反应为 。下列说法正确的是( ) A.放电时,向M电极移动 B.充电时电路中每通过0.5mol电子,就有36g碳和金属锂复合在一起 C.放电时,M电极的电极反应为 D.充电时,N电极的电极反应为 5、设NA表示阿伏加德罗常数的值,下列叙述中正确的是( ) A.1.8g的NH4+中含有的电子数为1.1NA B.0.1mol/L的MgCl2溶液中,所含Cl-的数目为0.2NA C.42g N2中含有的分子数为1.5NA D.标准状况下,2.24L四氯化碳(CCl4)中含有的分子数为0.1NA 6、以下实验设计能达到实验目的的是( ) 选项 实验目的 实验设计 A 除去固体中的 将固体加热至恒重 B 制备无水 蒸发与稀盐酸反应后的溶液 C 重结晶提纯苯甲酸 将粗品水溶、过滤、蒸发、结晶 D 鉴别和溶液 分别加新制氯水后,用萃取 A.A B.B C.C D.D 15 7、已知Ksp(CaCO3)=2.8×10-9,Ksp(CaF2)=1.5×10-10。下列关于CaCO3和CaF2两悬浊液说法错误的是( ) A.CaCO3悬浊液中c(Ca2+)较小 B.分别滴加稀硫酸,溶度积常数均增大 C.分别加入0.1mol/L的CaCl2溶液,c()和c(F-)均减小 D.CaF2更容易转化成CaCO3 8、实验小组制备高铁酸钾(K2FeO4)并探究其性质。 资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。 (1)制备K2FeO4(夹持装置略) ① A为氯气发生装置。A中反应方程式是__________(锰被还原为Mn2+)。 ② 将除杂装置B补充完整并标明所用试剂。 ③ C中得到紫色固体和溶液。C中Cl2发生的反应有3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O,另外还有________________。 (2)探究K2FeO4的性质 ① 取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案: 方案Ⅰ 取少量a,滴加KSCN溶液至过量,溶液呈红色。 方案Ⅱ 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出, 得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 Ⅰ.由方案Ⅰ中溶液变红可知a中含有__________离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由__________产生(用方程式表示)。 Ⅱ.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是__________。 15 ② 根据K2FeO4的制备实验得出:氧化性Cl2__________FeO42-(填“>”或“<”)而方案Ⅱ实验表明,Cl2和FeO42-的氧化性强弱关系相反,原因是__________。 ③ 资料表明,酸性溶液中的氧化性FeO42->MnO4-,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性FeO42->MnO4-。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:__________。 9、CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题: (1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为__________(写离子符号);若所得溶液c():c()=2:1,溶液pH=__________。(室温下,H2CO3的K1=4×10-7;K2=5×10-11) (2)CO2与CH4经催化重整,制得合成气: CH4(g)+CO2(g)2CO(g)+2H2(g) ①已知上述反应中相关的化学键键能数据如下: 化学键 C—H C=O H—H C O(CO) 键能/kJ·mol-1 413 745 436 1075 则该反应的ΔH=__________。分别在v L恒温密闭容器A)恒容)、B(恒压,容积可变)中,加入CH4和CO2各1mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是__________(填“A” 或“B ”)。 ②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如图3所示。此反应优选温度为900℃的原因是__________ 15 (3)O2辅助的Al—CO2电池工作原理如图4所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。电池的负极反应式:__________,电池的正极反应式:6O2+6e-=6, 6CO2+6O2-=3反应过程中O2的作用是__________,该电池的总反应式:__________。 10、工业采用氯化铵焙烧菱锰矿制备高纯碳酸锰的流程如图所示: 已知: ①菱锰矿的主要成分是,其中含Fe、Ca、Mg、Al等元素。 ②沉淀完全的pH分别为4.7、3.2,开始沉淀的pH分别为8.1、9.1。 ③焙烧过程中主要反应为 回答下列问题: 1.氯化铵的电子式为___。 2.结合图1、2、3,分析焙烧过程中最佳的焙烧温度、焙烧时间、 15 分别为___、___、___。 3.对浸出液净化除杂时,需先加入将转化为,再调节溶液pH的范围为___,将和+变为沉淀而除去,然后加入将+变为氟化物沉淀除去。 4.“碳化结晶”步骤中,加入碳酸氢铵时反应的离子方程式为___。 5.上述流程中可循环使用的物质是___。 6.现用滴定法测定浸出液中的含量。实验步骤:用分析天平称取1.650 g试样,向其中加入稍过量的磷酸和硝酸,加热,搅拌,使反应+2H+充分进行,然后加入稍过量的硫酸铵,除去;加入稀硫酸酸化,用2.0010.00 mL硫酸亚铁铵标准溶液进行滴定,发生的反应为-;用0.1010.00 mL酸性溶液恰好除去过量的(还原产物是) ①酸性溶液与反应(还原产物是)的离子方程式为___。 ②碳酸锰产品中锰的质量分数为___。 11、钕铁硼磁铁是目前为止具有最强磁力的永久磁铁。预计在未来20年里,不可能有替代钕铁硼磁铁的磁性材料岀现。生产钕铁硼磁铁的主要原材料有稀土金属钕、纯铁、铝、硼以及其他稀土原料。 1.钕(Nd)为60号元素,在周期表中第_________周期;基态铁原子的外围电子轨道表示式为__________________。 2.实验测得AlCl3的实际存在形式为Al2Cl6,其分子的球棍模型如图所示。 15 ①已知Al2Cl6分子中正负电荷中心重合,则Al2Cl6属于_________分子(填“极性”或“非极性”),分子中AI原采取__________________杂化。 ②Al2Cl6与过量NaOH溶液反应生成Na[Al(OH)4],[AI(OH)4]-中存在的化学键有_________(填选项字母)。 A.离子键 B.共价键 C.金属键 D.配位键 E.氢键 3.B元素及与其同周期相邻的两种元素第一电离能由小到大的顺序为__________(用元素符号表示)。 4.因材料中含有大量的钕和铁,容易锈蚀是它的一大弱点。可电镀镍(Ni)、锌(Zn)等进行表面涂层处理。已知Ni可以形成[Ni(NH3)6]Cl2,该配合物中配体分子的空间构型为__________。 5.已知立方BN晶体硬而脆,其原因是___________________________;其晶胞结构如图所示,N原子填充在B原子构成的正四面体空隙中,则晶胞中正四面体的空隙填充率为__________________,设晶胞中最近的B、N原子之间的距离为a nm,晶体的密度为b g·cm-3,则阿伏加德罗常数为_________mol-1(列式即可,用含a、b的代数式表示) 12、化合物N具有镇痛、消炎等药理作用,其合成路线如下: (1)A的系统命名为__________,E中官能团的名称为______________。 15 (2)A→B的反应类型为__________,从反应所得液态有机混合物中提纯B的常用方法为__________。 (3)C→D的化学方程式为__________________________。 (4)C的同分异构体W(不考虑手性异构)可发生银镜反应:且1mol W最多与2mol NaOH发生反应,产物之一可被氧化成二元醛。满足上述条件的W有__________种,若W的核磁共振氢谱具有四组峰,则其结构简式为__________。 (5)F与G的关系为(填序号)__________。 a.碳链异构 b.官能团异构 c.顺反异构 d.位置异构 (6)M的结构简式为_________________________。 (7)参照上述合成路线,以为原料,采用如下方法制备医药中间体, 该路线中试剂与条件1为__________,X的结构简式为__________;试剂与条件2为__________,Y的结构简式为__________。 答案以及解析 1答案及解析: 答案:B 解析:A、PM2.5是对空气中直径小于或等于2.5微米(即≤2.5μm)的固体颗粒或液滴的总称,故A正确; B、根据分散质粒子的直径大小,分散系可分为溶液、浊液和胶体,浊液的分散质粒子大小溶液和胶体,故B错误; C、As元素和P元素同主族性质相似,所以科学家发现一种新细菌的DNA链中有砷(As)元素,该As元素最有可能取代了普通DNA链中的P元素,故C正确; D、和CO2发生加聚反应生成可降解聚合物 15 ,无其他物质,原子的利用率达到100%,原子的利用率达到100%,故D正确. 故选B. 2答案及解析: 答案:C 解析:因为该反应温度为115~125℃,而水浴加热的温度不超过100℃,所以该实验不能用水浴加热;长玻璃管起导气和冷凝回流的作用,B正确;酯类物质在NaOH溶液中易发生水解反应,所以不能用NaOH溶液洗涤,C不正确:加入过量乙酸,可使平衡正向移动,1-丁醇的转化率提高,D正确。 3答案及解析: 答案:B 解析: 4答案及解析: 答案:D 解析: 5答案及解析: 答案:C 解析: 6答案及解析: 答案:D 解析:A. 碳酸氢钠加热分解生成碳酸钠,加热将原物质除去,不能除杂,故A错误; B. 蒸发时促进氯化铝水解,生成的盐酸易挥发,则应在HCl气流中蒸发结晶,故B错误; C. 苯甲酸在水中的溶解度不大,应趁热过滤后,选择重结晶法分离提纯,故C错误; D. 氯气与NaBr、NaI反应分别生成溴、碘,在四氯化碳中的颜色不同,则分别加新制氯水后,用CCl4萃取后观察颜色可鉴别,故D正确; 故选D. 7答案及解析: 答案:B 15 解析:Ksp(CaCO3)=2.8×10-9,CaCO3悬浊液中c(Ca2+)=mol/L,,Ksp(CaF2)=1.5×10-10,CaF2悬浊液中c(Ca2+)=mol/L,所以CaCO3悬浊液中c(Ca2+)较小,故A正确;溶度积常数只受温度影响,故分别滴加稀硫酸,溶度积常数都不变,故B错误;分別加入0.1mol/L的CaCl2溶液,钙离子浓度增大,溶解平衡逆向移动,则c()和c(F-)均减小,故C正确;显然,Ksp(CaF2)查看更多
相关文章
- 当前文档收益归属上传用户