- 2021-07-06 发布 |
- 37.5 KB |
- 21页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
福建省漳州市2020届高三毕业班第一次教学质量检测化学试题 Word版含解析
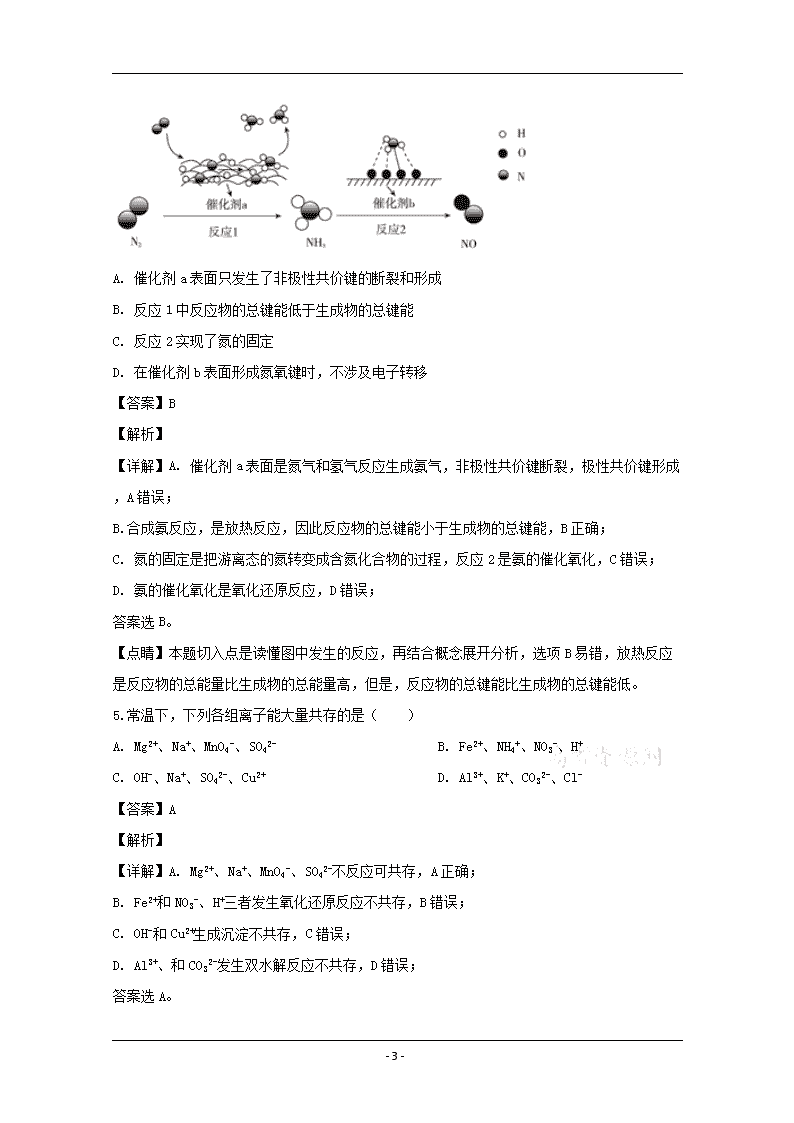
www.ks5u.com 漳州市2020届高三毕业班第一次教学质量检测卷 化学 注意事项: 1.本试题卷共8页,满分100分,考试时间90分钟。 2.答题前,考生务必将自己的姓名、准考证号等填写在答题卡的相应位置。 3.全部答案在答题卡上完成,答在本试题卷上无效。 4.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。 5.考试结束后,将本试题卷和答题卡一并交回。 可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35.5 Mn-55 一、选择题(本题共14小题,每小题3分,共42分) 1.化学与生活密切相关。下列叙述不正确的是( ) A. “信口雌黄”中的雌黄因与纸张颜色相近被称为古代的“修正带”,它的修正原理不涉及化学变化 B. “乌桕,实如鸡头,液如猪脂,可压油为烛”,古代的蜡烛成分为烃 C. 珍珠奶茶中的“珍珠”是由淀粉制成,淀粉属于糖类 D. 硅胶(主要成分为SiO2·nH2O)对水分子具有极强的吸附性,可以用作袋装食品的干燥剂 【答案】B 【解析】 【详解】A.雌黄的修正原理利用的是与纸张颜色相近这一点,颜色属于物理性质,修正过程不涉及化学变化,A正确; B.乌桕种子有一层蜡质表皮,是制蜡的上品,桕子榨油,混入融化的白蜡,倒进模具内,凝结后便是桕烛,古代的蜡烛不属于烃,B错误; C.淀粉属于糖类,是一种多糖,C正确; D.硅胶对水分子具有极强的吸附性,对人体无毒无害,是常用的袋装食品干燥剂,D正确; 答案选B。 2.下列化学用语正确的是( ) A. 质子数为7、中子数为8的氮原子:N B. 甲烷的球棍模型 - 21 - C. 苯的结构式:C6H6 D. 氯化铵的电子式: 【答案】A 【解析】 【详解】A.氮原子的质量数为15,表示为N,A正确; B. 是甲烷的比例模型,B错误; C. C6H6是苯的分子式,C错误; D. 中氯离子的电子式书写错误,正确的为,D错误; 答案选A。 3.设NA为阿伏加德罗常数的值,下列说法正确的是( ) A. 标准状况下,2.24L苯在氧气中完全燃烧,得到0.6NA个CO2分子 B. 1.6gCD4中所含质子数为NA C. 1mol·L-1氯化铜溶液中的Cl-数为2NA D. 32g由氧气和臭氧组成的混合物中含有氧原子的数目为2NA 【答案】D 【解析】 【详解】A. 标准状况下,苯为液体,2.24L苯不是0.1mol,A错误; B. CD4摩尔质量是20g/mol,1.6g CD4物质的量是0.08mol,质子的物质的量为0.8mol,所含质子数为0.8mol NA,B错误; C溶液体积不知道,无法求Cl-数,C错误; D.氧气和臭氧组成的混合物中含有氧原子共32g,氧原子的物质的量为2mol,数目为2NA,D正确; 答案选D。 4.氮及其化合物的转化过程如图所示,下列分析正确的是( ) - 21 - A. 催化剂a表面只发生了非极性共价键的断裂和形成 B. 反应1中反应物的总键能低于生成物的总键能 C. 反应2实现了氮的固定 D. 在催化剂b表面形成氮氧键时,不涉及电子转移 【答案】B 【解析】 【详解】A. 催化剂a表面是氮气和氢气反应生成氨气,非极性共价键断裂,极性共价键形成,A错误; B.合成氨反应,是放热反应,因此反应物的总键能小于生成物的总键能,B正确; C. 氮的固定是把游离态的氮转变成含氮化合物的过程,反应2是氨的催化氧化,C错误; D. 氨的催化氧化是氧化还原反应,D错误; 答案选B。 【点睛】本题切入点是读懂图中发生的反应,再结合概念展开分析,选项B易错,放热反应是反应物的总能量比生成物的总能量高,但是,反应物的总键能比生成物的总键能低。 5.常温下,下列各组离子能大量共存的是( ) A. Mg2+、Na+、MnO4-、SO42- B. Fe2+、NH4+、NO3-、H+ C. OH-、Na+、SO42-、Cu2+ D. Al3+、K+、CO32-、Cl- 【答案】A 【解析】 【详解】A. Mg2+、Na+、MnO4-、SO42-不反应可共存,A正确; B. Fe2+和NO3-、H+三者发生氧化还原反应不共存,B错误; C. OH-和Cu2+生成沉淀不共存,C错误; D. Al3+、和CO32-发生双水解反应不共存,D错误; 答案选A。 - 21 - 【点睛】B容易错选,因为Fe2+ 、NO3-和H+三者发生的氧化还原反应比较隐蔽,同学要多熟悉溶液中具有强氧化性、强还原性的离子,也要注意溶液酸碱性对反应的影响,例如S2-、SO32-、和H+不能共存,但是S2-、SO32-、和OH-能共存。 6.下列离子方程式书写正确的( ) A. Al(OH)3沉淀溶于NaOH溶液:Al3++4OH-=AlO2-+2H2O B. 在酸性溶液中KBrO3与KBr反应:5Br-+BrO3-+3H2O=3Br2+6OH- C. 向Ba(OH)2溶液中滴加稀硫酸:Ba2++OH-+H++SO42-=H2O+BaSO4↓ D. 溴化亚铁溶液中通入足量的氯气:3Cl2+2Fe2++4Br-=6Cl-+2Fe3++2Br2 【答案】D 【解析】 【详解】A. Al(OH)3是沉淀,不能拆写,A错误; B. 在酸性溶液中不会生成大量OH-,应为5Br-+BrO3-+6H+=3Br2+3H2O,B错误; C. OH-、H+以及H2O的化学计量数应该均为2,C错误; D. 由于通入足量的氯气,溴化亚铁溶液中Fe2+和Br-按物质的量之比为1:2的比例被完全氧化,D正确; 答案选D。 【点睛】C容易出错为Ba2++OH-+H++SO42-=H2O+BaSO4↓原因,是没有考虑滴入的稀硫酸中H+与SO42-物质的量之比为2:1,两个离子均被Ba(OH)2溶液中Ba2+和OH-完全反应,正确的离子方程式Ba2++2OH-+2H++SO42-=2H2O+BaSO4↓中则体现了这一点。 7.指甲花中的β-紫罗兰酮属于一种萜类化合物,可作为合成维生素A的原料,其结构如图所示。下列有关β-紫罗兰酮的说法正确的是( ) A. β-紫罗兰酮的分子式为C13H18O B. 分子中所有碳原子可能处于同一平面 C. 与足量的H2反应后,分子中只含1种官能团 D. 不能被酸性KMnO4溶液氧化 【答案】C 【解析】 【详解】A. 分子式应为C13H20O,A错误; - 21 - B. 环上有一个碳原子连着2个甲基,所以分子中所有碳原子不可能处于同一平面,B错误; C. 分子中碳碳双键与氢气加成,变为饱和键,分子中羰基与足量的H2反应后,有羟基生成,C正确; D. 分子中所含碳碳双键,能被酸性KMnO4溶液氧化,D错误; 答案选C。 8.已知:三氧化硫的沸点为45℃,熔点为16.8℃,具有很强的氧化性和挥发性。如图是快速制备三氧化硫的实验装置图,其中装置Ⅰ和Ⅲ中都加入了金属铜,下列说法不正确的是( ) A. 装置Ⅰ和Ⅲ都需要加热 B. 本实验制备三氧化硫(SO3)的原理为NO2+SO2=NO+SO3 C. 连接反应器与尾气处理装置不宜使用橡胶管 D. 实验结束后,往反应器中滴加水,瓶内红棕色逐渐褪去 【答案】A 【解析】 【详解】A. 装置Ⅰ内铜和浓硝酸反应制NO2不需要加热,Ⅲ内铜和浓硫酸反应制SO2需要加热,A错误; B. 装置Ⅱ内SO2被NO2氧化为SO3,制备三氧化硫(SO3)的原理为NO2+SO2=NO+SO3,B正确; C. NO2、SO3具强氧化性,会腐蚀橡胶管,C正确; D. 水会和红棕色NO2反应得到硝酸和NO而褪色,D正确; 答案选A。 9.下列关于化学反应与能量的说法正确的是( ) A. 已知正丁烷的燃烧热为2878kJ·mol-1,则表示正丁烷燃烧热的热化学方程式为2CH3CH2CH2CH3(g)+13O2(g)=8CO2(g)+10H2O(l) ΔH=-2878kJ·mol-1 B. 已知在一定条件下,2molSO2与1molO2充分反应后,释放出98kJ的热量,则其热化学方程式为2SO2(g)+O2(g)2SO3(g) ΔH=-98kJ·mol-1 - 21 - C. 已知稀盐酸与稀NaOH溶液反应的中和热为57.3kJ·mol-1,则表示稀硫酸与稀NaOH溶液反应的热化学方程式为H2SO4(aq)+NaOH(aq)=Na2SO4(aq)+H2O(l) ΔH=-57.3kJ·mol-1 D. 已知CuSO4(s)+5H2O(l)=CuSO4·5H2O(s),该反应为熵增加的反应 【答案】C 【解析】 【详解】A. 燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量,则表示正丁烷燃烧热的热化学方程式为CH3CH2CH2CH3(g)+O2(g)=4CO2(g)+5H2O(l) ΔH=-1439kJ·mol-1,A错误; B. 不知道该条件下物质的状态,该反应是可逆反应,2molSO2与1molO2充分反应后,实际消耗多少不得而知,所以无法写出热化学方程式,B错误; C. 在稀溶液中酸和碱发生中和反应生成1molH2O放出的热量是中和热,C正确; D. 从液态H2O到固态CuSO4·5H2O,且物质的量减少,该反应熵减,D错误; 答案为C。 【点睛】B容易出错, 2SO2(g)+O2(g)2SO3(g) ΔH=-98kJ·mol-1,这样的可逆反应,代表的是实际消耗2molSO2(g)和1molO2(g)生成2molSO3(g)时,放热98kJ。 10.W、X、Y、Z为原子序数依次递增的短周期主族元素,其中X的某同位素可用于测量文物年代,M为由X元素构成的一种单质。甲和丁两种物质都由W和Y元素组成,乙由Y和Z元素组成,常温下为气体,具有漂白性,戊为二元强酸。它们之间的转化关系如下,下列叙述正确的是( ) A. 气态氢化物的稳定性:X>Y>Z B. 原子半径顺序:Z>Y>X>W C. 丁的水溶液适用于医用伤口消毒及环境消毒 D. 常温常压下,M能和丙发生化合反应 【答案】C 【解析】 【分析】 据题意可推断:W为H、X为C、Y为O、Z为S,甲和丁两种物质分别为H2O,H2O2,乙为SO2,丙为CO2,戊为二元强酸H2SO4; - 21 - 【详解】A. 非金属性:O> C,所以气态氢化物的稳定性:H2O>CH4,A错误; B. 同一周期,从左到右,原子半径减小,故原子半径顺序:C>O,B错误; C. H2O2水溶液因为强氧化性可杀菌消毒,且还原产物是H2O适用于医用伤口消毒,C正确; D. 常温常压下,碳的单质与CO2不反应,高温下才反应,D错误; 答案选C。 11.下列实验操作、现象、结论或解释均正确的是( ) 选项 实验操作 实验现象 结论或解释 A 向某溶液中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 试纸不变蓝 原溶液中无NH4+ B 往加有酚酞的碳酸钠溶液中加入足量的CaCl2溶液 产生白色沉淀,红色褪去 证明CO32-水解呈碱性 C 向NaOH溶液中滴加足量的MgCl2溶液,然后再滴加CuCl2溶液 先产生白色沉淀,然后沉淀变蓝色 Ksp[Cu(OH)2]>Ksp[Mg(OH)2] D 用硫酸作催化剂的淀粉水解液中,加入新制Cu(OH)2悬浊液,加热 无砖红色沉淀生成 淀粉未发生水解 A. A B. B C. C D. D 【答案】B 【解析】 【详解】A. 滴加的是稀NaOH溶液且没有加热,难于产生氨气,难以判断原溶液中无NH4+,A错误; B. 加有酚酞的碳酸钠溶液呈红色,红色溶液中加入足量的CaCl2溶液,钙离子把碳酸根离子沉淀完全的同时,红色也褪去,证明原溶液的碱性是CO32-水解所致,B正确; C. 溶解度小的沉淀易向溶解度更小的沉淀转化,得出的结论应是Ksp[Cu(OH)2]<Ksp[Mg(OH)2],C错误; D. 淀粉水解液中含硫酸,未加碱中和直接加入新制Cu(OH)2悬浊液,导致Cu(OH)2 - 21 - 被消耗,达不到预期现象,D错误; 答案选B。 【点睛】D容易错,淀粉水解一般在稀硫酸催化下进行,检测还原性糖的生成,应该选碱性环境,先在水解液中加过量NaOH溶液,再加新制的Cu(OH)2悬浊液,加热;而检测淀粉有没有水解完全?应该直接在水解液中加碘水,观察是否变成特殊的蓝色,若变蓝,则证明淀粉没有完全水解,若不变蓝,则水解完全。 12.复旦大学的王永刚教授研究团队在柔性电池研究方面取得了新突破,发展了一种基于有机物电极材料的柔性水系锌电池。充放电过程中实现了芘四酮 (PTO)与PTO-Zn的相互转化,原理如图所示。下列说法不正确的是( ) A. 放电时,Zn电极发生氧化反应 B. 放电时,Y极反应式可表示为PTO+2e-+Zn2+=PTO-Zn C. 充电时,Zn2+向Y极移动 D. 充电时,X电极与电源负极相连 【答案】C 【解析】 【详解】A. 放电时是原电池,电子从Zn电极流出,Zn发生氧化反应,说法正确,A不符合; B. 放电时,Y极是正极,反生还原反应,说法正确,B不符合; C. 充电时是电解池,Zn2+是阳离子应向阴极移动,Y极在充电时是阳极,说法错误,C符合; D. 充电时,X电极是阴极,与电源负极相连,说法正确,D不符合; 答案选C。 【点睛】二次电池的电极,放电时正极,充电时则为阳极;放电时负极,充电时则为阴极; 原电池负极的判断:电子流出那一极是负极,发生氧化反应的一极是负极,阴离子向负极移动,负极有可能因参加反应溶解而变细,如果是二次电池,与电源负极相连的那一极,在放电时是负极。 13.常温下,向20.00mL0.10mol·L-1NH4Cl溶液中逐滴加入0.10mol·L-1 - 21 - NaOH溶液时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发),其中d点为反应终点。下列说法不正确的是( ) A. V=20.00mL B. 常温下,Kb(NH3·H2O)的数量级为10-5 C. b点溶液中:c(Cl-)>c(Na+)>c(H+)=c(OH-) D. c点的混合溶液中:c(NH4+)=c(Na+) 【答案】D 【解析】 【分析】 A. d点溶液是反应终点,按恰好完全反应来分析; B. a点溶液是氯化铵溶液水解呈酸性,常温下pH为5,结合水解常数与电离平衡常数的关系估算; C. b点溶液恰好呈中性,加入的碱溶液体积小于10.00mL来判断; D. c点的混合溶液中,一水合氨和氯化铵的物质的量相等,根据电荷守恒和物料守恒分析; 【详解】A. d点为反应终点,加入NaOH的体积为20.00mL时,恰好完全反应生成NH3⋅H2O和NaCl,说法正确,不符合; B. 常温下,a点对应的0.10mol·L-1NH4Cl溶液,存在水解平衡, ,Kb(NH3·H2O)10-5,说法正确,不符合; C. b点溶液恰好呈中性,加入NaOH的体积小于10.00mL:混合溶液中c(Cl-)>c(Na+)>c(H+)=c(OH-),说法正确,C不符合; - 21 - D. c点溶液为加入NaOH的体积为10.00mL,恰得到物质的量均为10-3mol的NH3⋅H2O和NH4Cl,溶液中存在电荷守恒:,由物料守恒:,两个式子合并得到:,因为c点溶液呈碱性,所以 >c(Na+),D选项说法错误,D符合; 答案选D。 14.反应2NO+Cl2=2NOCl在295K时,其反应物浓度与反应速率关系的数据如下: c(NO)/(mol·L-1) c(Cl2)/(mol·L-1) v(Cl2)/(mol·L-1·s-1) ① 0.100 0.100 8.0×10-3 ② 0.500 0.100 2.0×10-1 ③ 0.100 0.500 4.0×10-2 注:①反应物浓度与反应速率关系式为v(Cl2)=k·cm(NO)cn(Cl2)(式中速率常数k=Ae-Ea/RT,其中Ea为活化能,A、R均为大于0的常数,T为温度);②反应级数是反应的速率方程式中各反应物浓度的指数之和。下列说法不正确的是( ) A. m=2,n=1,反应级数为3级 B. 当c(NO)=0.200mol·L-1,c(Cl2)=0.300mol·L-1,v(NO)=0.192mol·L-1·s-1 C. 加入催化剂可以改变反应途径,也可以增大速率常数k,而加快反应速率 D. 升高温度,可以增大反应的活化能Ea,从而使速率常数k增大 【答案】D 【解析】 分析】 由表中①③数据可知,n=1,由①②组数据可知,m=2,由①数据可知; 【详解】A.据数据分析知m=2,n=1,反应级数为3级,A正确; - 21 - B. 当c(NO)=0.200mol·L-1,c(Cl2)=0.300mol·L-1,v(NO)=2v(Cl2)=2×8.0××0.300mol·L-1·s-1=0.192mol·L-1·s-1,B正确; C. 催化剂可降低反应的活化能,增大活化分子数目,增大反应速率,C正确; D. 升高温度,活化能不变,D错误; 答案选D。 二、非选择题(本题共5小题,共58分) 15.A是来自石油的基本化工原料,其分子式为C2H4。B和D是生活中两种常见的有机物,F是高分子化合物。它们之间的相互转化关系如图所示: (1)C中官能团名称是__。 (2)在反应①~⑥中,属于取代反应的是__(填序号)。 (3)用于鉴别B、D的试剂是__(任写一种)。 (4)写出A→F的化学方程式:__。 (5)请写出G的同分异构体中含有羧基的结构简式:__。 【答案】 (1). 醛基 (2). ④⑤ (3). Na2CO3溶液(或紫色石蕊试液等) (4). nCH2=CH2 (5). CH3CH2CH2COOH、(CH3)2CHCOOH 【解析】 【分析】 A是来自石油的基本化工原料,其分子式为C2H4,即乙烯,B、C和D分别为乙醇、乙醛和乙酸,G为乙酸乙酯,E为乙酸钠,F为聚乙烯,据此回答; 【详解】(1)C为乙醛,所含官能团为醛基; 答案为:醛基; (2)酯化反应和酯的水解属于取代反应; 答案为:④⑤; - 21 - (3)B、D分别是乙醇和乙酸,乙醇呈中性,乙酸呈酸性,可利用紫色石蕊试液(溶液变红)(或碳酸钠溶液,产生气体)鉴别; 答案为:紫色的石蕊试剂; (4)A→F是乙烯的加聚反应, 答案为: (5)G为CH3COOCH2CH3,分子式为C4H8O2,含有羧基的同分异构体为羧酸,CH3CH2CH2COOH、(CH3)2CHCOOH; 答案为: CH3CH2CH2COOH、(CH3)2CHCOOH。 16.二氧化氯是一种高效消毒剂,通常状况下二氧化氯易溶于水,沸点为11.0℃,极易爆炸,制取和使用二氧化氯时要用性质稳定的气体按一定比例稀释,以防爆炸。某实验小组在干燥空气稀释条件下,用干燥的氯气与固体亚氯酸钠制备二氧化氯,实验装置如图所示: (1)仪器a的名称为__,装置A中反应的化学方程式为__。 (2)试剂X是__。 (3)装置D中冰水的主要作用是__。装置D内发生反应的化学方程式为__。 (4)工业上也常用盐酸或双氧水还原NaClO3制备ClO2,相比之下用双氧水制备ClO2方法更优,可能的原因是__。 (5)装置E中主要反应的离子方程式为:__。 (6)已知NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。 ①请完成实验室利用NaClO2溶液制得NaClO2晶体的操作步骤:a.减压,55℃蒸发结晶;b.__;c.用38~60℃的温水洗涤;d.低于60℃干燥,得到产品。 ②取上述所得产品2.50g溶于水配成250mL溶液,取出25.00mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应后(NaClO2被还原为Cl-,杂质不参加反应),加入2~3滴淀粉溶液,用0.500mol·L-1Na2S2O3 - 21 - 标准液滴定至终点。进行3次实验后,平均用去标准液18.80mL,试计算NaClO2产品的纯度:__(已知:2Na2S2O3+I2=Na2S4O6+2NaI)。 【答案】 (1). 分液漏斗 (2). MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O (3). 饱和食盐水 (4). 冷凝ClO2 (5). 2NaClO2+Cl2=2NaCl+2ClO2 (6). H2O2的氧化产物为O2不会污染环境(或HCl的氧化产物为Cl2会污染环境) (7). Cl2+2OH-=Cl-+ClO-+H2O (8). 趁热过滤 (9). 85.07%(或“0.8507”等) 【解析】 【分析】 (1)装置A是制取氯气用的,要注意反应条件,其中浓盐酸通过分液漏斗滴加; (2)试剂X用于去除Cl2中的HCl气体,据此选择试剂; (3)装置B的目的可从信息“沸点为11.0℃,极易爆炸”来推知,写装置D中用干燥的氯气与固体亚氯酸钠反应制备二氧化氯方程式,注意氧化还原中同种元素的价态变化; (4)相比之下用双氧水制备ClO2方法更优,从是否环境友好型来分析; (5)装置E是氢氧化钠溶液吸收多余氯气的反应; (6)①利用NaClO2溶液制得NaClO2晶体最关键是控制结晶的温度:高于38℃低于60℃; ②要计算NaClO2产品的纯度:最关键找到Na2S2O3 和NaClO2的关系式,代入数据计算即可; 【详解】(1)装置A是MnO2和浓HCl在共热条件下发生反应制取氯气用的,其中浓盐酸通过分液漏斗滴加; 答案为:分液漏斗; MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O; (2)试剂X用于去除Cl2中的HCl气体,所以选择饱和食盐水; 答案为:饱和食盐水; (3)装置B的目的是为防止气态ClO2爆炸,利用冰水浴降温,使ClO2冷凝;装置D中用干燥的氯气与固体亚氯酸钠反应得到二氧化氯,并同时生成NaCl,发生反应的化学方程式为2NaClO2+Cl2=2NaCl+2ClO2; 答案为:冷凝ClO2;2NaClO2+Cl2=2NaCl+2ClO2; (4)相比之下用双氧水制备ClO2方法更优,因为H2O2的氧化产物为O2不会污染环境(或HCl的氧化产物为Cl2会污染环境); 答案为:H2O2的氧化产物为O2不会污染环境(或HCl的氧化产物为Cl2会污染环境); (5)装置E是氢氧化钠溶液吸收多余氯气的反应,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O; 答案为:Cl2+2OH-=Cl-+ClO-+H2O (6)①利用NaClO2溶液制得NaClO2 - 21 - 晶体最关键是控制结晶的温度:高于38℃低于60℃;故操作为将装置D反应后的溶液在55℃条件下减压蒸发结晶,趁热过滤,再用38℃~60℃的温水洗涤,最后在低于60℃条件下干燥,得到NaClO2晶体; 故答案为:趁热过滤; ②要计算NaClO2产品的纯度:最关键找到Na2S2O3 和NaClO2的关系式,代入数据计算即可; =85.07%; 答案为:85.07%或0.8507。 17.碳酸锰可用作脱硫的催化剂,是合成二氧化锰和制造其他锰盐的原料。工业上从锰泥(主要含KMnO4和少量MnO2、CuO、PbO等)中回收MnCO3的流程如图所示: 回答下列问题: (1)“滤渣1”中的主要成分为PbSO4,其中Pb元素的化合价是__。 (2)Fe2+能将MnO2还原为Mn2+,该反应的离子方程式:__。 为检验FeSO4是否被氧化,可往滤液1中加入__溶液(填化学式)。 (3)已知Ksp[Fe(OH)3]=4.0×10-38,通入NH3调pH=4时,溶液中c(Fe3+)=__。 (4)流程中加入固体X能使Cu2+沉淀,则最适宜的固体X为__(填字母)。 a.MnS b.ZnS c.Ca(OH)2 d.Ba(OH)2 (5)加入氨水和过量NH4HCO3生成MnCO3沉淀的离子方程式为__。 (6)处理锰泥时,H2SO4、FeSO4混合溶液中比值不宜过大,请从节约药品的角度分析,原因是___。 (7)若利用100t锰泥制得55tMnCO3,反应中Mn元素的转化率为80.0%,则锰泥中Mn元素的质量分数为__%(精确到小数点后1位)。 - 21 - 【答案】 (1). +2 (2). 4H++2Fe2++MnO2=Mn2++2Fe3++2H2O (3). KSCN (4). 4.0×10-8mol·L-1 (5). a (6). Mn2++NH3·H2O+HCO3-=MnCO3↓+NH4++H2O (7). 在调节pH环节会多消耗氨气 (8). 32.9 【解析】 【分析】 锰泥(主要成分为KMnO4和少量MnO2、CuO、PbO等)加入硫酸、硫酸亚铁的混合溶液,过滤,滤渣1为PbSO4,滤液1含有Mn2+、Cu2+等,通入氨气调节pH=4,可生成氢氧化铁沉淀,加入MnS,生成CuS沉淀,即滤渣2,用氨水调节pH为6.5-7.2,加入过量碳酸氢铵,过滤、洗涤、干燥,可得MnCO3,以此解答该题。 (1)PbSO4中Pb元素的化合价+2; (2)Fe2+能将MnO2还原为Mn2+,书写离子方程式时注意酸性环境;检验FeSO4是否被氧化,检验的是氧化产物Fe3+; (3)已知Ksp[Fe(OH)3]=4.0×10-38=c(Fe3+)c3(OH-),通过pH=4即可求c(Fe3+); (4)固体X能使Cu2+沉淀,则最适宜的固体X必定能最大程度地沉淀Cu2+,同时不引人杂质; (5)加入氨水和过量NH4HCO3生成MnCO3沉淀的核心转化是碳酸氢根转成碳酸根被沉淀生成MnCO3; (6)那么太多的氢离子肯定会多消耗碱; (7)从锰泥到MnCO3,抓住反应中Mn元素的转化率为80.0%计算; 【详解】(1)PbSO4中Pb元素的化合价+2; 答案为:+2; (2)Fe2+能将MnO2还原为Mn2+,因为是酸性环境,所以反应方程式为4H++2Fe2++MnO2=Mn2++2Fe3++2H2O;检验FeSO4氧化产物Fe3+,检验时试剂用KSCN; 答案为:4H++2Fe2++MnO2=Mn2++2Fe3++2H2O ;KSCN; (3)已知Ksp[Fe(OH)3]=4.0×10-38=c(Fe3+)c3(OH-),因为调节pH=4,即c (OH-)=10-10mol/L则; 答案为:4.0×10-8mol·L-1; (4)固体X能使Cu2+沉淀,则最适宜的固体X必定能最大程度地沉淀Cu2+,同时不引人杂质,最佳为MnS; 答案为:a; - 21 - (5)加入氨水和过量NH4HCO3生成MnCO3沉淀的核心,把碳酸氢根转成碳酸根被沉淀生成MnCO3,所以反应为Mn2++ +=MnCO3↓+NH4++H2O; 答案为:Mn2+++=MnCO3↓+NH4++H2O (6)那么太多的氢离子肯定会多消耗碱,此处用氨气来调节pH,所以会多消耗氨气; 答案为:在调节pH环节会多消耗氨气 (7)从锰泥到MnCO3,抓住反应中Mn元素的转化率为80.0%计算,=32.9%; 答案为:32.9。 18.氢能作为新型能源,可利用CO制得.北京大学马丁教授等团队向容积为VL的密闭容器中充入等物质的量的CO和H2O进行反应。 已知: 反应Ⅰ:FeO(s)+CO(g)Fe(s)+CO2(g) ΔH1 反应Ⅱ:FeO(s)+H2(g)Fe(s)+H2O(g) ΔH2 反应Ⅲ:CO(g)+H2O(g)CO2(g)+H2(g) ΔH 反应Ⅲ在不同催化剂作用下(反应相同时间),温度与CO转化率的关系如图所示。 (1)反应Ⅲ的ΔH与ΔH1、ΔH2关系式:ΔH=_。 (2)若反应Ⅰ和反应Ⅱ的平衡常数分别为K1和K2,则反应Ⅲ的平衡常数K与K1、K2的关系式:K=___。 (3)随着温度的升高,CO的转化率先升后降,“后降”的可能原因是__。 (4)由图可知,ΔH__0(填“大于”或“小于”),催化剂应选择_(填“Au/α-MoC”或“Au/α-MoC/NaCN”) - 21 - (5)已知T=1025K时,K=1。则平衡时CO的转化率α(0)=__。当T>1025K时,平衡时,H2的体积分数ω的取值范围为_。此时,CO还原FeO(s)的能力__H2(填“大于”或“小于”)。 (6)欲提高H2的体积分数,可采取的措施为__。 【答案】 (1). ΔH1-ΔH2 (2). (3). 温度过高,催化剂的催化活性下降 (4). 小于 (5). Au/α-MoC (6). 50% (7). 0<ω<25% (8). 小于 (9). 及时分离出CO2(或降低温度) 【解析】 【分析】 (1)用盖斯定律进行分析; (2)热化学方程式相减,化学平衡常数相除; (3)在一定温度范围内催化剂活性较高; (4)升高温度CO转化率降低,说明平衡逆向移动;温度越低、催化剂活性越高越好,据此选择催化剂; (5)已知T=1025K时,K=1,可用三段式计算出CO、H2O、CO2、H2的物质的量相等,求出CO的转化率、得氢气的体积分数为25%;升高温度平衡逆向移动,氢气的体积分数有所下降,据此判断出体积分数的范围0<ω<25%;平衡逆向移动导致c(CO)>c(H2);选取的催化剂受温度影响; (6)欲提高H2的体积分数,可以通过改变条件使平衡正向移动而实现; 【详解】(1)反应Ⅰ:FeO(s)+CO(g)Fe(s)+CO2(g) ΔH1,反应Ⅱ:FeO(s)+H2(g)Fe(s)+H2O(g)ΔH2,将反应Ⅰ减去反应Ⅱ得到反应Ⅲ:CO(g)+H2O(g)CO2(g)+H2(g) ΔH,ΔH=ΔH1-ΔH2; 答案为:ΔH1-ΔH2; (2)根据反应Ⅰ、反应Ⅱ,写出各自的平衡常数表达式K1= ,K2= ;热化学方程式相减,反应Ⅲ:CO(g)+H2O(g)CO2(g)+H2(g),化学平衡常数相除,则反应Ⅲ的平衡常数K与K1、K2的关系式为:; - 21 - 答案为:; (3)在一定温度范围内催化剂活性较高,温度过高,催化剂的催化活性下降; 答案为:温度过高,催化剂的催化活性下降; (4)升高温度CO转化率降低,说明平衡逆向移动,则正反应为放热反应,△H <0;温度越低、催化剂活性越高越好,根据图知,应该选取Au/α-MoC; 答案为:小于;Au/α-MoC; (5)已知向容积为VL的密闭容器中充入等物质的量的CO和H2O进行反应,设充入的气体各为1mol,T=1025K时,K=1, 得x=0.5,= 、;反应未发生时没有氢气,升高温度平衡逆向移动,氢气的体积分数有所下降,据此判断出体积分数的范围0<ω<25%;平衡逆向移动导致c(CO)>c(H2); 答案为:50%;0<ω<25%;小于; (6)欲提高H2的体积分数,可以通过改变条件使平衡正向移动而实现; 答案为:及时分离出CO2(或降低温度)。 19.开发稳定高效的脱硫脱硝工艺是当前国内外研究的热点。 (1)天然气中含有的H2S会腐蚀管道和设备,可在1200℃下进行脱硫处理,其中涉及H2S与O2的反应,产物为SO2和水蒸气。若1molH2S参与该反应放热586.16kJ,则该反应的热化学方程式是__。 (2)烟气中的SO2可用“双碱法”洗除:先用NaOH溶液吸收烟气中的SO2,再往所得溶液中加入CaO,反应得到NaOH和CaSO3,原理可表示为:NaOH(aq)Na2SO3(aq)。 ①Na2SO3溶液中阴离子的浓度由大到小的顺序:__。 ②“双碱法”洗除SO2的优点是__(任写一点)。 (3)过二硫酸钾(K2S2O8 - 21 - )是一种白色、无味品体,溶于水,不溶于乙醇,有强氧化性。可作为燃煤锅炉烟气脱硝的氧化剂。 ①S2O82-的结构式为,则过二硫酸钾(K2S2O8)所含化学键有:__,1个S2O82-中含有化合价为-1价的氧原子的个数是___。 ②脱硝过程中依次发生两步反应:第1步K2S2O8将NO氧化成HNO2,第2步K2S2O8继续氧化HNO2,第2步的氧化产物为__。 ③实验室中通过电解饱和KHSO4水溶液的方法制备K2S2O8。 电极B为电解池__极(填“阳”或“阴”,气体a为__(写化学式),电极A的电极反应式为__。 【答案】 (1). H2S(g)+O2(g)=SO2(g)+H2O(g) ΔH=-586.16kJ·mol-1 (2). c(SO32-)>c(OH-)>c(HSO3-) (3). 用CaO可使NaOH再生(或可获得副产物石膏等其他合理答案) (4). 离子键、共价键 (5). 2 (6). HNO3 (7). 阴 (8). H2 (9). 2SO42--2e-=S2O82-(或2HSO4--2e-=S2O82-+2H+) 【解析】 【分析】 (1)写热化学方程式时注意状态及化学计量数与ΔH的比例关系; (2)①Na2SO3溶液水解呈碱性,按水解程度不大,把三种阴离子的浓度c(SO32-)、(OH-)、c(HSO3-)排序;②“双碱法”洗除SO2的优点可从提高原料利用率等综合经济效益的角度思考; (3)根据结构式,过二硫酸钾(K2S2O8)是含复杂离子的离子化合物,可据此判断化学键;求-1价的氧原子的个数,就是指氧原子之间共用一对电子对的那几个氧原子;HNO2的氧化产物只能为硝酸;电解饱和KHSO4水溶液制备K2S2O8,是KHSO4被氧化反应,按反应类型判断出电极A为阳极,并可写出电极A的电极反应式;气体a则是阴极产物; 【详解】(1)H2S与O2的反应的方程式为2H2S+3O2=2SO2+2H2O,1molH2 - 21 - S参与该反应放热586.16kJ ,故热化学方程式可以为:H2S(g)+O2(g)=SO2(g)+H2O(g) ΔH=-586.16kJ·mol-1; 答案为:H2S(g)+O2(g)=SO2(g)+H2O(g) ΔH=-586.16kJ·mol-1 (2)①Na2SO3是强碱弱酸盐,水解显碱性,水解程度不大并且以第一步水解为主,水有极微弱的电离,则可知溶液中阴离子的浓度c(SO32-)>c(OH-)>c(HSO3-); 答案为:c(SO32-)>c(OH-)>c(HSO3-); ②双碱法原理可表示为:NaOH(aq)Na2SO3(aq),由此可知,第一步消耗NaOH、第二步又生成NaOH和CaSO3,使NaOH再生,而CaSO3氧化生成CaSO4,得到石膏; 答案为:用CaO可使NaOH再生(或可获得副产物石膏等其他合理答案) (3)①①过二硫酸钾(K2S2O8)是离子化合物、含有离子键;阴离子S2O82-的结构式为可知含有极性共价键O-S、O=S键和非极性共价键O-O键,其中-1价的氧原子的个数为2; 答案:离子键、共价键;2; ②HNO2的氧化产物只能为硝酸; 答案为:HNO3; ③电解饱和KHSO4水溶液制备K2S2O8,是KHSO4被氧化反应,电极A为阳极,并可写出电极A的电极反应式2SO42--2e-=S2O82-(或2HSO4--2e-=S2O82-+2H+);电极B是阴极,气体a是阴极的还原产物,只能是氢气; 答案为:阴;H2;2SO42--2e-=S2O82-(或2HSO4--2e-=S2O82-+2H+)。 【点睛】(3)出现了过二硫酸钾,信息提示它的强氧化性,从结构式中完全可以找到原因:含有—O—O—不稳定,这-1的氧原子可以联想过氧化钠、过氧化氢;碰到新物质,要联想有共同点的熟悉的物质类比。 - 21 - - 21 -查看更多