湖北省长阳县第一高级中学2018-2019学年高二上学期第一次月考化学试题 Word版缺答案
长阳一中2018-2019学年度第一学期第一次月考
高二化学试卷
命题:田丹妮 审题:田卫行
考试时间90分钟 满分100分
相对分子质量: C:12 O:16 Si:28
第Ⅰ卷 选择题(共54分)
一.选择题:(本大题共18小题,每小题3分,共54分,每小题只有一个选项符合题意)
1. 下列说法正确的是( )
A.反应热就是反应中放出的能量
B.在101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热
C.等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多
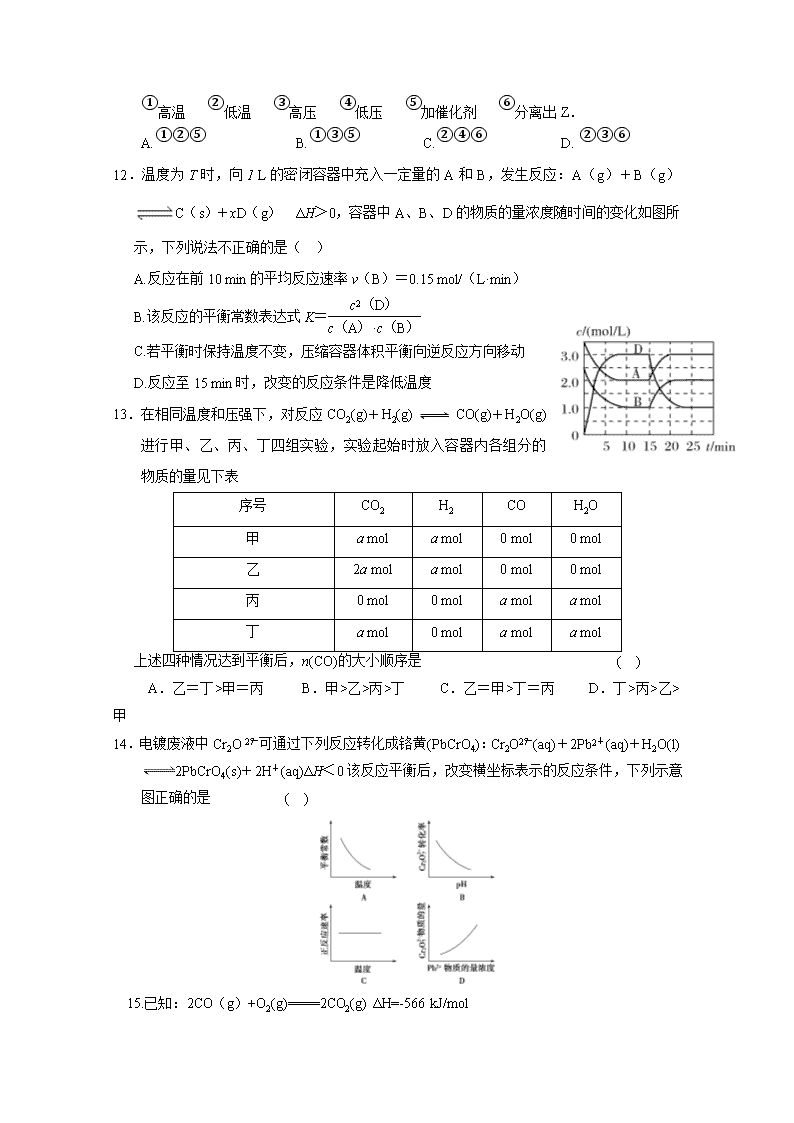
D.由C(石墨)―→C(金刚石) ΔH=+1.9 kJ·mol-1可知,金刚石比石墨稳定
2. 美国迄今最大的太阳能发电站——德索托下一代太阳能中心于2009年10月27日正式投入使用,获得美国政府高度重视。21世纪人类正由“化石能源时代”逐步向“多能源时代”过渡,下列不属于新能源的是( )
A.太阳能 B. 核能
C. 氢能 D. 电力
3.下列热化学方程式表达正确的是(的绝对值均正确)( )
A.C2H5OH(1) + 3O2(g) = 2CO2(g) + 3H2O(g) = -1367.0 kJ/mol(燃烧热)
B.NaOH(aq) + HCl(aq) = NaCl(aq) + H2O(1) = +57.3 kJ/mol (中和热)
C.S(s) + O2(g) = SO2(g) = -269.8 kJ/mol (反应热)
D.2NO2 = O2 + 2NO = +116.2 kJ/mol (反应热)
4.在2 L的密闭容器中,发生以下反应:2A(g)+B(g)
2C(g)+D(g)。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速率为0.12 mol·L-1·s-1,则10秒钟时,容器中B的物质的量是( )
A.1.6 mol B.2.8 mol C.2.4 mol D.1.2 mol
5.下列能用勒夏特列原理解释的是( )
A.高温及加入催化剂都能使合成氨的反应速率加快
B.红棕色的NO2加压后颜色先变深后变浅
C.SO2催化氧化成SO3的反应,往往需要使用催化剂
D.H2、I2、HI平衡时的混合气体加压后颜色变深
6. 反应:L(s)+a G(g)
b R(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡时混合气体中G的体积分数。据此可判断( )
①上述反应是放热反应 ②上述反应是吸热反应 ③a+1 < b ④ a
Q2>57.3
C.Q1甲=丙 B.甲>乙>丙>丁 C.乙=甲>丁=丙 D.丁>丙>乙>甲
14.电镀废液中Cr2O可通过下列反应转化成铬黄(PbCrO4):Cr2O(aq)+2Pb2+(aq)+H2O(l)
2PbCrO4(s)+2H+(aq)ΔH<0该反应平衡后,改变横坐标表示的反应条件,下列示意图正确的是 ( )
15.已知:2CO(g)+O2(g)====2CO2(g) ΔH=-566 kJ/mol
Na2O2(s)+CO2(g)====Na2CO3(s)+ O2(g) ΔH=-226 kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
A. CO的燃烧热为283 kJ
B. 右图可表示由CO生成CO2的反应过程和能量关系
C. 2Na2O2(s)+2CO2(s)====2Na2CO3(s)+O2(g)ΔH>-452 kJ/mol
D. CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
16.在一个6 L的密闭容器中,放入3 L X(g)和2 L Y(g),在一定条件下发生下列反应:4X(g)+3Y(g)2Q(g)+nR(g),达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减小,则该反应方程式中n的值是( )
A.3 B.4 C.5 D.6
17.一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示.下列判断正确的是( )
A.在0~50 min之间,pH=2和pH=7时R的降解百分率相等
B.溶液酸性越强,R的降解速率越小
C.R的起始浓度越小,降解速率越大
D.在20~25 min之间,pH=10时R的平均降解速率为0.04 mol•L﹣1•min﹣1
18.已知(HF)2(g)2HF(g) ΔH>0;且平衡体系的总质量(m总)与总物质的量(n总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是( )
A.温度:T1<T2
B.平衡常数:K(a)=K(b)<K(c)
C.反应速率:vb>va
D.当=30 g/mol时,n(HF)∶n[(HF)2]=2∶1
第Ⅱ卷 非选择题(共46分)
二、 填空题
19. (10分)(1)依据事实,写出下列反应的热化学方程式。
①在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放出热量22.68 kJ,则表示甲醇燃烧热的热化学方程式为 。
②在25 ℃、101 kPa下,已知SiH4(g)在氧气中完全燃烧后恢复至原状态,平均每转移1 mol电子放热190.0 kJ,当转移8 mol电子时反应的热化学方程式是 。
③一定条件下,断开1 mol H—H键、N—H键、键需要的能量分别是436 kJ、391 kJ、946 kJ,则该条件下N2与H2反应生成NH3的热化学方程式为 。
(2)可逆反应A(g)+B(g)
2C(g)在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如图所示。
①由T1向T2变化时,正反应速率______逆反应速率(填“>”、“<”或“=”)。
②由T3向T4变化时,正反应速率______逆反应速率(填“>”、“<”或“=”)。
③反应在________温度下达到平衡。
④此反应的正反应为______热反应。
20. (8分)在2 L的密闭容器内,800℃时反应2NO(g)+O2(g)
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s)
0
1
2
3
4
5
n(NO)(mol)
0.020
0.010
0.008
0.007
0.007
0.007
(1) 写出该反应的平衡常数表达式:K=_____________________________________。
已知:K300℃>K350℃,则该反应是______热反应。
(2)下图表示NO2的变化的曲线是__________。用O2表示从0~2 s内该反应的平均速率v=________________________________________________________________________。
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
21.(12分)50mL 0.50mol/L盐酸跟50mL 0.55 mol/L NaOH溶液在右图所示的装置 中进行中和反应,通过测定反应过程中所放出的热量可计算反应热。
(1) 烧杯间填满泡沫塑料的作用是 ;
(2) 大烧杯上若不盖硬纸板,求得的中和热数值 (填“偏大”、“偏小”、“无影响”)
(3) 如右图所示,仪器A的名称是_______________;在实验过程中,
如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,
则测得的△H -57.3KJ/mol(填“>”、“<”或“=”);
(4) 实验中改用80mL 0.50mol/L盐酸跟100mL 0.55 mol/L NaOH
溶液进行反应,与上述实验相比,所放出的热量
(填“相等、“不相等”),所求中和热 (填“相等、“不相等”) 。
简述理由
(5) 用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(均填“偏大”、“偏小”、“无影响”)
(6) 理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出稀硝酸和稀氢氧化钾溶液反应的中和热的热化学方程式 ;
22.(8分)硫—碘循环分解水制氢主要涉及下列反应:
Ⅰ SO2+2H2O+I2===H2SO4+2HI
Ⅱ 2HIH2+I2
Ⅲ 2H2SO4===2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是________。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭
容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间
的变化如图所示。
0~2 min内的平均反应速率v(HI)=________。该温度下,
H2(g)+I2(g)2HI(g)的平衡常数K=________。
相同温度下,若开始加入HI(g)的物质的量是原来的2倍,
则________是原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中H2OH+ + OH-平衡_______移动(填“向左”、“向右”或“不”);若加入少量下列试剂中的________,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。
已知 2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1某氢氧燃料电池释放228.8 kJ电
能时,生成1 mol液态水,该电池的能量转化率为________。
23.(8分)A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同。(已知:2NO2(g)
N2O4(g) ΔH<0)
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是vA______vB(填 “>”、“<”或“=”);若打开活塞K2,气球B将______(填“变大”、“变小”或“不变”)。
(2)关闭活塞K2,若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2
的转化率αA将________(填“增大”、“减小”或“不变”);若分别通人等量的氖气,则达到平衡时,A中NO2的转化率将________,B中NO2的转化率将______(填“变大”、“变小”或“不变”)。
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时______中的颜色较深,原因是 。
(4)若在容器A中充入4.6 g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为______。