- 2021-07-06 发布 |
- 37.5 KB |
- 8页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
广西柳州市2020届高三毕业班4月模拟考试化学试题
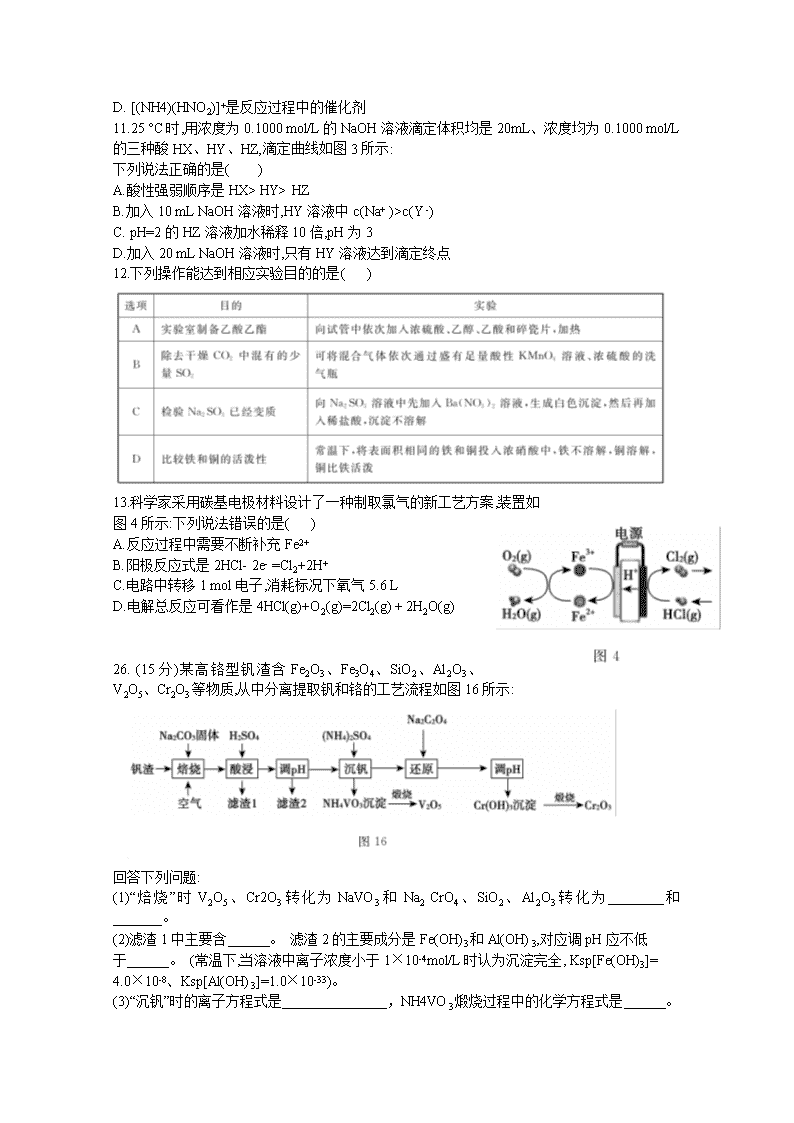
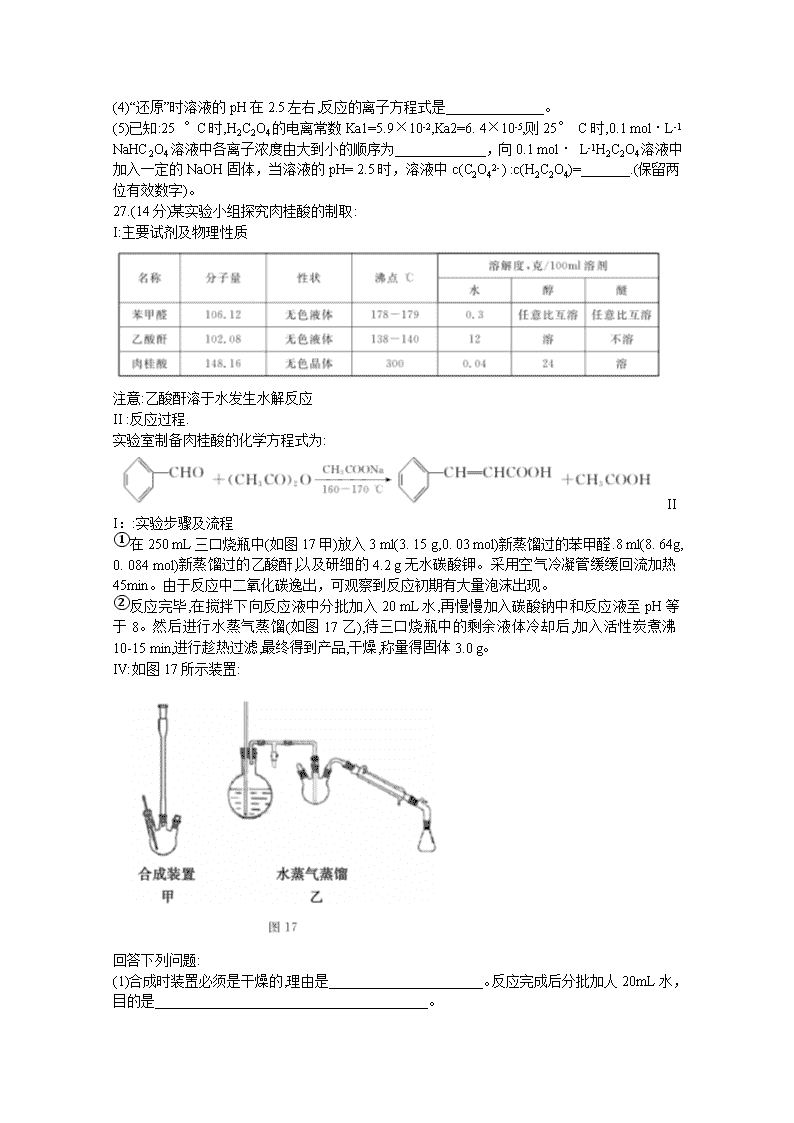
柳州市2020届高三毕业班4月模拟 理科综合能力测试化学部分 可能用到的相对原子质量:H-1 C-12 O-16 Ca-40 Cr-52 7.中华传统文化中蕴含着诸多化学知识,下列说法错误的是( ) A.“火树银花不夜天”指的是某些金属元素的焰色反应 B.“千锤万凿出深山,烈火焚烧若等闲”蕴含了碳酸钙的分解反应 C.“榆荚只能随柳絮,等闲撩乱走空园”中的“柳絮”主要成分是纤维素 D.“日照香炉生紫烟,遥看瀑布挂前川”中的“烟”是弥散在空气中的PM2. 5固体颗粒 8.-种治疗感冒咳嗽的药物结构简式是。下列关于该有机物的说法正确的是( ) A.分子中所有碳原子可在同一平面上. B.该有机物的分子式是C10H16O C.该有机物能发生加成和氧化反应 D.该有机物与互为同分异构体 9. X、Y、Z、R、W是原子序数依次递增的五种短周期主族元素,它们所在周期数之和为11, YZ气体遇空气变成红棕色,R的原子半径是短周期中最大的,W和Z同主族。下列说法错误的是( ) A.X、Y、Z元素形成的化合物溶于水一定呈酸性 B.气态氢化物的稳定性:Z> W C.简单离子半径:W> R D. Z、R形成的化合物中可能含有共价键 10.利用某分子筛作催化剂,NH3可脱除废气中的NO和NO2,生成两种无毒物质,其反应历程如图2所示,下列说法正确的是( ) 下列说法正确的是( ) A.反应过程中NO2、NH4+之间的反应是氧化还原反应 B..上述历程的总反应可以为:2NH3+NO+NO22N2+3H2O C.X是HNO2,是还原产物 D. [(NH4)(HNO2)]+是反应过程中的催化剂 11.25 °C时,用浓度为0.1000 mol/L的NaOH溶液滴定体积均是20mL、浓度均为0.1000 mol/L的三种酸HX、HY、HZ,滴定曲线如图3所示: 下列说法正确的是( ) A.酸性强弱顺序是HX> HY> HZ B.加入10 mL NaOH溶液时,HY溶液中c(Na+ )>c(Y -) C. pH=2的HZ溶液加水稀释10倍,pH为3 D.加入20 mL NaOH溶液时,只有HY溶液达到滴定终点 12.下列操作能达到相应实验目的的是( ) 13.科学家采用碳基电极材料设计了一种制取氯气的新工艺方案,装置如 图4所示:下列说法错误的是( ) A.反应过程中需要不断补充Fe2+ B.阳极反应式是2HCl- 2e- =Cl2+2H+ C.电路中转移1 mol电子,消耗标况下氧气5.6 L D.电解总反应可看作是4HCl(g)+O2(g)=2Cl2(g) + 2H2O(g) 26. (15分)某高铬型钒渣含Fe2O3、Fe3O4、SiO2、Al2O3、V2O5、Cr2O3等物质,从中分离提取钒和铬的工艺流程如图16所示: 回答下列问题: (1)“焙烧”时V2O5、Cr2O3转化为NaVO3和Na2 CrO4、SiO2、Al2O3转化为________和_______。 (2)滤渣1中主要含______。 滤渣2的主要成分是Fe(OH)3和Al(OH)3,对应调pH应不低 于______。 (常温下,当溶液中离子浓度小于1×10-4mol/L时认为沉淀完全, Ksp[Fe(OH)3]= 4.0×10-8、Ksp[Al(OH)3]=1.0×10-33)。 (3)“沉钒”时的离子方程式是_______________,NH4VO3煅烧过程中的化学方程式是______。 (4)“还原”时溶液的pH在2.5左右,反应的离子方程式是______________。 (5)已知:25 °C时,H2C2O4的电离常数Ka1=5.9×10-2,Ka2=6. 4×10-5,则25° C时,0.1 mol·L-1 NaHC2O4溶液中各离子浓度由大到小的顺序为_____________,向0.1 mol· L-1H2C2O4溶液中加入一定的NaOH固体,当溶液的pH= 2.5时,溶液中c(C2O42- ) :c(H2C2O4)=_______.(保留两位有效数字)。 27.(14分)某实验小组探究肉桂酸的制取: I:主要试剂及物理性质 注意:乙酸酐溶于水发生水解反应 II :反应过程. 实验室制备肉桂酸的化学方程式为: III::实验步骤及流程 ①在250 mL三口烧瓶中(如图17甲)放入3 ml(3. 15 g,0. 03 mol)新蒸馏过的苯甲醛.8 ml(8. 64g, 0. 084 mol)新蒸馏过的乙酸酐,以及研细的4.2 g无水碳酸钾。采用空气冷凝管缓缓回流加热45min。由于反应中二氧化碳逸出,可观察到反应初期有大量泡沫出现。 ②反应完毕,在搅拌下向反应液中分批加入20 mL水,再慢慢加入碳酸钠中和反应液至pH等于8。然后进行水蒸气蒸馏(如图17乙),待三口烧瓶中的剩余液体冷却后,加入活性炭煮沸10-15 min,进行趁热过滤,最终得到产品,干燥,称量得固体3.0 g。 IV:如图17所示装置: 回答下列问题: (1)合成时装置必须是干燥的,理由是______________________。反应完成后分批加人20mL水,目的是_______________________________________。 (2)反应完成后慢慢加入碳酸钠中和,目的是_________________________。 (3)步骤②进行水蒸气蒸馏,除去的杂质是______,如何判断达到蒸馏终点__________。 (4)加入活性炭煮沸10- 15 min,进行趁热过滤,将滤液冷却至室温,趁热过滤的目的是_______。 (5)若进一步提纯粗产品,应用的操作名称是______,该实验产品的产率约是_______。(保留小数点后一位) 28. (14分) (1)氢气是一.种未来十分理想的能源。 镧镍合金是一种良好的储氢材料,在一定条件下通过如下反应实现储氢: LaNi3(s)+3H2(g) LaNi3H6(s) ∆H<0。 某实验室模拟该过程,向体积一定的密闭容器中充入反应物发生反应。H2的平衡转化率与其初始加入量(n)、反应温度(T)的关系如图18所示;一定温度(T)下,将a mol的氢气充入体积是1 L的容器内,气体的压强(P)随时 间(t)的变化关系如图19所示: ①n1、n2、n3的大小关系是__________________。 ②温度T1下反应的平衡常数是__________(用含a的代数式表示)。 ③保持温度不变,在t6时刻将容积压缩至原容积的一半,容器内的压强_________6kPa(填写“大于”或“小于”)。 (2)贮氢合金ThNi5可催化由CO、H2合成CH4等有机化工产品的反应。温度为TK时发生以 下反应: (3)TK时,向一恒压密闭容器中充入等物质的量的CO(g)和H2O(g)发生上述反应②(已排除其 他反应干扰),测得CO(g)物质的量分数随时间变化如下表所示: 若初始投入CO为2 mol,恒压容器容积10 L,用H2O(g)表示该反应0-5分钟内的速率v(H2O(g))=______。6分钟时,仅改变一种条件破坏了平衡,且第9min达到平衡时,CO的物质的量是0.2mol,则改变的外界条件为______________________。 (4)温度、压强对反应CO(g)十2H2 (g)==CH3OH(g) ∆H=-90. 1 kJ·mol-1中CO转化率的影响如图20所示: ①温度在较低范围内,对CO转化率影响的主要因素是 ____________ (填“温度”或“压强”)。 ②由图像可知,温度越低,压强越大,CO转化率越高,但实际生产往往采用300~400 °C和10 MPa的条件,其原因是______________________________________。 35.[化学一选修 3:物质结构与性质](15分) 锂碳、铝、铬是重要的元素,在工业生产和科技中有重要的应用。 (1)铝热反应可以冶炼金属铬,Cr基态核外电子排布式为_____________。 (2)金属锂是锂电池重要的组成部分。Li、Be、B 原子的第一电离能由大到小的顺序为______。 (3)LiAlH4是有机合成中常用的还原剂。AlH4-的空间构型为___________。 ①乙酸酐分子中碳原子轨道的杂化类型为________。 ②l mol对甲基苯乙酮分子中含有的σ键的数目为_______ ③甲苯分子难溶于水的原因是_________________。 (5)已知铬酸钙晶胞如图25所示,该晶体密度为pg·cm-1,NA是阿伏加德罗常数的值。Ca离子周围距离最近且相等的O有_____个。相邻两个面心氧离子最短核间距(d)为_______pm。 36.[化学一选修 6:有机化学基础](15分) 回答下列问题: (1)B物质所含官能团名称是________,E物质的分子式是_________ (2)巴豆醛的系统命名为____________,检验其中含有碳碳双键的方法是___________. (3)A到B的反应类型是__________,E与足量氢气在一定条件下反应的化学方程式是________________________________________。 (4)比A少两个碳原子且含苯环的同分异构体有________种,写出核磁共振氢谱有四组峰且峰.面积比为3:2:2:2的结构简式_________________。 请设计由乙醇为原料制备巴豆醛的合成路线。 ________________________________________________________________________。查看更多