2020版高考化学二轮复习专题强化训练8水溶液中的离子平衡含解析
专题强化训练(八)
能力练(20分钟)
一、选择题
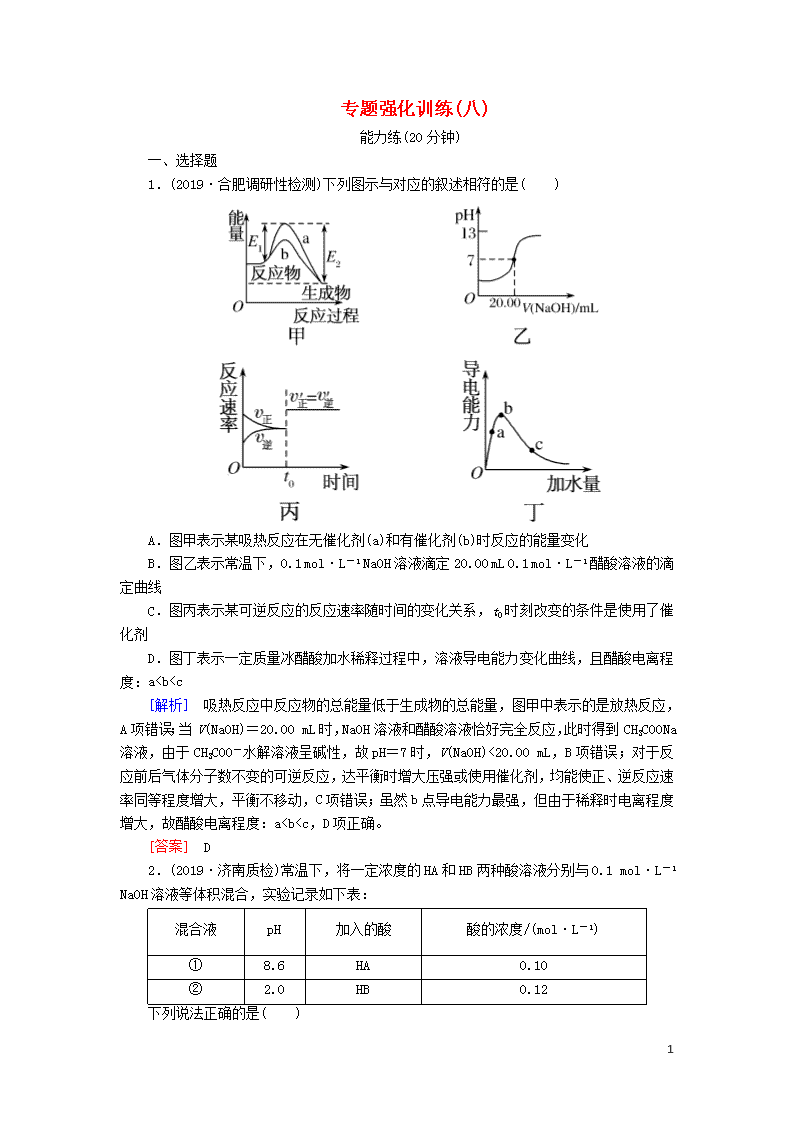
1.(2019·合肥调研性检测)下列图示与对应的叙述相符的是( )
A.图甲表示某吸热反应在无催化剂(a)和有催化剂(b)时反应的能量变化
B.图乙表示常温下,0.1 mol·L-1 NaOH溶液滴定20.00 mL 0.1 mol·L-1 醋酸溶液的滴定曲线
C.图丙表示某可逆反应的反应速率随时间的变化关系,t0时刻改变的条件是使用了催化剂
D.图丁表示一定质量冰醋酸加水稀释过程中,溶液导电能力变化曲线,且醋酸电离程度:a
c(Na+)>c(OH-)>c(H+)
C.升高温度,溶液①中c(H+)增大,pH减小
D.溶液②中存在:c(Na+)+c(H+)=c(OH-)+c(B-)
[解析] 溶液①中HA与NaOH恰好完全反应,得到NaA溶液,pH=8.6,说明NaA为强碱弱酸盐,则HA为弱酸,溶液②中HB与NaOH反应,HB过量,剩余HB的浓度为 mol·L-1=0.01 mol·L-1,pH=2,说明HB为强酸,A项错误;溶液①中的溶质为NaA,NaA为强碱弱酸盐,离子浓度关系:c(Na+)>c(A-)>c(OH-)>c(H+),B项错误;升高温度,促进溶液①中NaA水解,c(OH-)增大,c(H+)减小,pH增大,C项错误;根据电荷守恒,溶液②中c(Na+)+c(H+)=c(OH-)+c(B-),D项正确。
[答案] D
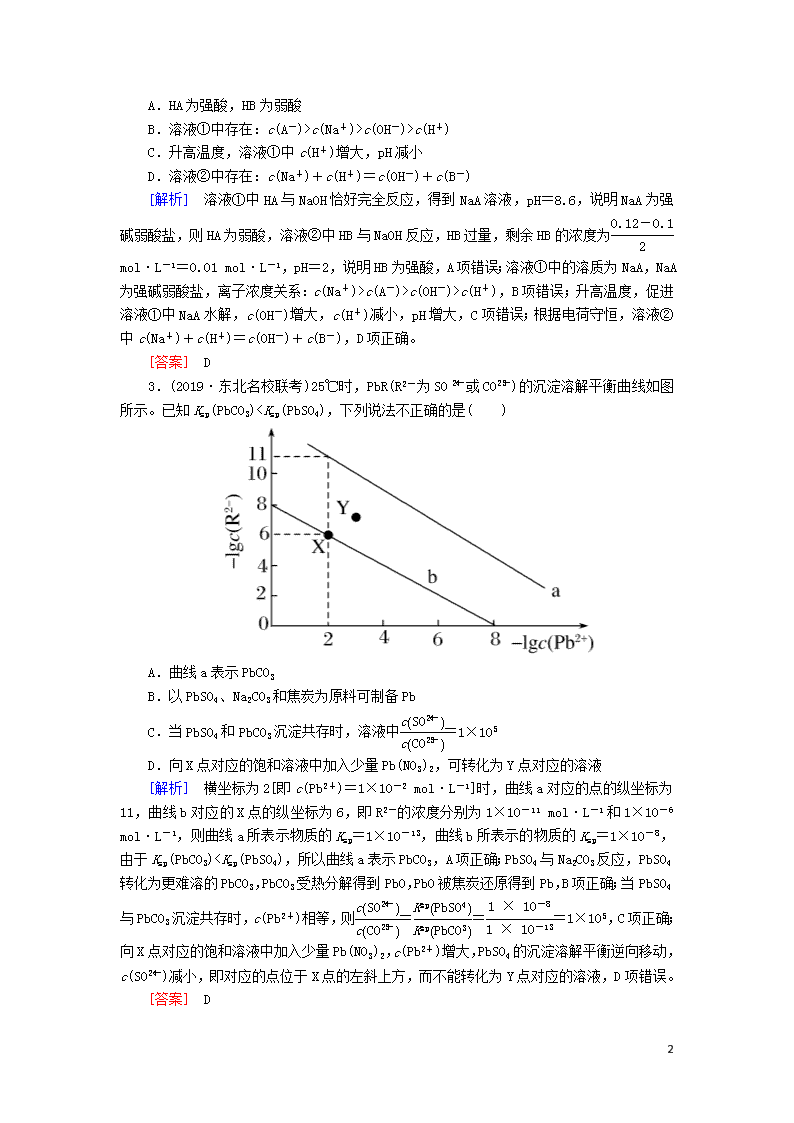
3.(2019·东北名校联考)25℃时,PbR(R2-为SO或CO)的沉淀溶解平衡曲线如图所示。已知Ksp(PbCO3)pH(NaCN)>pH(CH3COONa)
B.a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于b
C.向冰醋酸中逐滴加水,则溶液的导电性和pH均先增大后减小
D.NaHCO3和Na2CO3的混合溶液中,一定有2c(Na+)=3[c(H2CO3)+c(HCO)+c(CO)]
[解析] 由电离平衡常数可知酸性:CH3COOH>HCN>HCO,根据越弱越水解可知盐类水解能力:Na2CO3>NaCN>CH3COONa,同浓度时则各溶液pH关系:pH(Na2CO3)>pH(NaCN)
>pH(CH3COONa),A项正确;a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),由电荷守恒得c(OH-)>c(H+),溶液呈碱性,则溶液中溶质可能是NaCN或NaCN和极少量HCN或NaCN和NaOH,故a、b关系不确定,B项错误;加水稀释冰醋酸,能促进CH3COOH电离,离子浓度先增大,增大到一定程度时再加水,离子浓度反而减小,即溶液的导电性先增大后减小,溶液的pH先减小后增大,C项错误;只有Na2CO3溶液和NaHCO3溶液等物质的量混合时,才存在2c(Na+)=3[c(H2CO3)+c(HCO)+c(CO)],D项错误。
[答案] A
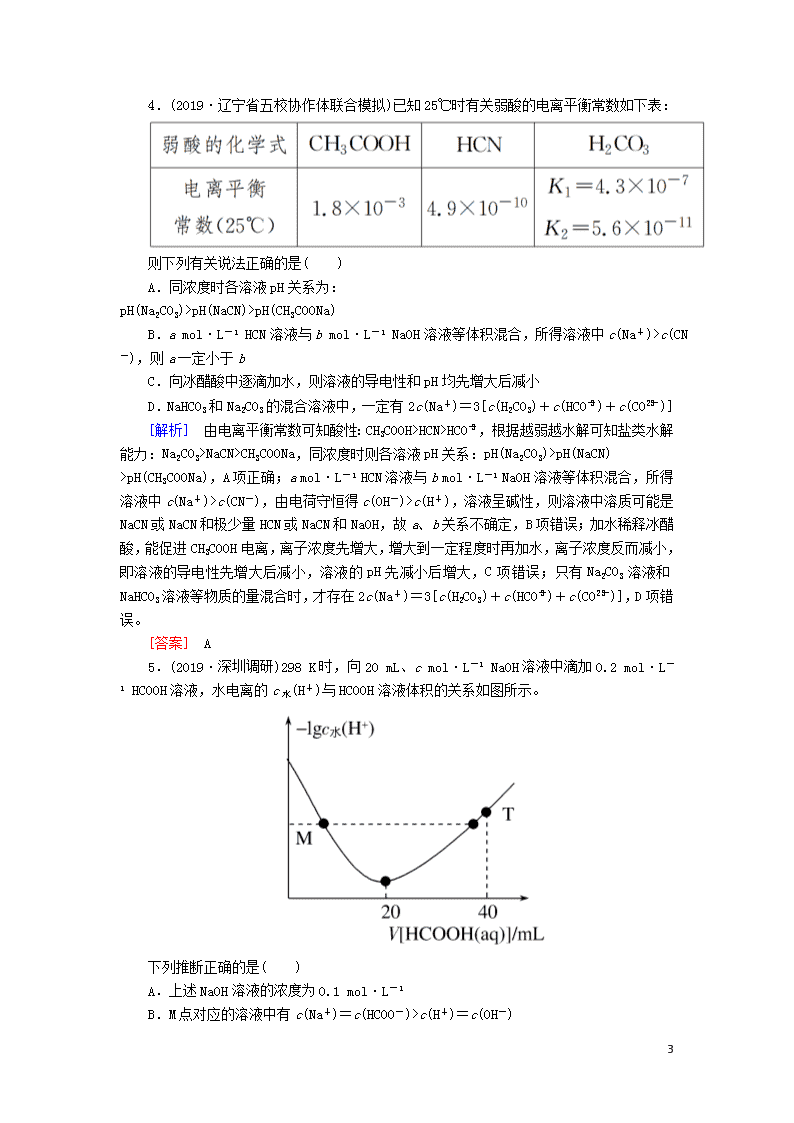
5.(2019·深圳调研)298 K时,向20 mL、c mol·L-1 NaOH溶液中滴加0.2 mol·L-1 HCOOH溶液,水电离的c水(H+)与HCOOH溶液体积的关系如图所示。
下列推断正确的是( )
A.上述NaOH溶液的浓度为0.1 mol·L-1
B.M点对应的溶液中有c(Na+)=c(HCOO-)>c(H+)=c(OH-)
C.T点对应的溶液中有c(Na+)=2c(HCOOH)+2c(HCOO-)
14
D.若298 K时,V[HCOOH(aq)]=20 mL时对应溶液中-lgc水(H+)=5.7,则Ka(HCOOH)的数量级为10-4
[解析] 从图像可看出,加入20 mL 0.2 mol·L-1 HCOOH溶液时,水的电离程度最大,此时NaOH与HCOOH恰好完全反应,则c(NaOH)==0.2 mol·L-1,A项错误;M点对应溶液的溶质是NaOH与HCOONa,溶液呈碱性,溶液中c(H+)c[X(OH)+]
D.在X(OH)NO3水溶液中,c[X(OH)2]+c(OH-)=c(X2+)+c(H+)
[解析] A项,选取图中左侧交点处数据进行计算,此时,pH=6.2,c[X(OH)+]=c(X2+),所以Kb2==c(OH-)=10-(14-6.2)=10-7.8≈1.58×10-8,正确。B项,X(OH)NO3的水溶液中X的主要存在形式为X(OH)+,由图示知X(OH)+占主导位置时,pH在7到8之间,溶液显碱性,正确。C项,X2+的水解程度比X(OH)+的电离程度大,所以c(X2+)”“<”或“=”)c(OH-)。
②常温下,若清液中c(Cr3+)≤1.5 mg·L-1,则达到国家排放标准。试判断当清液的pH=5时,是否符合排放标准:
___________________________________________(要有计算过程和必要的文字叙述)。
[解析] (1)同一个化学反应中,速率之比等于化学计量数之比,则v(Cr2O)消耗=v(H+)生成;达到平衡时,v(H+)消耗=v(H+)生成,故v(Cr2O)消耗=v(H+)消耗。(2)①I-具有还原性,在空气中长时间放置,过量的I-可被空气中的氧气氧化。②I2遇淀粉显蓝色,当达到滴定终点时,I2全部转化为I-,溶液蓝色褪去,故滴定终点时的现象为滴入最后一滴Na2S2O3标准溶液,溶液蓝色刚好褪去,且半分钟内不恢复原色。K2Cr2O7与KI反应的离子方程式为Cr2O+6I-+14H+===2Cr3++3I2+7H2O,I2与Na2S2O3反应的离子方程式为I2+2S2O===S4O+2I-,从而可得关系式:Cr2O~3I2~6S2O。则25.00 mL所配溶液中n(Cr2O)=×cV×10-3 mol,故产品的纯度为×100%=×100%。(3)①H2SO3H++HSO,Ka1=,HSO+H2OH2SO3+OH-,Kh=====6.7×10-13。由于Ka2=1.0×10-7>Kh=6.7×10-13,则NaHSO3溶液显酸性,该溶液中c(H+)>c(OH-)。②常温下,清液pH=5时,c(OH-)=10-9 mol·L-1,c(Cr3+)===6.3×10-4(mol·L-1),Cr3+的浓度为=32.76 mg·L-1>1.5 mg·L-1,故不符合排放标准。
14
[答案] (1)
(2)①防止时间过长I-被O2氧化 ②滴入最后一滴Na2S2O3标准溶液,溶液蓝色刚好褪去,且半分钟内不恢复原色 ×100%
(3)①6.7×10-13或6.7×10-13 mol·L-1 >
②清液pH=5时,c(OH-)=10-9 mol·L-1,c(Cr3+)===6.3×10-4(mol·L-1),Cr3+的浓度为
=32.76 mg·L-1>1.5 mg·L-1,故不符合排放标准
拔高练(25分钟)
一、选择题
1.(2019·河南郑州第一次模拟)常温下,将NaOH溶液滴加到HA溶液中,测得混合溶液的pH与p变化关系如图所示。下列叙述正确的是 ( )
A.pH=5时,c(A-)0,>1,c(A-)>c(HA),A错误;m点时,pH=4.76,p=0,即c(A-)=c(HA),Ka(HA)==c(H+)=10-4.76=100.24×10-5,故其数量级为10-5,B正确;m点对应溶液显酸性,c(OH-)c(Na+),又知m点对应溶液中p=0,则c(A-)=c(HA),所以[c(A-)+c(HA)]>c(Na+),则m点时加入NaOH的物质的量小于原HA溶液中HA的物质的量的
14
,则m点对应溶液中溶质HA的物质的量大于NaA,C错误;根据电荷守恒得c(A-)+c(OH-)=c(H+)+c(Na+),故r点对应溶液中c(A-)-c(Na+)=c(H+)-c(OH-)=10-6-10-8=9.9×10-7(mol/L),D错误。
[答案] B
2.(2019·南充市第一次适应性考试)常温下,下列条件下的溶液pH=7的是( )
A.等体积等物质的量浓度的强酸和强碱溶液混合
B.向明矾溶液中滴加Ba(OH)2溶液至SO恰好完全沉淀
C.向KHC2O4溶液中滴加KOH溶液至c(H+)= mol·L-1
D.c(Na+)=c(HCO)+c(CO)的NaHCO3和Na2CO3的混合溶液
[解析] 若是等体积等物质的量浓度的二元强酸(如H2SO4)与一元强碱(如NaOH)溶液混合,反应后H+浓度大于OH-浓度,溶液为酸性,常温下pH<7,A项错误;KAl(SO4)2+2Ba(OH)2===2BaSO4↓+KAlO2+2H2O,偏铝酸钾溶液呈碱性,常温下pH>7,B项错误;由c(H+)= mol·L-1推知,c(H+)=c(OH-),溶液呈中性,常温下pH=7,C项正确;根据电荷守恒,c(Na+)+c(H+)=c(OH-)+c(HCO)+2c(CO),若c(Na+)=c(HCO)+c(CO),则c(H+)=c(OH-)+c(CO)>c(OH-),溶液为酸性,常温下pH<7,D项错误。
[答案] C
3.(2019·四川四市联考)草酸(H2C2O4)是一种二元弱酸。常温下向H2C2O4溶液中滴加NaOH溶液,混合溶液中lg X[X表示或]随pH的变化关系如图所示。下列说法不正确的是( )
A.直线Ⅰ中X表示的是
B.直线Ⅰ、Ⅱ的斜率均为1
C.c(HC2O)>c(C2O)>c(H2C2O4)对应溶液pH:1.22Ka2=10-4.19,所以直线Ⅰ中x表示的是,直线Ⅱ中x表示的是
14
,故A正确;pH=0时,lg=lgKa1=-1.22,lg=lgKa2=-4.19,所以直线Ⅰ、Ⅱ的斜率均为1,故B正确;设pH=a,c(H+)=10-a,==10a-4.19,当c(C2O)c(H2C2O4)时,102a-5.41>1,即2a-5.41>0,解得a>2.705,所以c(HC2O)>c(C2O)>c(H2C2O4),对应2.705B
B.向A点溶液中加少量的水:保持不变
C.C点:c(Na+)>c(HA-)+2c(A2-)
D.D点:2c(Na+)=c(HA-)+c(H2A)+c(A2-)
[解析] B点pH=7,溶液呈中性,溶质为NaHA和H2A,基本不影响水的电离;C点恰好反应生成NaHA,溶液呈碱性,说明HA-的电离程度小于其水解程度,促进了水的电离,所以水的电离程度:C>B,故A正确;由于=,温度不变,Kh不变,则该比值不变,故B正确;C点pH>7,c(OH-)>c(H+),根据电荷守恒c(OH-)+c(HA-)+2c(A2-)=c(H+)+c(Na+),可知:c(Na+)>c(HA-)+2c(A2-),故C正确;D点加入20 mL等浓度的NaOH溶液,恰好反应生成Na2A,根据物料守恒可知:c(Na+)=2c(HA-)+2c(H2A)+2c(A2-),故D错误。
[答案] D
5.(2019·四川绵阳诊断二)常温下,将AgNO3溶液分别滴加到浓度均为0.01 mol·L-1的NaBr、Na2SeO3溶液中,所得的沉淀溶解平衡曲线如图所示(Br-、SeO用Xn-
14
表示,不考虑SeO的水解)。下列叙述正确的是( )
A.Ksp(Ag2SeO3)的数量级为10-10
B.d点对应的AgBr溶液为不饱和溶液
C.所用AgNO3溶液的浓度为10-3 mol·L-1
D.Ag2SeO3(s)+2Br-(aq)2AgBr(s)+SeO(aq)的平衡常数为109.6,反应趋于完全
[解析] 由题图可知,当c(Ag+)=10-5 mol·L-1时,c(SeO)=10-5 mol·L-1,则Ksp(Ag2SeO3)=c2(Ag+)·c(SeO)=(10-5)2×10-5=10-15,A项错误;由题图可知,d点对应的AgBr溶液的Qc=10-3×10-7.3=10-10.3,Ksp(AgBr)=10-5×10-7.3=10-12.3,Qc>Ksp(AgBr),则d点对应的溶液为AgBr的过饱和溶液,B项错误;由题图可知,加入的AgNO3溶液的浓度为10-2 mol·L-1,C项错误;Ag2SeO3(s)+2Br-(aq)2AgBr(s)+SeO(aq)的平衡常数K====109.6,一般地说,K>105时,该反应进行得就基本完全了,故D项正确。
[答案] D
6.(2019·江西名校联考)下列曲线图与对应的叙述相符的是( )
14
A.如图1所示,用0.1 mol·L-1 NaOH溶液分别滴定相同物质的量浓度、相同体积的盐酸和醋酸,其中实线表示的是滴定盐酸的曲线
B.某温度下FeS、CuS的沉淀溶解平衡曲线如图2所示,纵轴c(M2+)代表Fe2+或Cu2+的浓度,横轴c(S2-)代表S2-的浓度。在物质的量浓度相等的Fe2+和Cu2+的溶液中滴加硫化钠溶液,首先沉淀的离子为Fe2+
C.如图3所示,用0.1 mol·L-1 CH3COOH溶液滴定20 mL 0.1 mol·L-1 NaOH溶液,当pH=7时:c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
D.据图4,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量CuO至pH在5.5左右
[解析] 用0.1 mol·L-1 NaOH溶液滴定醋酸时,随着加入氢氧化钠溶液的量的增加,醋酸会电离出一部分氢离子,所以对应的pH突跃要缓慢,A项错误;依据题图2分析可知,硫化铜的溶度积小于硫化亚铁,向同浓度Fe2+和Cu2+的溶液中滴加硫化钠溶液,先沉淀的离子是Cu2+,B项错误;用0.1 mol·L-1 CH3COOH溶液滴定20 mL 0.1 mol·L-1 NaOH溶液,反应后溶液pH=7,根据电荷守恒,c(H+)+c(Na+)=c(OH-)+c(CH3COO-),c(H+)=c(OH-),则c(CH3COO-)=c(Na+),得c(Na+)=c(CH3COO-)>c(OH-)=c(H+),C项正确;根据题图4可知Fe3+完全沉淀的pH约为3.7,加入氧化铜可以调节溶液pH,当pH=5.5时部分铜离子会沉淀,应调节溶液pH在4~5之间,D项错误。
[答案] C
7.(2019·湖南模拟)下列有关电解质溶液的说法不正确的是( )
A.向Na2CO3溶液中通入NH3,减小
B.将0.1 mol·L-1的K2C2O4溶液从25℃升温至35℃,增大
C.向0.1 mol·L-1的HF溶液中滴加NaOH溶液至中性,=1
D.向0.1 mol·L-1的CH3COONa溶液中加入少量水,增大
[解析] 在一定条件下,Na2CO3溶液中存在水解平衡:CO+H2OHCO+OH-,溶液中通入NH3,与水结合电离出OH-,抑制CO水解,所以减小,A项正确;K2C2O4溶液中C2O水解使溶液显碱性,升高温度,水解程度增加,C2O浓度减小,K+浓度不变,所以增大,B项正确;向0.1 mol·L-1的HF溶液中滴加NaOH溶液至中性,此时溶液的溶质是HF和NaF的混合物,存在电荷守恒:c(F-)+c(OH-)=c(H+)+c(Na+),因c(H+)=c(OH-),故Na+和F-浓度相等,二者比值是1,C项正确;向CH3COONa溶液中加入少量水,不会影响醋酸的电离平衡常数,即不变,D项错误。
[答案] D
二、非选择题
8.(2019·沈阳质量监测)Ⅰ.H3AsO3和H3AsO4水溶液中含砷的各种微粒的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图所示。
14
回答下列问题:
(1)以酚酞为指示剂(变色范围:pH 8.0~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为________________________。
(2)pH=11时,H3AsO3水溶液中三种微粒浓度由大到小的顺序为_______________________________________。
(3)H3AsO4第一步电离方程式为________________。
(4)若pKa2=-lgKa2,H3AsO4第二步电离的电离常数为Ka2,则pKa2=________。
Ⅱ.用0.100 mol·L-1 AgNO3溶液滴定50.00 mL Cl-浓度为0.0500 mol·L-1的溶液的滴定曲线如图所示:
14
(5)根据曲线数据计算可知Ksp(AgCl)的数量级为________。
(6)相同实验条件下,若Cl-浓度改为0.0400 mol·L-1,则反应终点由c移到________(填“a”“b”或“d”)。
(7)已知Ksp(AgCl)>Ksp(AgBr),相同实验条件下,若改为Br-浓度为0.0500 mol·L-1,则反应终点由c向________(填“a”“b”或“d”)移动。
[解析] Ⅰ.(1)以酚酞为指示剂,将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时,溶液pH在8.0~10.0之间,结合图像可知溶液中H3AsO3减少而H2AsO增加,则该过程中主要反应的离子方程式为OH-+H3AsO3===H2AsO+H2O。(2)结合图像可知pH=11时,H3AsO3水溶液中c(H2AsO)最大,c(H3AsO3)最小,各含砷微粒浓度关系为c(H2AsO)>c(HAsO)>c(H3AsO3)。(3)结合题图知,H3AsO4为多元弱酸,存在电离平衡,其第一步电离方程式为H3AsO4H2AsO+H+。(4)H3AsO4第二步电离方程式为H2AsOHAsO+H+,其电离常数Ka2=,由图像可知当pH=7.0时,c(H2AsO)=c(HAsO),则Ka2=10-7.0,pKa2=7.0。Ⅱ.(5)50.00 mL含0.0500 mol·L-1Cl-的溶液与25.00 mL0.100 mol·L-1 AgNO3溶液完全反应后,由题图得知c(Cl-)为10-4.75 mol·L-1,因为Cl-与Ag+等量,即c(Ag+)也为10-4.75 mol·L-1,则Ksp(AgCl)=10-9.5=100.5×10-10,则Ksp(AgCl)的数量级为10-10。(6)相同条件下,若Cl-浓度改为0.0400 mol·L-1,则需消耗20.00 mL 0.100 mol·L-1的AgNO3溶液,即反应终点由c移到b。(7)相同实验条件下,若改为Br-浓度为0.0500 mol·L-1,则消耗25.00 mL 0.100 mol·L-1的AgNO3溶液,又因为Ksp(AgBr)-lgc(Cl-),即反应终点由c向d移动。
[答案] (1)OH-+H3AsO3===H2AsO+H2O
(2)c(H2AsO)>c(HAsO)>c(H3AsO3)
(3)H3AsO4H2AsO+H+ (4)7.0
(5)10-10 (6)b (7)d
14
14