高中化学第三章水溶液中的离子平衡水平测试含解析新人教版选修4
第三章 水平测试
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分100分,考试时间90分钟。第Ⅰ卷(选择题,共48分)
一、选择题(本题包括16个小题,每小题仅有一个选项符合题意,每小题3分,共48分)1.下列各组物质全部是弱电解质的是( )
A.H2O、NH3·H2O、H3PO4、HF
B.Cu(OH)2、CH3COOH、C2H5OH、CH3COONa
C.H2SO3、Ba(OH)2、BaSO4
D.SO2、H2S、CO2
答案 A
解析 B项中,C2H5OH是非电解质,CH3COONa是强电解质;C项中,Ba(OH)2、BaSO4是强电解质;D项中SO2、CO2是非电解质。
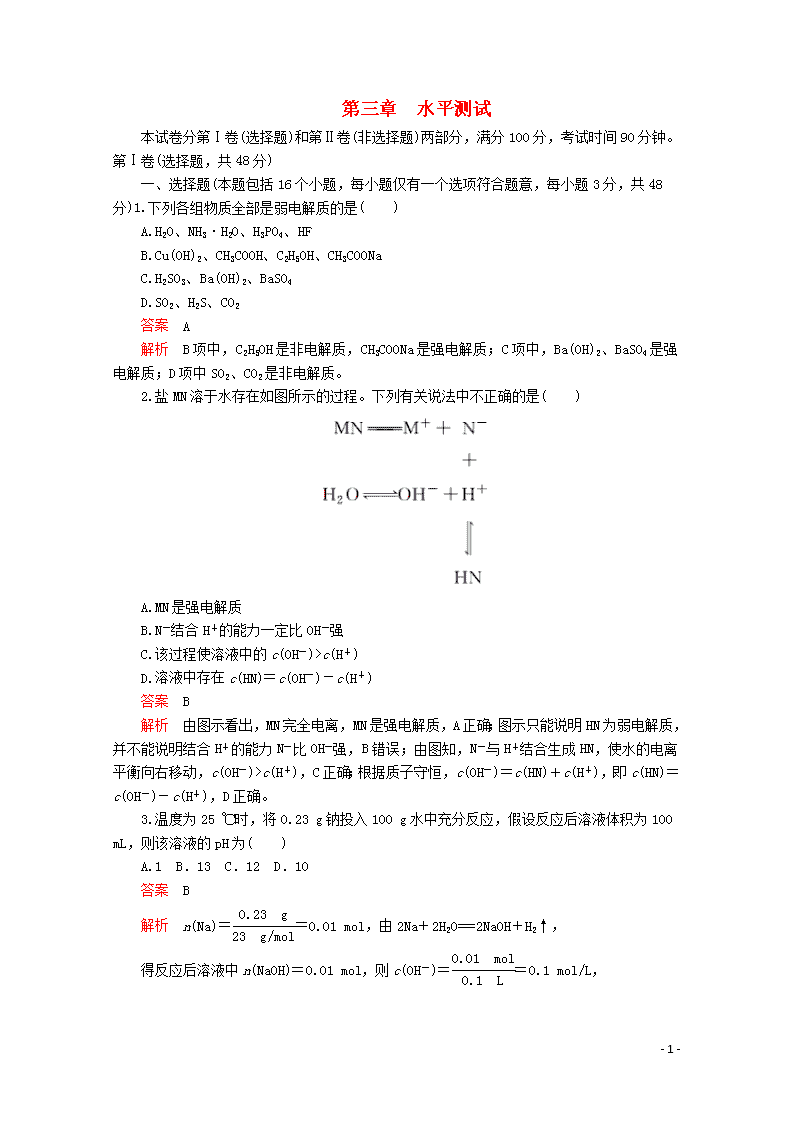
2.盐MN溶于水存在如图所示的过程。下列有关说法中不正确的是( )
A.MN是强电解质
B.N-结合H+的能力一定比OH-强
C.该过程使溶液中的c(OH-)>c(H+)
D.溶液中存在c(HN)=c(OH-)-c(H+)
答案 B
解析 由图示看出,MN完全电离,MN是强电解质,A正确;图示只能说明HN为弱电解质,并不能说明结合H+的能力N-比OH-强,B错误;由图知,N-与H+结合生成HN,使水的电离平衡向右移动,c(OH-)>c(H+),C正确;根据质子守恒,c(OH-)=c(HN)+c(H+),即c(HN)=c(OH-)-c(H+),D正确。
3.温度为25 ℃时,将0.23 g钠投入100 g水中充分反应,假设反应后溶液体积为100 mL,则该溶液的pH为( )
A.1 B.13 C.12 D.10
答案 B
解析 n(Na)==0.01 mol,由2Na+2H2O===2NaOH+H2↑,
得反应后溶液中n(NaOH)=0.01 mol,则c(OH-)==0.1 mol/L,
c(H+)= mol/L=10-13 mol/L,
- 9 -
pH=-lg 10-13=13。
4.25 ℃时,水的电离达到平衡:H2OH++OH-,下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)减小
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)减小
D.将水加热,Kw增大,pH不变
答案 B
解析 A项,NH3·H2O是弱碱,加入氨水后c(OH-)增大,平衡逆向移动;B项,NaHSO4溶于水发生电离:NaHSO4===Na++H++SO,c(H+)增大,由于温度不变,故Kw不变;C项,向水中加入固体CH3COONa,CH3COO-结合H+生成弱电解质,促进水的电离,使水的电离平衡正向移动,溶液呈碱性,c(H+)减小;D项,升高温度,水的电离程度增大,Kw增大,pH减小。
5.下列事实不属于盐类水解应用的是( )
A.明矾、氯化铁晶体常用于净水
B.实验室通常在HCl气氛中加热MgCl2·6H2O制MgCl2
C.实验室配制FeCl3溶液时加入少量稀盐酸
D.实验室用Zn和稀H2SO4制氢气时加入少量CuSO4溶液
答案 D
解析 A项,因为明矾、氯化铁电离产生的Al3+、Fe3+发生水解反应:Al3++3H2OAl(OH)3(胶体)+3H+、Fe3++3H2OFe(OH)3(胶体)+3H+而用于吸附水中杂质;B项,加热时MgCl2发生水解,MgCl2+2H2OMg(OH)2+2HCl,在HCl气氛中加热可抑制水解;C项,配制FeCl3溶液加入稀盐酸,是抑制Fe3+水解;D项,制氢气加入CuSO4是形成原电池加快反应速率,不是水解反应。
6.下列说法正确的是( )
A.两难溶电解质作比较时,Ksp小的,溶解度一定小
B.欲使溶液中某离子沉淀完全,加入的沉淀剂应该是越多越好
C.所谓沉淀完全就是用沉淀剂将溶液中某一离子除净
D.欲使Ca2+沉淀完全,选择Na2CO3作沉淀剂效果比Na2SO4好
答案 D
解析 结构类型不同的电解质Ksp小,溶解度不一定小,A错误;难溶电解质存在溶解平衡,应加入合适的沉淀剂使其溶度积最小,并不是越多越好,B错误;沉淀离子浓度小于1×10-5 mol/L即可认为被除净,C错误;Ksp(CaCO3)
c(NO)>c(Cl-)>c(I-)>c(Ag+)
B.溶液中先产生的是AgI沉淀
C.AgCl的Ksp的数值为1.69×10-10
D.若在AgI悬浊液中滴加少量的KCl溶液,黄色沉淀不会转变成白色沉淀
答案 A
解析 Ksp(AgI)=c(Ag+)·c(I-)=1.22×10-8×1.22×10-8≈1.49×10-16,Ksp(AgCl)=c(Ag+)·c(Cl-)=1.30×10-5×1.30×10-5=1.69×10-10,故C正确;由Ksp(AgI)c(I-),故A不正确;在AgI悬浊液中滴加少量KCl溶液,AgI不会转化为AgCl,故D正确。
12.下列叙述正确的是( )
A.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度
B.25 ℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7
C.25 ℃时,0.1 mol·L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱
D.0.1 mol AgCl和0.1 mol AgI混合后加入1 L水中,所得溶液中c(Cl-)=c(I-)
答案 C
解析 CH3COOH在水溶液中存在如下平衡:CH3COOHCH3COO-+H+,加入CH3COONa,增大了CH3COO-浓度,平衡逆向移动,CH3COOH电离程度减小,A项错误;二者完全反应后生成NH4NO3,NH水解导致溶液呈酸性,故反应后的溶液pH<7,B项错误;H2S溶液中,H2S不能完全电离,溶液中离子浓度小,导电能力弱,Na2S在溶液中完全电离,溶液中离子浓度大,导电能力强于同浓度的H2S溶液,C项正确;AgCl和AgI的Ksp不等,该溶液中c(Cl-)和c(I-)不可能相等,D项错误。
13.下列有关电解质溶液的说法正确的是( )
A.在蒸馏水中滴加浓H2SO4,Kw不变
B.CaCO3难溶于稀硫酸,也难溶于醋酸
C.在Na2S稀溶液中,c(H+)=c(OH-)-2c(H2S)-c(HS-)
D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
答案 C
解析 水的电离是吸热过程,升高温度促进水电离,浓硫酸在水中稀释放出热量,所以水的离子积常数变大,A错误;CaCO3与硫酸反应生成的硫酸钙微溶于水,阻止反应继续进行,而醋酸钙易溶于水,且酸性CH3COOH>H2CO3
- 9 -
,所以碳酸钙难溶于稀硫酸,易溶于醋酸,B错误;根据质子守恒得c(H+)=c(OH-)-2c(H2S)-c(HS-),C正确;氯化钠是强酸强碱盐,对水的电离无影响,醋酸铵是弱酸弱碱盐,促进水电离,D错误。
14. 如图是常温下向20.0 mL的盐酸中,逐滴加入0.10 mol·L-1 NaOH溶液时,溶液的pH随 NaOH溶液的体积V(mL)变化的曲线,根据图像所得的下列结论中正确的是( )
A.原盐酸的浓度为0.10 mol·L-1
B.x的值为2.0
C.pH=12,V值为20.4
D.原盐酸的浓度为1.0 mol·L-1
答案 A
解析 当V(NaOH)=0 mL时,盐酸溶液的pH=1,因此c(HCl)=0.10 mol·L-1,A正确,D错误;当反应后溶液pH=7时,HCl与NaOH恰好完全反应,因此n(HCl)=n(NaOH),故V(NaOH)=20.0 mL,B错误;当反应后溶液pH=12时,=1×10-2 mol·L-1,解得V(NaOH)≈24.4 mL,C错误。
15.室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号
起始浓度/(mol·L-1)
反应后溶液的pH
c(HA)
c(KOH)
①
0.1
0.1
9
②
x
0.2
7
下列判断不正确的是( )
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.0.1 mol·L-1HA的溶液中由水电离出的c(H+)=1×10-13 mol·L-1
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol·L-1
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
答案 B
解析 室温下,将等体积等浓度的HA和KOH混合(忽略体积变化),溶液呈碱性,说明该盐是强碱弱酸盐,其溶液呈碱性,c(OH-)>c(H+),水的电离较微弱,所以c(A-)>c(OH-),A正确;HA是弱酸,0.1 mol·L-1HA的溶液中H+浓度小于0.1 mol·L-1,由水电离出的c(H+)大于1×10-13 mol·L-1,B错误;等物质的量的酸和碱恰好反应时,溶液呈碱性,要使等体积的酸和碱混合后溶液呈中性,则酸的浓度应大于碱,根据物料守恒得反应后的溶液中c(A-)+c(HA)>0.1 mol·L-1,故C正确;溶液中存在电荷守恒,即c(K+)+c(H+)=c(A-)+c(OH
- 9 -
-),溶液呈中性,即c(OH-)=c(H+),则c(K+)=c(A-),中性溶液中水的电离较微弱,所以c(A-)>c(OH-),故D正确。
16.下列溶液中微粒的物质的量浓度关系正确的是( )
A.25 ℃时,pH=7的NH4Cl和NH3·H2O的混合溶液中:c(H+)=c(OH-)=c(NH)=c(Cl-)
B.0.1 mol·L-1Na2S溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)
C.25 ℃时,pH=2的HCOOH溶液与pH=12的NaOH溶液等体积混合:c(HCOO-)+c(H+)<c(Na+)+c(OH-)
D.0.1 mol·L-1Na2CO3溶液与0.1 mol·L-1NaHCO3溶液等体积混合:3c(CO)+3c(HCO)+3c(H2CO3)=2c(Na+)
答案 D
解析 A项中的溶液显中性,结合电荷守恒式可知:c(NH)=c(Cl-)>c(H+)=c(OH-),A项错误;Na2S溶液中的质子守恒式应为c(OH-)=c(H+)+c(HS-)+2c(H2S),B项错误;C项中的HCOOH是弱电解质,反应后HCOOH过量,溶液显酸性:c(H+)>c(OH-),又由电荷守恒式c(HCOO-)+c(OH-)=c(Na+)+c(H+)可得c(HCOO-)>c(Na+),故c(HCOO-)+c(H+)>c(Na+)+c(OH-),C项错误;混合溶液中,c(Na+)=0.15 mol·L-1,c(CO)+c(HCO)+c(H2CO3)=0.1 mol·L-1,故3c(CO)+3c(HCO)+3c(H2CO3)=2c(Na+),D项正确。
第Ⅱ卷(非选择题,共52分)
二、非选择题(本题包括4个小题,共52分)
17.(13分)已知t ℃时,0.01 mol/L NaOH溶液的pH=110.1 mol/L的HA溶液中=109。请回答下列问题:(1)该温度下,水的离子积Kw=________,HA是________(填“强”或“弱”)酸。(2)该温度下,将pH之和为13的NaOH溶液和HA溶液等体积混合后,所得溶液呈________(填“酸”“碱”或“中”)性,理由是______________________________________________________。
(3)在室温下,蒸馏水稀释0.01 mol/L HA溶液时,下列呈减小趋势的是________。
A.
B.
C.溶液中c(H+)和c(OH-)的乘积
D.溶液中c(A-)·c(HA)的值
E.水的电离程度
(4)室温下,取pH=2的盐酸和HA溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示:
- 9 -
①图中表示HA溶液pH变化曲线的是________(填“A”或“B”)。
②设盐酸中加入Zn的质量为m1,HA溶液中加入Zn的质量为m2,则m1________m2(填“>”“<”或“=”)。
答案 (1)1×10-13 弱(2)酸 混合前的酸中c(H+)与碱中c(OH-)相同,而HA是弱酸,等体积混合后酸过量(3)BD (4)①B ②<
解析 (1)0.01 mol/L NaOH溶液的pH=11,即c(H+)=10-11 mol/L,则Kw=0.01×10-11=1×10-13。0.1 mol/L的HA溶液中=109,则c(H+)=10-2 mol/L,故HA为弱酸。
(2)pH之和为13的NaOH溶液和HA溶液等体积混合后,HA有剩余,酸过量,溶液显酸性。
(3)A项,加水稀释时n(H+)的增加量大于n(A-),增大;B项,K=,=,由于K不变,c(H+)减小,则减小;C项,c(H+)和c(OH-)的乘积为Kw,温度不变,Kw不变;D项,稀释时,c(A-)、c(HA)均减小,故c(A-)·c(HA)减小;E项,水的电离程度增大。
(4)①向HA溶液中加入Zn,HA电离程度增大,c(H+)减小的慢,故曲线B对应的是HA。②pH由2变为4时,HA减小的物质的量大于HCl减小的物质的量,因此HA消耗的Zn质量较大。
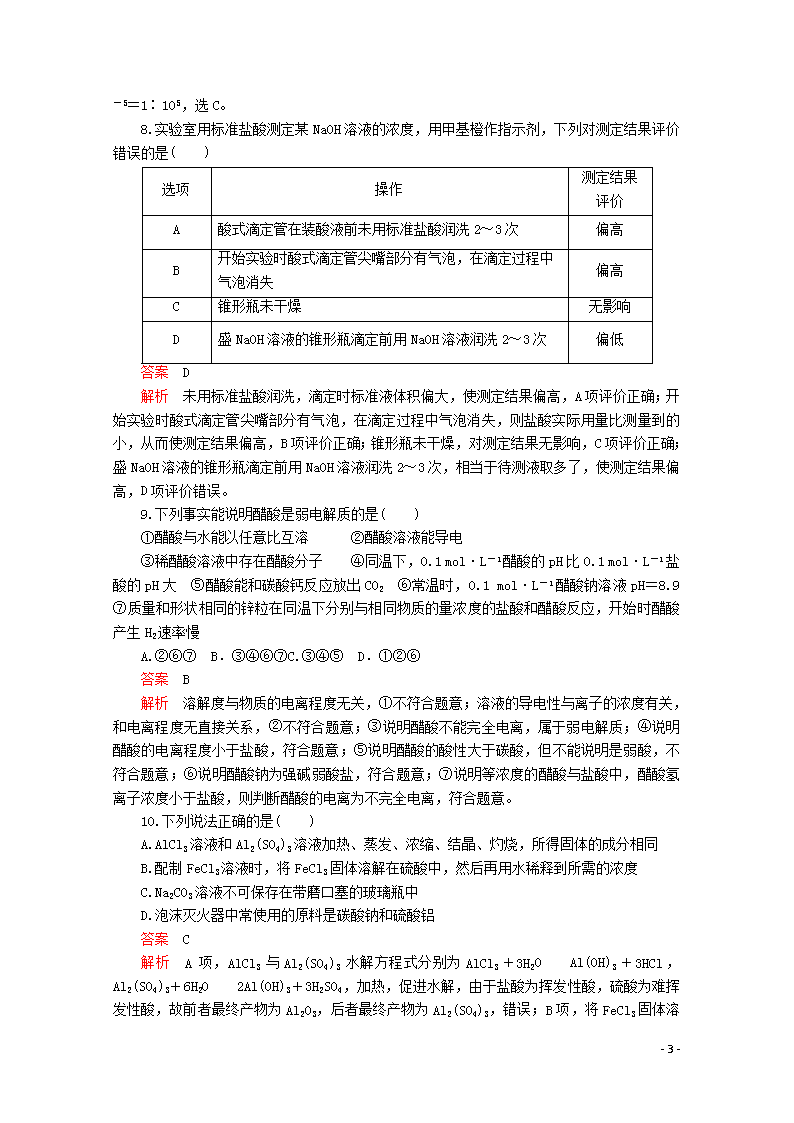
18.(13分)乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4·xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。该组同学的研究课题是:探究测定草酸晶体(H2C2O4·xH2O)中的x值。通过查阅资料,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O学习小组的同学设计了滴定的方法测定x值。
①称取1.260 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4。
③用浓度为0.1000 mol·L-1的酸性KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL。
- 9 -
(1)滴定时,将酸性KMnO4标准液装在如图中的________(填“甲”或“乙”)滴定管中。
(2)本实验滴定达到终点的标志是___________________________________。
(3)通过上述数据,求得x=________。讨论:
①若滴定终点时俯视滴定管刻度,则由此测得的x值会________(填“偏大”“偏小”或“不变”,下同)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会________。
答案 (1)甲
(2)当滴入最后一滴酸性KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色,即达滴定终点
(3)2 ①偏大 ②偏小
解析 (1)因为酸性KMnO4具有强氧化性,会腐蚀橡胶管,故应用酸式滴定管盛装。
(2)可利用酸性KMnO4溶液自身的颜色作为指示剂判断滴定终点,当达到滴定终点时,溶液将由无色变为紫色且半分钟内不褪色。
(3)由题给化学方程式及数据可知,1.260 g纯草酸晶体中含H2C2O4的物质的量为0.1000 mol·L-1×10.00 mL×10-3 L·mL-1××=0.0100 mol,则1.260 g H2C2O4·xH2O中含H2O的物质的量为=0.0200 mol,则x=2。若滴定终点时俯视滴定管读数,则所得消耗酸性KMnO4溶液的体积偏小,由此所得n(H2C2O4)偏小,则n(H2O)偏大,x偏大;同理,若酸性KMnO4溶液变质浓度偏小,则消耗其体积偏大,所得x值偏小。
19.(13分)某二元酸(化学式用H2B表示)在水中的电离方程式是H2B===H++HB-;HB-H++B2-。回答下列问题。
(1)在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是________。
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
B.c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
(2)常温下,已知0.1 mol·L-1NaHB溶液的pH=2,则0.1 mol·L-1 H2B溶液中的氢离子的物质的量浓度可能________0.11 mol·L-1(填“<”“>”或“=”),理由是____________________________________________________________________。
- 9 -
(3)0.1 mol·L-1 NaHB溶液中各种离子浓度由大到小的顺序是_______________________________________________________________。
答案 (1)BCD
(2)< 0.1 mol·L-1 NaHB溶液的pH=2,说明其中c(H+)=0.01 mol·L-1,主要是HB-电离产生的。在H2B溶液中,第一步电离产生的H+抑制了第二步的电离,所以0.1 mol·L-1 H2B溶液中c(H+)<0.11 mol·L-1
(3)c(Na+)>c(HB-)>c(H+)>c(B2-)>c(OH-)
解析 (1)HB-不水解,Na2B溶液中不存在H2B分子,B为质子守恒式,C为电荷守恒式,D为物料守恒式。
20.(13分)某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示:
(1)a点表示Ag2SO4________(填“饱和”或“不饱和”)溶液。
(2)b点对应的Ksp________(填“<”“>”或“=”)c点对应的Ksp。
(3)现将足量的Ag2SO4分别放入:a.40 mL 0.01 mol·L-1 K2SO4溶液b.10 mL蒸馏水c.10 mL 0.02 mol·L-1 H2SO4溶液则Ag2SO4的溶解度由大到小的排列顺序为________(填字母)。
(4)下列有关Ag2SO4的说法中正确的是________。A.含有大量SO的溶液中肯定不存在Ag+B.Ag2SO4的溶度积常数Ksp=1.6×10-5 (mol·L-1)3C.0.02 mol·L-1的AgNO3溶液与0.2 mol·L-1的Na2SO4溶液等体积混合不会生成沉淀
(5)往Ag2SO4固体中加入足量的Na2CrO4溶液,可观察到砖红色沉淀(Ag2CrO4为砖红色),写出沉淀转化的离子方程式:_____________________________。
答案 (1)不饱和 (2)= (3)b>a>c (4)BC
(5)Ag2SO4+CrOAg2CrO4+SO
解析 (1)曲线上的点都是处于平衡状态,此时纵坐标与横坐标二次方的乘积等于Ksp,a点对应的纵坐标与横坐标二次方的乘积小于Ksp,没有达到饱和。(2)Ksp仅与温度有关。(3)SO对Ag2SO4的溶解起抑制作用,使溶解度减小,SO浓度越大,Ag2SO4的溶解度越小。(4)由Ag2SO4(s)2Ag+(aq)+SO(aq)知A错误;取图像中b点计算:Ksp=c2(Ag+)·c(SO)=(2×10-2 mol·L-1)2×4×10-2 mol·L-1=1.6×10-5 (mol·L-1)3,B正确;Qc=c2(Ag+)·c(SO)=(1×10-2 mol·L-1)2×0.1 mol·L-1=1×10-5(mol·L-1)3
查看更多