- 2021-07-02 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
天津市南开区2019届高三下学期一模考试 化学(PDF版)
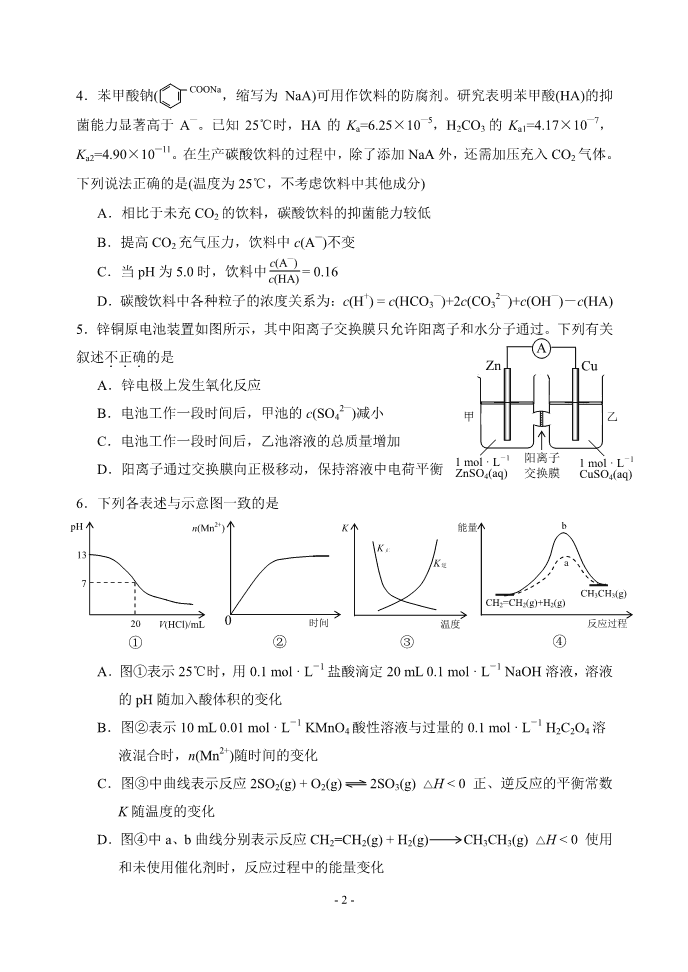
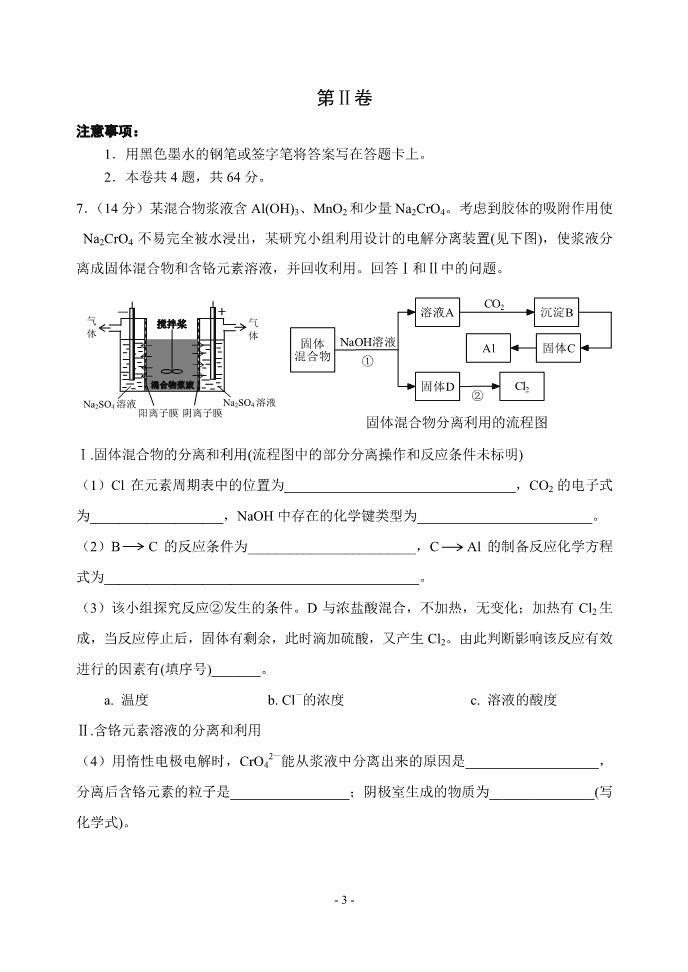
- 1 - 南开区 2018~2019 学年度高三理科综合能力测试(一) (化学部分) 化学试卷分为第Ⅰ卷(选择题)和第Ⅱ卷两部分,第Ⅰ卷 1 至 2 页,第Ⅱ卷 3 至 6 页,共 100 分。 第Ⅰ卷 注意事项: 1.答第 I 卷前,考生务必将自己的姓名、准考号、科目涂写在答题卡上。 2.每题选出答案后,用 2B 铅笔将答题卡上对应题目的答案标号涂黑。如需改动, 用橡皮擦干净后,再选涂其他答案标号。I 卷答案答在试卷上无效。 3.本卷共 6 题,每题 6 分,共 36 分。在每题列出的四个选项中,只有一项是最符 合题目要求的。 以下数据可供解题时参考: 相对原子质量:H-1 C-12 N-14 O-16 Fe-56 Cu-64 Zn-65 1.化学与生产、生活息息相关,下列叙述错误..的是 A.用灼烧的方法可以区分蚕丝和人造纤维 B.可以用 Si3N4、Al2O3 制作高温结构陶瓷制品 C.Ge(32 号元素)的单晶可以作为光电转换材料用于太阳能电池 D.纤维素在人体内可水解为葡萄糖,故可作为人类的营养物质 2.下列有关物质性质的比较,结论正确的是 A.碱性:LiOH < RbOH B.溶解度:Na2CO3 < NaHCO3 C.热稳定性:PH3 < SiH4 D.沸点:C2H5OH < C2H5SH 3.下列叙述正确的是 A.NaCl 溶液和 CH3COONH4 溶液均显中性,两溶液中水的电离程度相同 B.原电池中发生的反应达平衡时,该电池仍有电流产生 C.NH4F 水溶液中含有 HF,因此 NH4F 溶液不能存放于玻璃试剂瓶中 D.反应 4Fe(s) + 3O2(g) === 2Fe2O3(s)常温下可自发进行,该反应为吸热反应 - 2 - 4.苯甲酸钠( ,缩写为 NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑 菌能力显著高于 A—。已知 25℃时,HA 的 Ka=6.25×10—5,H2CO3 的 Ka1=4.17×10—7, Ka2=4.90×10—11。在生产碳酸饮料的过程中,除了添加 NaA 外,还需加压充入 CO2 气体。 下列说法正确的是(温度为 25℃,不考虑饮料中其他成分) A.相比于未充 CO2 的饮料,碳酸饮料的抑菌能力较低 B.提高 CO2 充气压力,饮料中 c(A—)不变 C.当 pH 为 5.0 时,饮料中 = 0.16 D.碳酸饮料中各种粒子的浓度关系为:c(H+) = c(HCO3 —)+2c(CO3 2—)+c(OH—)-c(HA) 5.锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过。下列有关 叙述不.正确..的是 A.锌电极上发生氧化反应 B.电池工作一段时间后,甲池的 c(SO4 2—)减小 C.电池工作一段时间后,乙池溶液的总质量增加 D.阳离子通过交换膜向正极移动,保持溶液中电荷平衡 6.下列各表述与示意图一致的是 A.图①表示 25℃时,用 0.1 mol · L-1 盐酸滴定 20 mL 0.1 mol · L-1 NaOH 溶液,溶液 的 pH 随加入酸体积的变化 B.图②表示 10 mL 0.01 mol · L-1 KMnO4 酸性溶液与过量的 0.1 mol · L-1 H2C2O4 溶 液混合时,n(Mn2+)随时间的变化 C.图③中曲线表示反应 2SO2(g) + O2(g) 2SO3(g) △H < 0 正、逆反应的平衡常数 K 随温度的变化 D.图④中 a、b 曲线分别表示反应 CH2=CH2(g) + H2(g) CH3CH3(g) △H < 0 使用 和未使用催化剂时,反应过程中的能量变化 COONa c(A—) c(HA) A Zn Cu 甲 乙 阳离子 交换膜 1 mol · L-1 ZnSO4(aq) 1 mol · L-1 CuSO4(aq) CH3CH3(g) ① 温度 K 逆 K ③ K 正 ④ 反应过程 CH2=CH2(g)+H2(g) a b ② 时间 0 V(HCl)/mL pH 7 13 20 n(Mn2+) 能量 - 3 - 第Ⅱ卷 注意事项: 1.用黑色墨水的钢笔或签字笔将答案写在答题卡上。 2.本卷共 4 题,共 64 分。 7.( 14 分)某混合物浆液含 Al(OH)3、MnO2 和少量 Na2CrO4。考虑到胶体的吸附作用使 Na2CrO4 不易完全被水浸出,某研究小组利用设计的电解分离装置(见下图),使浆液分 离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。 Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明) (1)Cl 在元素周期表中的位置为_________________________________,CO2 的电子式 为___________________,NaOH 中存在的化学键类型为_________________________。 (2)B C 的反应条件为________________________,C Al 的制备反应化学方程 式为_____________________________________________。 (3)该小组探究反应②发生的条件。D 与浓盐酸混合,不加热,无变化;加热有 Cl2 生 成,当反应停止后,固体有剩余,此时滴加硫酸,又产生 Cl2。由此判断影响该反应有效 进行的因素有(填序号)_______。 a. 温度 b. Cl—的浓度 c. 溶液的酸度 Ⅱ.含铬元素溶液的分离和利用 (4)用惰性电极电解时,CrO4 2—能从浆液中分离出来的原因是___________________, 分离后含铬元素的粒子是_________________;阴极室生成的物质为_______________(写 化学式)。 搅拌桨 混合物浆液 + - 气 体 气 体 Na2SO4 溶液 阳离子膜 阴离子膜 Na2SO4 溶液 固体 混合物 溶液A 沉淀B 固体D 固体CAl Cl2 NaOH溶液 ① CO2 ② 固体混合物分离利用的流程图 - 4 - 8.( 18 分)扁桃酸衍生物是重要的医药中间体。以 A 和 B 为原料合成扁桃酸衍生物 F 的 路线如下: (1)A 分子式为 C2H2O3,可 发 生 银镜反应,且具有酸性,A 所含官能团名称为__________。 写出 A + B C的化学反应方程式:_____________________________________。 (2)C ( )中①、②、③ 3 个-OH 的酸性由弱到强的顺序是_________。 (3)E 是由 2 分子 C 生成的含有 3 个六元环的化合物,E 分子中不同化学环境的氢原子 有_________种。 (4)D F的反应类型是________________,1 mol F在一定条件下与足量 NaOH 溶 液反应,最多消耗 NaOH 的物质的量为_________mol。 写出符合下列条件的 F 的所有同分异构体(不考虑立体异构)的结构简式: ___________________________________________________________。 ①属于一元酸类化合物;②苯环上只有 2 个取代基且处于对位,其中一个是羟基。 (5)已知: A 有多种合成方法,在方框中写 出由乙酸合成 A 的路线流程图(其他原料任选)。合成路线流程图示例如下: CH2=CH2 CH3CH2OH CH3COOC2H5 A B OH OHO OH 一定条件 CH3OH 浓硫酸,△ OCH3 OHO OH 副产物E等 浓氢溴酸 △ OCH3 OHO Br C D F OH OHO OH ① ② ③ R CH2 COOH PCl3 △ R CH COOH Cl H2O 催化剂,△ CH3COOH 浓硫酸,△ - 5 - 9.( 18 分) K3[Fe(C2O4)3] · 3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。请 回答下列问题: (1)晒制蓝图时,用 K3[Fe(C2O4)3] · 3H2O 作感光剂,以 K3[Fe(CN)6]溶液为显色剂。其 光解反应的化学方程式为:2K3[Fe(C2O4)3] ==== 2FeC2O4 + 3K2C2O4 + 2CO2↑;显色反应的 化学反应式为:___ FeC2O4 +___ K3[Fe(CN)6] —— ___ Fe3[Fe(CN)6]2 + __________,配平 并完成该显色反应的化学方程式。 (2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。 ①通入氮气的目的是_________________________________________。 ②实验中观察到装置 B、F 中澄清石灰水均变浑浊,装置 E 中固体变为红色,由此判断热 分解产物中一定含有________、_________。 ③为防止倒吸,停止实验时应进行的操作是__________________________________。 ④样品完全分解后,装置 A 中的残留物含有 FeO 和 Fe2O3,检验 Fe2O3 存在的方法是: _________________________________________________________________________。 (3)测定三草酸合铁酸钾中铁的含量。 ①称量 m g 样品于锥形瓶中,溶解后加稀 H2SO4 酸化,用 c mol · L-1 KMnO4 溶液滴定至 终点。在滴定管中装入 KMnO4 溶液的前一步,应进行的操作为________________。滴定 终点的现象是_____________________。 ②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到 锥形瓶中。加稀 H2SO4 酸化,用 c mol · L-1 KMnO4 溶液滴定至终点,消耗 KMnO4 溶液 V mL。该晶体中铁的质量分数的表达式为____________________。若在滴定终点读取滴 定管刻度时,俯视 KMnO4 溶液液面,则测定结果__________________。 ③过滤、洗涤实验操作过程需要的玻璃仪器有__________________________________。 光照 N2 浓 H2SO4 A 澄清石灰水 C NaOH 溶液 B 澄清石灰水 D E F 样品 CuO - 6 - 10.( 14 分)砷(As)与氮同一主族,As 原子比 N 原子多两个电子层。可以形成 As2S3、 As2O5、H3AsO3、H3AsO4 等化合物,有着广泛的用途。回答下列问题: (1)As 的原子序数为___________。 (2)工业上常将含砷废渣(主要成分为 As2S3)制成浆状,通入 O2 氧化,生成 H3AsO4 和 单质硫。写出发生反应的化学方程式_________________________________________。该 反应需要在加压下进行,原因是___________________________________________。 (3)已知:As(s) + H2(g) + 2O2(g) === H3AsO4(s) △H1 H2(g) + O2(g) === H2O(l) △H2 2As(s) + O2(g) === As2O5(s) △H3 则反应As2O5(s) + 3H2O(l) === 2H3AsO4(s)的△H =_____________________。 (4)298K 时,将 20 mL 3x mol · L-1 Na3AsO3、20 mL 3x mol · L-1 I2 和 20 mL NaOH 溶 液混合,发生反应:AsO3 3—(aq) + I2(aq) + 2OH—(aq) AsO4 3—(aq) + 2I—(aq) + H2O(l)。溶 液中 c(AsO4 3—)与反应时间(t)的关系如图所示。 ①下列可判断反应达到平衡的是________(填标号)。 a. v(I—) = 2v(AsO3 3—) b.溶液的 pH 不再变化 c. c(I—) = y mol · L-1 d. c(AsO4 3—)/ c(AsO3 3—)不再变化 ②tm 时,v 正_______ v 逆 (填“大于”、“小于”或“等于”)。 ③tm 时 v 逆 ____ tn 时 v 逆 (填“大于”、“小于”或“等于”),理由是_____________________。 ④若平衡时溶液的 pH=14,则该反应的平衡常数为_____________________(用 x、y 表示)。 3 2 1 2 5 2 c (AsO 4 3 — )/(mol · L — 1 ) 0 tm y • tn t/min m n • - 1 - 南开区 2018~2019 学年度高三理科综合能力测试(一) (化学试卷答案) 1D 2A 3C 4D 5B 6C 7.( 14 分) (1)第三周期第ⅦA 族 (1分) (1分) 离子键、共价键 (1分) (2)加热(或煅烧) (1分) 2Al2O3(熔融) ======= 4Al + 3O2↑ (2分) (3)a c (2分) (4)在直流电场作用下,CrO4 2—通过阴离子交换膜向阳极室移动,脱离浆液 (2分) CrO4 2—和 Cr2O7 2— (2分) NaOH 和 H2 (2分) 8.( 18 分) (1)醛基 羧基 (2分) (2分) (2)② < ① < ③ (1分) (3)4 (2分) (4)取代反应 (1分) 3 (2分) (4分) (5) (4分) O C O 电解 冰晶石 CHO COOH + OH 一定条件 OH OHO OH COOH HO BrH3C COOH HO Br HO COOH Br HO COOH Br CH3COOH CH2Cl COOH CH2OH COONa NaOH H2O, △ 盐酸 CH2OH COOH O2 Cu,△ CHO COOH PCl3 △ - 2 - 9.( 18 分) (1)3 2 1 3K2C2O4 (1分) (2)①隔绝空气,使反应产生的气体全部进入后续装置 (2分) ②CO2 CO (2分) ③先熄灭装置 A、E 的酒精灯,冷 却 后 停止通入氮气 (2分) ④取少许固体粉末于试管中,加 稀硫酸溶解,滴入 1~2 滴 KSCN 溶液,溶液变红色, 证明含有 Fe2O3 (3分) (3)①用 KMnO4 溶液进行润洗 粉红色出现 (每空1分,共 2 分) ② ×100% (3分) 偏低 (1分) ③烧杯、漏斗、玻璃棒、胶头滴管(可不填“胶头滴管”) (2分) 10.( 14 分) (1)33 (1分) (2)2As2S3 + 5O2 + 6H2O === 4H3AsO4 + 6S (2分) 增加反应物 O2 的浓度,提高 As2S3 的转化率 (2分) (3)2△H1-3△H2-△H3 (2分) (4)① b d (2分) ② 大于 (1分) ③ 小于 tm 时生成物浓度较低 (每空1分,共 2 分) ④4y3/(x-y)2(mol · L-1)-1 (可不写单位) (2分) (以上答案仅供参考,合理答案均给分) 5cV×56 m×1000查看更多