- 2021-07-02 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
山东省潍坊市临朐县实验中学2021届高三化学9月月考试卷(Word版附答案)
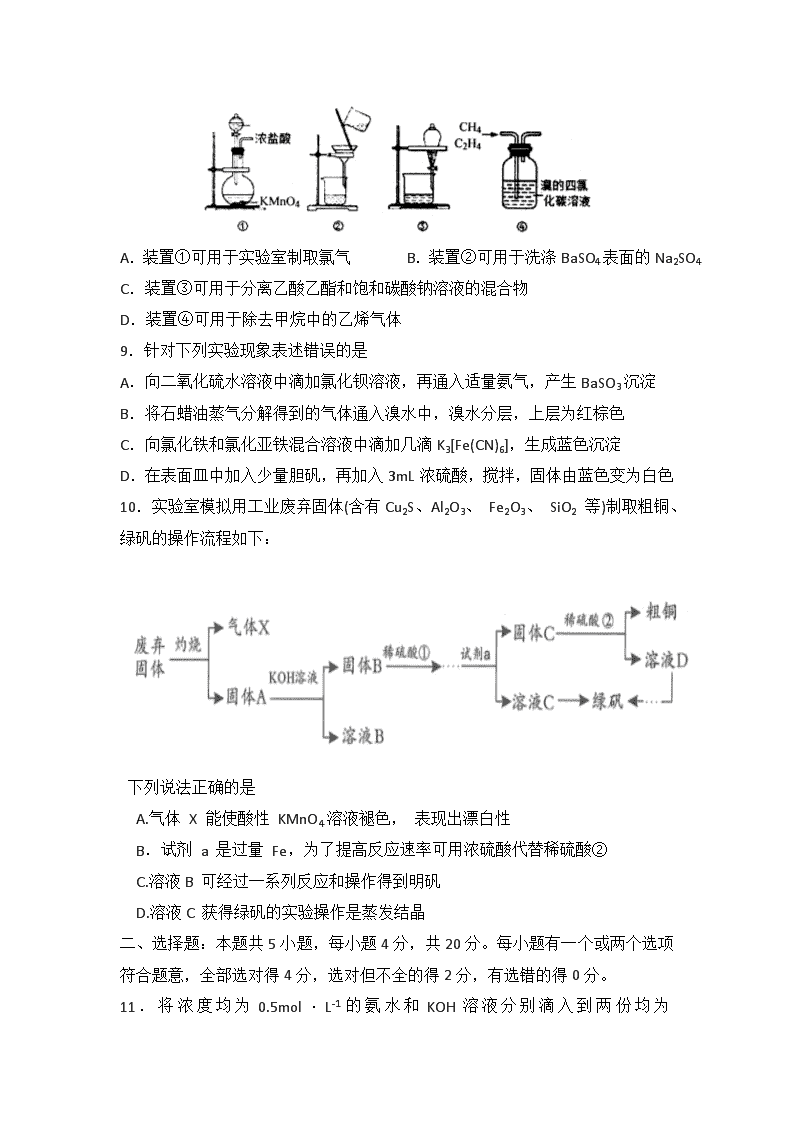
化学试题 可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Al 27 Na 23 Cu 64 B 11 Zn 65 第I卷(选择题 共40分) 一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。 1.化学与生活密切相关,下列说法错误的是 A.高浓度二氯甲烷有麻醉作用,切忌吸入或与皮肤接触 B.传统无机非金属材料碳纳米管可用于生产传感器 C.甲烷在一定条件下可以生成金刚石 D.聚乳酸可用于制作免拆型手术缝合线 2.常温常压下,某金属有机多孔材料(MOFA)对CO2具有超高的吸附能力,并能催化CO2与环氧丙烷的反应,其工作原理如图所示。下列说法错误的是 A.物质a分子中碳原子和氧原子均采取sp3杂化 B.b的一氯代物有3种 C.a生成b的反应类型为取代反应,并有极性共价键形成 D.该材料的吸附作用具有选择性,利用此法可减少CO2的排放 3.下列实验操作、现象和结论都正确的是 4.SiH4(Si为+4价)可制取LED基质材料Si3N4(超硬物质):3SiH4+4NH3==Si3N4+12H2 下列分析正确的是 A.Si3N4晶体中,Si位于正八面体的两个顶点,N位于八面体中间平面的4个点 B.Si3N4和SiH4均为共价晶体,其Si原子均采取sp3杂化 C.反应中每转移0.8mol e-,还原0.2molSiH4,生成17.92LH2(标准状况) D.电负性:Si>N>H 5.下列离子方程式正确的是 A. 碳酸钠溶液呈碱性的原因:CO32-+2H2OH2CO3+2OH- B. Cl2通入水中: Cl2+H2O 2H++Cl-+ClO- C. 向 1 L 浓度均为 l mol/L 的 FeBr2 和 FeI2混合溶液中通入 3mo1Cl2 2Fe2++2Br-+2I-+3Cl2= 2Fe3++ I2+Br2+6Cl- D.明矾溶液中加入过量的氢氧化钡溶液: Al3++SO42-+Ba2++4OH-= BaSO4↓ +AlO2-+ 2H2O 6.X、Y、Z、W、Q为原子序数依次增大的5种短周期元素,位于不同主族。Y的氢化物与其最高价氧化物对应水化物反应生成盐甲,Z、W、Q的最高价氧化物对应水化物之间两两反应均可生成盐和水,Z的某种氧化物(Z2O2)与X的某种氧化物(XO)在一定条件下发生化合反应,生成一种正盐乙。下列说法错误的是 A.Z是所在周期中原子半径最大的元素 B.甲的水溶液呈酸性,乙的水溶液呈中性 C.X、Q组成的分子可能为直线型非极性分子 D.简单离子半径:Q>Z>W 7.交警用三氧化铬(CrO3)硅胶可以查酒驾。元素Cr的几种化合物转化关系如图所示。下列判断正确的是 A.反应①表明CrO3有酸性氧化物的性质 B.CrO42-在碱性溶液中不能大量存在 C.只有反应③为氧化还原反应 D.基态铬原子的价电子排布式为3d44s2 8.下列关于各实验装置的叙述错误的是 A.装置①可用于实验室制取氯气 B.装置②可用于洗涤BaSO4表面的Na2SO4 C.装置③可用于分离乙酸乙酯和饱和碳酸钠溶液的混合物 D.装置④可用于除去甲烷中的乙烯气体 9.针对下列实验现象表述错误的是 A.向二氧化硫水溶液中滴加氯化钡溶液,再通入适量氨气,产生BaSO3沉淀 B.将石蜡油蒸气分解得到的气体通入溴水中,溴水分层,上层为红棕色 C.向氯化铁和氯化亚铁混合溶液中滴加几滴K3[Fe(CN)6],生成蓝色沉淀 D.在表面皿中加入少量胆矾,再加入3mL浓硫酸,搅拌,固体由蓝色变为白色 10.实验室模拟用工业废弃固体(含有Cu2S、Al2O3、 Fe2O3、 SiO2 等)制取粗铜、绿矾的操作流程如下: 下列说法正确的是 A.气体 X 能使酸性 KMnO4溶液褪色, 表现出漂白性 B.试剂 a 是过量 Fe,为了提高反应速率可用浓硫酸代替稀硫酸② C.溶液B 可经过一系列反应和操作得到明矾 D.溶液C 获得绿矾的实验操作是蒸发结晶 二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。 11.将浓度均为0.5mol·L-1的氨水和KOH溶液分别 滴入到两份均为20mLc1mol·L-1的AlCl3溶液中,测得溶液的导电率与加入碱的体积关系如图所示。下列说法正确的是 A.c1=0.2 B.b点时溶液的离子浓度:c(C1-)>c(NH4+)>c(OH-)>c(H+) C.ac段发生的反应为:Al(OH)3+OH-==[Al(OH)4]- D.d点时溶液中:c(K+)+c(H+)==[Al(OH)4]-+c(OH-) 12.设NA为阿伏加德罗常数的值,下列说法正确的是 A.25℃,1LpH=10的NaHCO3溶液中含有CO32-的数目为10-4NA B.1mol冰中含有4NA个氢键 C.惰性电极电解AgNO3溶液,两极均产生0.25mol气体时,电路中通过电子数为NA D.含0.1mol NH4HSO4溶液中,阳离子数目略大于0.2NA l3.废旧印刷电路板是一种电子废弃物,某科研小组设计如下工艺流程回收铜并制取胆矾(流程中RH为萃取剂),下列说法正确的是 A.反应I的离子方程式为:Cu+H2O2+2NH3+2NH4+==Cu(NH3)42++2H2O B.操作②用到的主要仪器为蒸馏烧瓶 C.操作④以石墨为电极电解硫酸铜溶液:阳极产物为O2和H2SO4 D.操作⑤为:蒸发浓缩、冷却结晶、过滤、热水洗涤、干燥 14.实验室用还原制备金属的装置如图所示(粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气)。下列说法正确的是( ) A. ①、②、③中依次盛装溶液、浓、焦性没食子酸溶液 B. 管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度 C. 结束反应时,先关闭活塞,再停止加热 D. 装置(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气 15.某溶液中可能含有 NH4+、 K+、 Ba2+、 Fe3+、I-、 SO32-、SO42-中的几种, 现取 l00 mL 溶液加入少量溴水, 溶液呈无色。继续滴加足量 HNO3和 Ba(NO3)2 混合溶液, 产生沉淀, 沉淀经洗涤、高温干燥后质量为 4.66g。滤液加足量 NaOH 溶液、加热,生成气体在标准状况下体积为1120 mL。(已知还原性:SO32- >I-)根据上述实验, 以下推测正确的是 A. 原溶液肯定只存在NH4+ 、SO32- B. 原溶液一定不含 Ba2+、 Fe3+、I- C. 原溶液可能存在 K+、 SO42- D. 另取试液滴加足量盐酸、BaCl2 溶液, 即可确定溶液离子组成 第II卷(非选择题 共60分) 三、非选择题:本题共5小题,共60分。 16.(12分)为测定CuSO4溶液的浓度,某同学设计了一个方案。回答下列问题: 实验原理:, 实验步骤: ①按上图安装装置(夹持仪器略去) ②…… ③在仪器A、B、C、D、E…中加入图示的试剂 ④调整D、E中两液面相平,使D中液面保持在0或略低于0刻度位置,读数并记录。 ⑤将CuSO4溶液滴入A中搅拌,反应完成后,再滴加稀硫酸至体系不再有气体产生 ⑥待体系恢复到室温,移动E管,保持D、E中两液面相平,读数并记录 ⑦处理数据 (1)仪器A的名称________________________。 (2)步骤②为________________________________________。 (3)步骤⑥需保证体系恢复到室温的原因是________(填序号)。 a.反应热受温度影响 b.气体密度受温度影响 c.反应速率受温度影响 (4)Zn粉质量为ag,若测得H2体积为bmL,已知实验条件下,则c(CuSO4)______mol/L(列出计算表达式)。 (5)若步骤⑥E管液面高于D管,未调液面即读数,则测c(CuSO4)________(填“偏高”、“偏低”或“无影响”)。 (6)是否能用同样的装置和方法测定MgSO4溶液的浓度:_________(填“是”或“否”)。 17、以铁、硫酸、柠檬酸、双氧水、氨水等为原料可制备柠檬酸铁铵【(NH4)3Fe(C6H5O7)2】。 (1)Fe基态核外电子排布式为___________; 中与Fe2+配位的原子是________(填元素符号)。 (2)NH3分子中氮原子的轨道杂化类型是____________; C、N、O元素的第一电离能由大到小的顺序为_______________。 (3)与NH互为等电子体的一种分子为_______________(填化学式)。 (4)柠檬酸的结构简式见下图。1 mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为_________mol。 18.(12分)草酸是草本植物常具有的成分。查阅相关资料得到草酸晶体(H2C2O4·3H2O)及其盐的性质如下表。 (1)草酸晶体(H2C2O4·3H2O)175℃以上会发生分解生成三种氧化物,某实验小组欲通过实验证明这三种氧化物。 ①该小组选用装置_________作为分解装置。 ②从下图选用合适的装置,验证分解产生的气体,装置的连接顺序是______________。(用装置编号表示,某些装置可以重复使用,也可以装不同的试剂) ③B装置的作用是________________________。 (2)某实验小组称取4.0g粗草酸晶体配成100mL溶液,采用0.1mol·L-1酸性高锰酸钾溶液滴定该草酸溶液,测定该草酸晶体的纯度。 ①配制草酸溶液需要用到的主要玻璃仪器有_______________。 ②本实验达到滴定终点的标志是______________________。 ③将所配草酸分为四等份,实验测得每份平均消耗酸性高锰酸钾溶液20mL。计算该粗草酸中含草酸晶体的质量为_______g(保留两位有效数字)。 19.(12分)高锰酸钾消毒片主要成分为KMnO4,可外用消炎杀菌。用某软锰矿(主要成分是MnO2,还含有A12O3、SiO2等杂质)制备KMnO4的流程图如下: 已知:K2MnO4固体和溶液均为墨绿色,溶液呈碱性且能发生可逆的歧化反应。 (1)“操作I”中玻璃棒的作用是____________。“操作Ⅱ”时,当__________时,停止加热,自然冷却,抽滤后即可获得紫黑色KMnO4晶体。 (2)向“浸取液”中通入CO2,调节其pH,经“过滤”得滤渣I,滤渣I的成分为__________。 (3)“熔融煅烧”时,MnO2参与反应的化学方程式为_________________________。 (4)“歧化”时,加入冰醋酸的目的是___________________________(用必要的离子方程式和文字解释)。 (5)“歧化”时,下列酸可以用来代替冰醋酸的是___________(填字母)。 a.浓盐酸 b.亚硫酸 c.稀硫酸 d.氢碘酸 20. (12分) 白磷在化工、军事等领域有着广泛应用。工业上采用、及C为原料制备,产物除外,还有、等。回答下列问题: (1)下列状态的钙中,电离最外层第一个电子所需能量最小的是________(填选项字母)。 A. B. C. D. (2)的空间构型为____________________________,酸性条件下,可与形成从而掩蔽溶液中的,基态核外M层有________种空间运动状态不同的电子。 (3)分子中P原子的杂化形式为____________________,难溶于水而易溶于,原因是____________________________________。 (4)CO可与第四周期过渡元素形成羰基配合物,形成配合物时,每个CO提供一对电子与金属原子形成配位键,研究发现金属原子的价电子和CO提供的电子总和等于18。中所含键的物质的量为________mol(填数值) (5)天然硅酸盐组成复杂,其复杂性在其阴离子,而阴离子的基本结构单元是硅氧四面体。硅、氧原子通过共用氧原子形成各种不同的硅酸根负离子,无限长链的硅酸根离子(如图a所示)的化学式可用通式表示为_____________________________(用n代表Si原子数,不考虑边界氧原子)。 化学试题参考答案 一、选择题(15个小题,共40分。1~10为单项选择题,每题2分,共20分;11~15为不定项选择题,全部选对的得4分,选对但不全的得1分,有选错的得0分,共20分) 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 B C D A C B A D B C C CD AC B C 二、填空题(共60分) 16.(12分)(1)三颈烧瓶(2). 检查装置气密性 (3). b (4). (5). 偏高 (6). 否 17.(共12分) (1). 1s22s22p63s23p63d64s2或[Ar]3d64s2 O (2). sp3 N>O>C (3). CH4或SiH4 (4). 7 18.(12分) (1)①丙②EBCDCEFC③冷凝草酸,防止生成白色草酸钙沉淀干扰CO2的检验 (2)①烧杯、玻璃棒、容量瓶、胶头滴管(可写可不写)②最后一滴高锰酸钾滴入,溶液突然无色变到粉红色(或淡红色)且半分钟内颜色不变③2.9 19.(12分) (1)引流;表面出现晶膜(2分,答出“有少量晶体析出”也得分) (2)Al(OH)3和H2SiO3(2分,答出一种给1分,H2SiO3写成H4SiO4也得分) (3)2MnO2+4KOH+O2 2K2MnO4+2H2O(2分) (4)调节溶液pH,使3MnO42-+2H2O 2MnO4-+MnO2↓+4OH-平衡向右移动,促进KMnO4的生成,提高KMnO4的产率(2分) (5)c(2分) 20.(12分) (1)C(2分)(2)正四面体形(1分)9(1分) (3)(2分) 和均为非极性分子,为极性分子,根据相似相溶原理,难溶于水而易溶于(2分) (4)12(2分) (5)(或)(2分,其他合理答案也给分)查看更多