- 2021-07-02 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高一化学金属总结
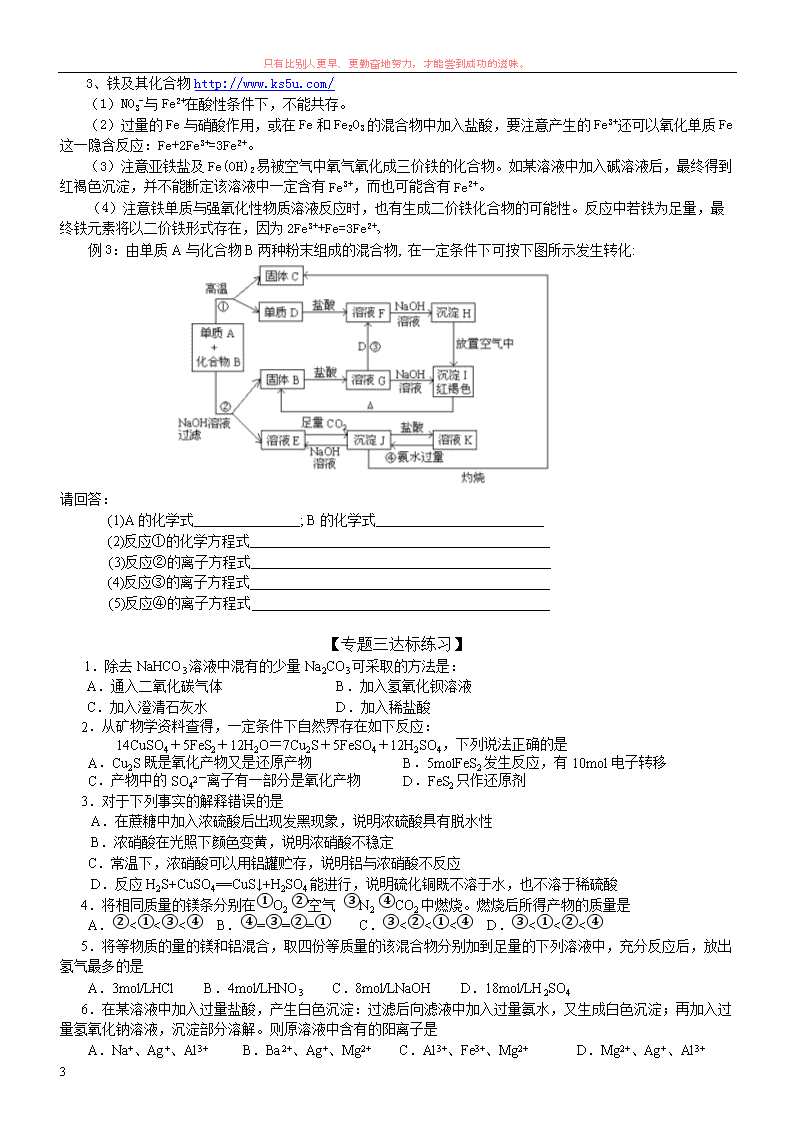
只有比别人更早、更勤奋地努力,才能尝到成功的滋味。 1 常见金属元素单质及其重要化合物(基础+拓展) 一、金属的性质 1.金属物理性质 (1)状态:在常温下,除汞(Hg)外,其余金属都是固体。 (2)颜色:大多数金属呈银白色(处于粉末状时,常显黑色),而金、铜、铯等具有特殊颜色。 (3)密度:差别很大,钾、镁、铝均为轻金属(密度小于 4.5 g·cm-3),密度最大的是锇,达 21.45 g·cm-3。 (4)硬度:差别很大,如钠、钾的硬度很小,可用小刀切割;最硬的金属是铬。 (5)熔点:差别很大,如熔点最高的金属为钨,其熔点为 3410℃,而汞的熔点为-38.9℃。 (6)大多数金属都具有延展性,是电和热的良导体,其中银和铜的传热、导电性能最好。 2.金属化学性质(重点) 金属活动性顺序表: (1)金属与水反应: ①活泼金属 K、Ca、Na 与冷水发生剧烈置换反应,生成碱和氢气。如:2K+2H2O==2KOH+H2↑ ②较活泼金属 Mg 与沸水发生置换反应,生成碱和氢气。如:Mg+2H2O Mg(OH)2↓+H2↑ ③金属 Fe 在高温下与水蒸汽发生置换反应。如:3Fe+4H2O(气) Fe3O4+4H2↑ ④氢后金属不与水发生反应。 (2)金属与氧气反应: ①活泼金属 K、Ca、Na 常温下在空气中易被氧化,在空气中又可发生燃烧。如: 4Na+O2=2Na2O(继续反应:2Na2O+O2=2Na2O2)或 2Na+O2 Na2O2 ②较活泼金属 Mg、Al 常温下在空气中易氧化,形成氧化膜,也可发生燃烧。如: 4Al+3O2=2Al2O3 4Al+3O2(纯) 2Al2O3 ③金属 Fe 等常温下在干燥空气中不反应,加热被氧化,纯氧中可燃烧。如:3Fe+2O2(纯) Fe3O4 ④金属 Cu 在强热条件下,只氧化而不发生燃烧。如:2Cu+O2 2CuO ⑤Hg 以后金属不能被氧气氧化 (3)金属与非氧化性酸(盐酸、稀 H2SO4)反应 ①氢前金属能置换酸中的氢,生成盐和氢气。 ②氢后金属不能发生反应 (4)金属与氧化性酸(浓 H2SO4,浓稀 HNO3)反应, ①活泼金属 K、Ca、Na 和氧化性酸反应较复杂(不要求掌握); ②Mg→Ag 与氧化性酸发生氧化还原反应,生成盐、水和气体,但气体不是氢气,而是含氧酸的还原产 物,其中硫酸还原产物是 SO2,浓硝酸还原产物是 NO2,稀硝酸还原产物是 NO。如: Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O ③Pt、Au 只能溶于王水。 ④常温下,浓 H2SO4、浓 HNO3 使 Fe、Al 表面生成致密氧化膜,而不生成 H2,即表面发生“钝化”。 (5)金属与盐溶液反应: ①活泼金属 K、Ca、Na 放入盐溶液后,首先与水发生置换反应,生成碱和氢气;所生成的碱再与盐发生复 分解反应。如 Na 投入 CuSO4 溶液中 2Na+2H2O=2NaOH+H2↑、2NaOH+CuSO4=Cu(OH)2↓+Na2SO4 或合并成: 2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑ ②Mg 和 Mg 以后的金属,一般发生“活泼”金属单质(前面金属)将后面的金属从盐溶液中置换出来;如: Fe+CuSO4=FeSO4+Cu.其他反应有 Cu+2FeCl3=2FeCl2+CuCl2,Fe+2FeCl3=3FeCl2。 (6)某些金属与强碱溶液反应:Zn、Al 和强碱溶液发生反应,生成盐和氢气。 只有比别人更早、更勤奋地努力,才能尝到成功的滋味。 2 2Al+2NaOH+2H2O=2NaAlO2+3H2↑(两种写法) Zn+2NaOH=Na2ZnO2+H2↑ (7)某些金属与氧化物反应: ①Mg 与 CO2 发生置换反应,生成黑、白色两种固体。2Mg+CO2 2MgO+C ②Al 和其它金属氧化物,发生铝热反应放出大量热,如:8Al+3Fe3O4 4Al2O3+9Fe (8)金属与非金属(S、F2、Cl2 等)反应 ①金属性越强,越易发生化合,如:Fe+S FeS,2Cu+S Cu2S。 ②Au、Pt 难与非金属直接发生反应。 ③金属 Mg 等与氮气发生化合反应,如:3Mg+N2 Mg3N2. 3.金属氧化物对应的水化物为碱,碱的稳定性比较: ①K、Ca、Na 的氧化物和水反应,生成可溶性的碱 KOH 和 NaOH 及微溶性碱 Ca(OH)2: K2O+H2O=2KOH,Na2O+H2O=2NaOH,CaO+H2O=Ca(OH)2;这些氢氧化物受热不易分解。 ②Mg 的氧化物和水缓慢反应,生成难溶性碱 Mg(OH)2,Mg(OH)2 受热易分解。 ③Al 以后的金属氧化物,不溶于水,也不与水反应,其对应的水化物(碱)不能由氧化物与水直接反应生 成,而碱的热稳定性逐渐减弱,即受热易分解。如:2Fe(OH)3 Fe2O3+3H2O Cu(OH)2 CuO+H2O 二、重点金属元素化合物 1、镁铝及其化合物 http://www.ks5u.com/ (1)镁是活泼金属,不跟碱性溶液反应,能置换出酸中的氢。 (2)注意对 Al2O3、Al(OH)3 两性的理解,以及对 Al3+、AlO2 -存在条件的认识。 Al2O3、Al(OH)3 仅能溶于强酸和强碱溶液中。 (3)注意研究以下几个实验现象及产生沉淀的量与加入物质的量的数量关系的图象: ①向 AlCl3 溶液中逐滴加入 NaOH 溶液直至过量;②向 AlCl3 和 MgCl2 混合中逐滴加入 NaOH 溶液直至过量; ③向 NaAlO2 溶液中逐滴加入 HCl 溶液直至过量;④向 HCl、NH4Cl、MgCl2、AlCl3 混合液中逐滴加入 NaOH 溶液 直至过量。 例 1:将一定质量的镁和铝的混合物投入 100mL 盐酸中,固 体全 部溶解后,向所得溶液中加入 NaOH 溶液,生成沉淀的物 质的量与加入 NaOH 溶液的体积关系如下图所示。若不考虑金属 和盐酸反应时 HCl 的挥发,则下列说法正确的是 A.镁和铝的总质量为 9g B.盐酸的物质的量浓度为 5 mol·L-1 C.NaOH 溶液的物质的量浓度为 5 mol·L-1 D.生成的氢气在标准状况下的体积为 11.2 L 2、碱金属元素化合物 http://www.ks5u.com/ (1)注意钠及其化合物溶于水所得溶液浓度的计算中,Na 及 Na2O2 溶于水均会产生气态物质,所得溶液的质 量应是原混合物质的质量总和减去产生气体的质量。 (2)注意 Na2O2 跟 CO2 和水蒸气组成的混合气体反应时的先后顺序。应先考虑 Na2O2 跟 CO2 的反应 例 2:1mol 过氧化钠与 2 mol 碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷 却,残留的固体物质是 。 只有比别人更早、更勤奋地努力,才能尝到成功的滋味。 3 3、铁及其化合物 http://www.ks5u.com/ (1)NO3 -与 Fe2+在酸性条件下,不能共存。 (2)过量的 Fe 与硝酸作用,或在 Fe 和 Fe2O3 的混合物中加入盐酸,要注意产生的 Fe3+还可以氧化单质 Fe 这一隐含反应:Fe+2Fe3+=3Fe2+。 (3)注意亚铁盐及 Fe(OH)2 易被空气中氧气氧化成三价铁的化合物。如某溶液中加入碱溶液后,最终得到 红褐色沉淀,并不能断定该溶液中一定含有 Fe3+,而也可能含有 Fe2+。 (4)注意铁单质与强氧化性物质溶液反应时,也有生成二价铁化合物的可能性。反应中若铁为足量,最 终铁元素将以二价铁形式存在,因为 2Fe3++Fe=3Fe2+ 例 3:由单质 A 与化合物 B 两种粉末组成的混合物, 在一定条件下可按下图所示发生转化: 请回答: (1)A 的化学式 ; B 的化学式 (2)反应①的化学方程式 (3)反应②的离子方程式 (4)反应③的离子方程式 (5)反应④的离子方程式 【专题三达标练习】 1.除去 NaHCO3 溶液中混有的少量 Na2CO3 可采取的方法是: A.通入二氧化碳气体 B.加入氢氧化钡溶液 C.加入澄清石灰水 D.加入稀盐酸 2.从矿物学资料查得,一定条件下自然界存在如下反应: 14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,下列说法正确的是 A.Cu2S 既是氧化产物又是还原产物 B.5molFeS2 发生反应,有 10mol 电子转移 C.产物中的 SO42-离子有一部分是氧化产物 D.FeS2 只作还原剂 3.对于下列事实的解释错误的是 A.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 B.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 C.常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应 D.反应 H2S+CuSO4==CuS↓+H2SO4 能进行,说明硫化铜既不溶于水,也不溶于稀硫酸 4.将相同质量的镁条分别在①O2 ②空气 ③N2 ④CO2 中燃烧。燃烧后所得产物的质量是 A.②<①<③<④ B.④=③=②=① C.③<②<①<④ D.③<①<②<④ 5.将等物质的量的镁和铝混合,取四份等质量的该混合物分别加到足量的下列溶液中,充分反应后,放出 氢气最多的是 A.3mol/LHCl B.4mol/LHNO3 C.8mol/LNaOH D.18mol/LH2SO4 6.在某溶液中加入过量盐酸,产生白色沉淀:过滤后向滤液中加入过量氨水,又生成白色沉淀;再加入过 量氢氧化钠溶液,沉淀部分溶解。则原溶液中含有的阳离子是 A.Na+、Ag+、Al3+ B.Ba2+、Ag+、Mg2+ C.Al3+、Fe3+、Mg2+ D.Mg2+、Ag+、Al3+ 只有比别人更早、更勤奋地努力,才能尝到成功的滋味。 4 7.若在加入铝粉能放出 H2 的溶液中,分别加入下列各组离子,肯定不能共存的是 A.Fe3+、NO3-、Cl-、Na+ B.Ba2+、Mg2+、HCO3-、AlO2- C.NO3-、Na+、K+、CO32- D.NO3-、K+、AlO2-、OH- 8.下列离子方程式书写正确的是 A.硫酸铝中加入过量氨水 Al3++3OH-=Al(OH)3↓ B.氢氧化铝跟盐酸反应 Al(OH)3+3H+=Al3++3H2O C.硫酸铜与氢氧化钡溶液反应 Ba2++SO42-=BaSO4↓ D.偏铝酸钠溶液与适量稀硝酸反应 AlO2-+H++H2O=Al(OH)3↓ 9.下列关于金属的叙述中正确的是 A.常温下所有的金属都是固态的 B.金属具有导电性、导热性和延展性 C.Al 是地壳中含量最多的元素 D.金属元素在自然界中都是以化合态存在的 10.从海水中提镁,最基本的方法是往海水里加碱,得到 Mg(OH)2 沉淀,将沉淀分离出来后再加入盐酸把 它变成 MgCl2;之后,经过滤、干燥、电解,即可得到金属镁。下列对从海水中提镁的有关说法中,正确的是 A.整个过程中没有涉及置换反应 B.往海水里加碱是指直接加入 Ca(OH)2 C.电解 MgCl2 溶液即可得到金属镁 D.电解时得到的镁蒸气应在 CO2 氛围中冷却 11.把 Al 和 Fe3O4 粉末均匀混和,分成两等分,前一份在高温下恰好完全反应,将生成物与 足量的盐酸充分反应,后一份直接与足量的 NaOH 溶液反应,前后两种情况生成的气体的物质的量之比为 A.1:1 B.9:8 C.3:4 D.4:3 12.制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为 2FeCl3+Cu=2FeCl2+CuCl2。向盛有氯化 铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能...出现的是 A.烧杯中有铜无铁 B.烧杯中有铁无铜 C.烧杯中铁、铜都有 D.烧杯中铁、铜都无 13.下列各组的两种溶液中,分别加入足量氨水,观察到的现象相同的是 A.FeCl3 AlCl3 B.NaCl BaCl2 C.MgCl2 CuCl2 D.FeCl2 FeCl3 14.四种黑色粉末 CuO、FeO、MnO2、C(石墨粉)只需加入一种试剂即可将它们区别开来, 这种试剂是 A.NaOH 溶液 B.稀 H2SO4 C.浓盐酸 D.蒸馏水 15.在相同体积的 KI、FeCl2、FeBr2 的溶液里, 分别通入足量的氯气并且发生完全充分反应, 若它们耗用 Cl2 的质量相同, 则 KI、FeCl2、FeBr2 三种溶液的物质的量浓度比 A.6∶3∶2 B.1∶3∶3 C.3∶3∶1 D.1∶2∶3 16.下列各组物质反应后,滴入 KSCN 溶液一定显红色的是 A.生了锈的铁块放入稀 H2SO4 中 B.FeCl3、CuCl2 的混合溶液中加入过量的铁粉 C.FeO 放入稀 HNO3 中 D.Fe 放入 HNO3 溶液中 17.某溶液中有 NH4 +、Mg2+、Fe2+ 和 Al3+ 四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌, 再加入过量盐酸,溶液中大量减少的阳离子是 A. NH4 + B. Mg2+ C. Fe2+ D. Al3+ 18.把 a g 铁铝合金粉末溶于足量盐酸中,加入过量 NaOH 溶液。过滤出沉淀,经洗涤、干燥、灼烧,得 到红棕色粉末的质量仍为 a g,则原合金中铁的质量分数为 A 70% B 52% C 47% D 30% 19.某溶液中可能含种有 Fe2+、Mg2+、Cu2+、NH4 +、Al3+中的一种或 几种。当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀 生成,加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质 的量(纵坐标)的关系,如下图所示。请填写下列空白: 则所加的淡黄色固体是 在该溶液中含有的离子 是 ,它们的物质的量浓度之比为 。查看更多