- 2021-05-14 发布 |
- 37.5 KB |
- 25页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学工艺流程专题训练
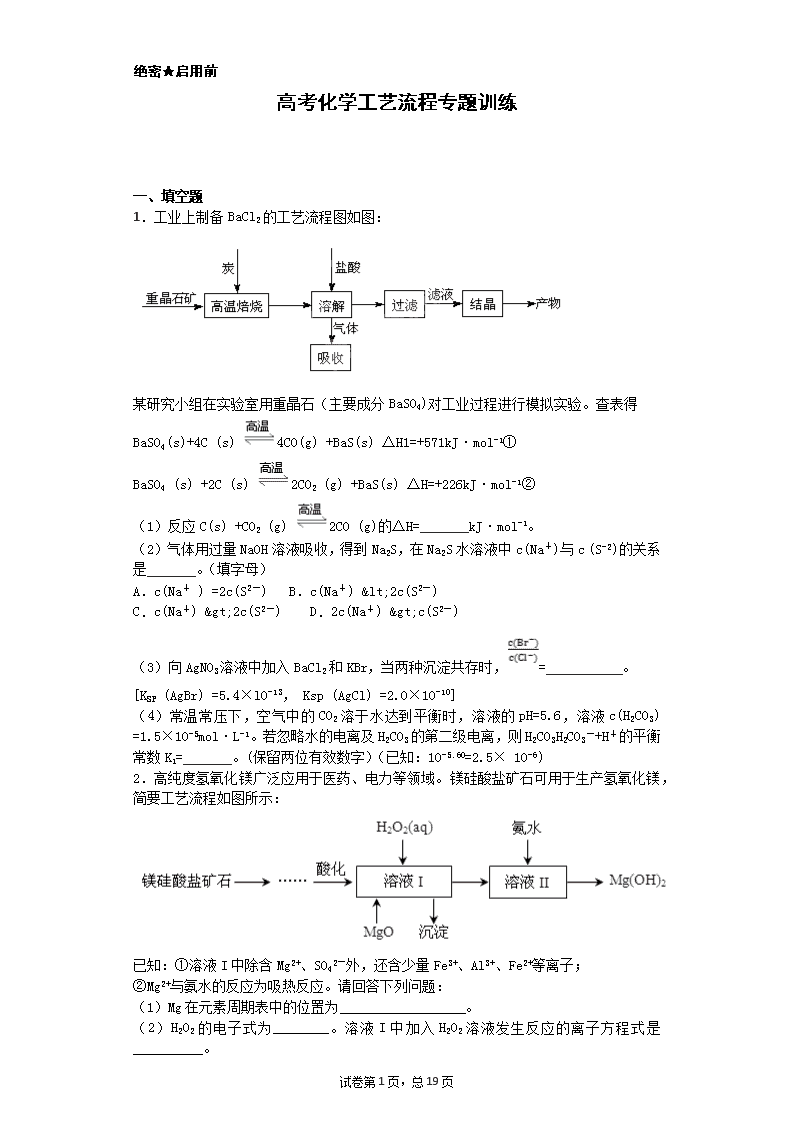
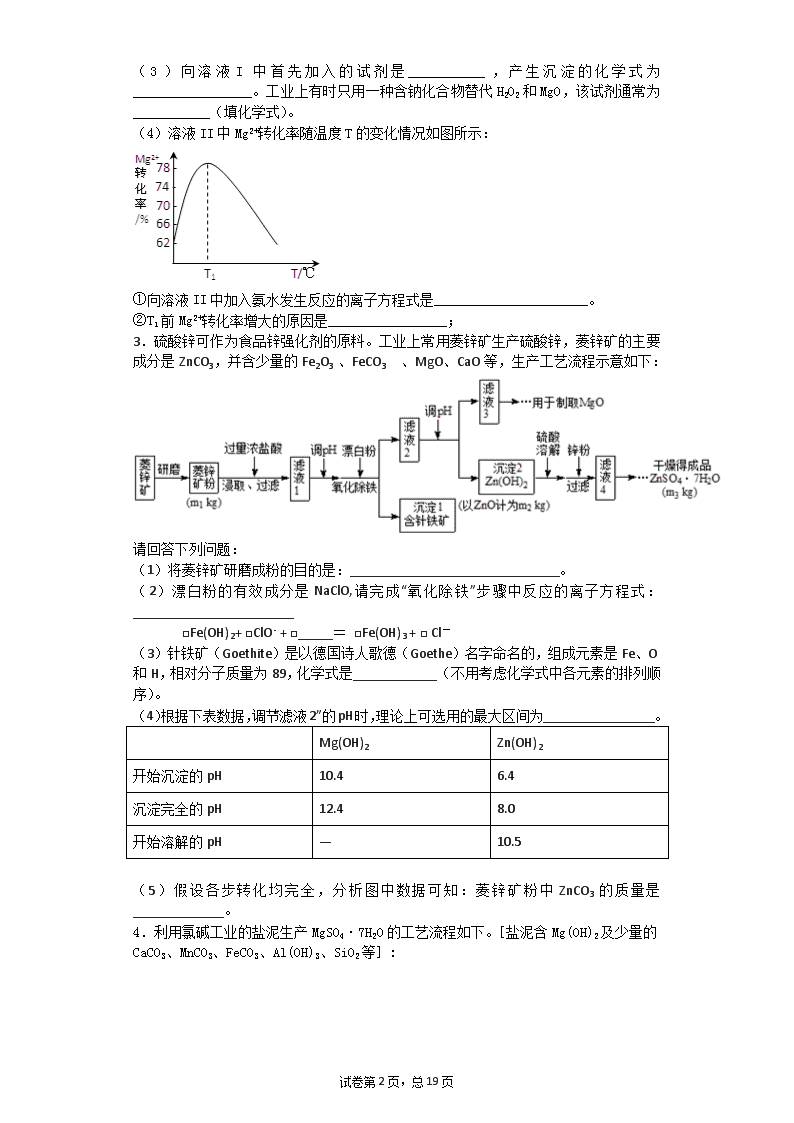
绝密★启用前 高考化学工艺流程专题训练 一、填空题 1.工业上制备BaCl2的工艺流程图如图: 某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得 BaSO4(s)+4C (s) 4CO(g) +BaS(s) △H1=+571kJ·mol-1① BaSO4 (s) +2C (s) 2CO2 (g) +BaS(s) △H=+226kJ·mol-1② (1)反应C(s) +CO2 (g) 2CO (g)的△H=_______kJ·mol-1。 (2)气体用过量NaOH溶液吸收,得到Na2S,在Na2S水溶液中c(Na+)与c (S-2)的关系是_______。(填字母) A.c(Na+ ) =2c(S2-) B.c(Na+) <2c(S2-) C.c(Na+) >2c(S2-) D.2c(Na+) >c(S2-) (3)向AgNO3溶液中加入BaCl2和KBr,当两种沉淀共存时,=___________。 [KSP (AgBr) =5.4×l0-13, Ksp (AgCl) =2.0×10-10] (4)常温常压下,空气中的CO2溶于水达到平衡时,溶液的pH=5.6,溶液c(H2CO3) =1.5×10-5mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3H2CO3-+H+的平衡常数K1=_______。(保留两位有效数字)(已知:10-5.60=2.5× 10-6) 2.高纯度氢氧化镁广泛应用于医药、电力等领域。镁硅酸盐矿石可用于生产氢氧化镁,简要工艺流程如图所示: 已知:①溶液I中除含Mg2+、SO42-外,还含少量Fe3+、Al3+、Fe2+等离子; ②Mg2+与氨水的反应为吸热反应。请回答下列问题: (1)Mg在元素周期表中的位置为__________________。 (2)H2O2的电子式为________。溶液I中加入H2O2溶液发生反应的离子方程式是__________。 试卷第19页,总19页 (3)向溶液I中首先加入的试剂是___________,产生沉淀的化学式为_________________。工业上有时只用一种含钠化合物替代H2O2和MgO,该试剂通常为___________(填化学式)。 (4)溶液II中Mg2+转化率随温度T的变化情况如图所示: ①向溶液II中加入氨水发生反应的离子方程式是______________________。 ②T1前Mg2+转化率增大的原因是_________________; 3.硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 、MgO、CaO等,生产工艺流程示意如下: 请回答下列问题: (1)将菱锌矿研磨成粉的目的是:______________________________。 (2)漂白粉的有效成分是NaClO,请完成“氧化除铁”步骤中反应的离子方程式:_______________________ □Fe(OH)2+ □ClO- + □_____= □Fe(OH)3 + □ Cl- (3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,相对分子质量为89,化学式是____________(不用考虑化学式中各元素的排列顺序)。 (4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为________________。 Mg(OH)2 Zn(OH)2 开始沉淀的pH 10.4 6.4 沉淀完全的pH 12.4 8.0 开始溶解的pH — 10.5 (5)假设各步转化均完全,分析图中数据可知:菱锌矿粉中ZnCO3的质量是_____________。 4.利用氯碱工业的盐泥生产MgSO4·7H2O的工艺流程如下。[盐泥含Mg(OH)2及少量的CaCO3、MnCO3、FeCO3、Al(OH)3、SiO2等]: 试卷第19页,总19页 (1)酸浸时,FeCO3与硫酸反应的化学方程式为____________;滤渣1的主要成分为CaSO4和________(填化学式);为了提高浸取率可采取的措施有___________(填序号)。 a.多次用废硫酸浸取 b.减小盐泥粒度并充分搅拌 c.延长浸取时间 (2)氧化时,次氯酸钠溶液(碱性条件)将MnSO4氧化为MnO2的离子方程式为________;滤渣2为MnO2和_____________、________(填化学式)。 (3)镁的碳化物常见的有MgC2和Mg2C3 两种,分别可发生水解反应生成乙炔和丙二烯,MgC2的电子式为___________;丙二烯的结构简式为___________。 (4)一种碱式碳酸镁[4MgCO3·Mg(OH)2·5H2O]可用作防火保温材料,用化学方程式说明可作防火材料的原理:_______________。 5.碳酸钡是一种重要的无机盐产品,广泛应用于工业陶瓷、光学玻璃、建筑等行业。碳化法生产碳酸钡的工艺流程示意图如下: 已知:重晶石的主要成分是BaSO4;Ba(HS)2溶液呈弱碱性;2BaS+2H2O=Ba(OH)2+Ba(HS)2。 回答下列问题: (1)煅烧时发生反应的化学方程式为 ,该反应的氧化产物的电子式为 ;当温度过高时,尾气中有毒气体的含量会升高,原因是 (用化学方程式表示)。 (2)为了提高浸取速率,可采取的措施是 (任写一种)。 (3)碳化时发生反应的离子方程式为 。 (4)脱硫过程是用Na2CO3溶液将BaCO3浆液中含有的BaS2O3除去:CO32-+BaS2O3=BaCO3+S2O32-,该反应的平衡常数为 【已知Ksp(BaCO3)=2.5×10-9,Ksp(BaS2O3)=1.6×10-5】。 (5)Ba(HS)2溶液中离子浓度由大到小的顺序为 。 (6)BaCO3不能用于医疗用的“钡餐”,原因是 。 6.近年来,高锰酸钾在饮用水和工业污水处理领域的消费需求增长较快。实验室可用二氧化锰为主要原料制备高锰酸钾。其部分流程如下: (1)第①步中采用铁坩埚而不用瓷坩埚的原因是(用化学方程式表示)________________________________________。 (2)KOH、KClO3和MnO2共熔反应生成墨绿色K2MnO4的化学方程式为________________________________________。 (3)第④步通入CO2可以使MnO42—发生反应,生成MnO4—和MnO2。则K2MnO4 试卷第19页,总19页 完全反应时,转化为KMnO4的百分率约为________(精确到0.1%)。 (4)第⑤步趁热过滤的目的是______________________________________。 (5)第⑥步加热浓缩至液面有细小晶体析出时,停止加热,冷却结晶、________、洗涤、干燥。干燥过程中,温度不宜过高,因为____________________________________。 7.工业上以钛铁矿为原料制备二氧化钛的工艺流程如下图所示。钛铁矿的主要成分为钛酸亚铁(FeTiO3),其中一部分铁元素在风化过程中会转化为+3价。 已知:TiOSO4遇水会水解。 (1)步骤②中,用铁粉将Fe3+转化为Fe2+的离子方程式为_______________________ (2)步骤③中,实现混合物的分离是利用物质的________(填字母序号)。 a.熔、沸点差异 b.溶解性差异 c.氧化性、还原性差异 (3)步骤②、③、④中,均需要进行的操作是________(填操作名称)。 (4)请结合化学用语用化学平衡理论解释步骤④中将TiO2+转化为H2TiO3的原理: ____________________________________________________________。 (5)利用生产过程中的废液与软锰矿(主要成分为MnO2)反应可生产硫酸锰(MnSO4,易溶于水),该反应的离子方程式为__________________________________ (6)研究发现,用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置可获得金属钙,并可以钙为还原剂,还原二氧化钛制备金属钛。 写出阳极的电极反应式:_________________________ 在制备金属钛前后,CaO的总量不变,其原因是______________________________________(请结合化学用语解释)。 8.工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42—等杂质,提纯工艺流程如下: Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示: 试卷第19页,总19页 Ⅱ.有关物质的溶度积如下: 物质 CaCO3 MgCO3 Ca(OH)2 Mg(OH)2 Fe(OH)3 Ksp 4.96×10-9 6.82×10-6 4.68×10-6 5.61×10-12 2.64×10-39 回答下列问题: (1)加入NaOH溶液后过滤得到的滤渣中主要含有________(填写化学式)。25℃时,向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8 时,c(Mg2+)∶c(Fe3+)=________。 (2)操作X为________,其温度应控制在_____________________________________ (3)有人从“绿色化学”角度设想将“母液”沿流程中虚线所示进行循环使用。请你分析实际工业生产中是否可行________,并说明理由______________________________ ________________________________________________________________________。 9.氧化铜矿石含有CuO和难溶于水的Cu2(OH) 2CO3,还含有Fe2O3、FeO和SiO2等。铜、铁是畜禽所必需的微量元素。某厂生产硫酸铜和硫酸亚铁流程如下: (1)氧化铜矿石粉碎的目的是 ,KMnO4的作用是将Fe2+氧化成Fe3+。 (2)写出“酸浸”中Cu2(OH) 2CO3发生反应的离子方程式 。 (3)“中和/过滤”中加入CaCO3的目的是 ,使Fe3+ 水解成沉淀而除去。 (4)流程中多处涉及“过滤”,实验室中过滤需要使用的玻璃仪器有烧杯、 。 (5)加入铁屑的作用是使母液中Fe3+转化为Fe2+、 。 (6)下表为硫酸铜晶体“烘干粉碎”的试验结果。 表中m为CuSO4·5H2O晶体的质量,x为干燥后所得晶体中结晶水个数。据此可确定由CuSO4·5H2O脱水得流程所示产品的适宜工艺条件为 (指出条件的温度和时间)。 10.醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下: 相关离子生成氢氧化物的pH和相关物质的溶解性如下表: 试卷第19页,总19页 (1)调节pH步骤中,溶液pH的调节范围是____________。 (2)滤渣1和滤渣3主要成分的化学式分别是____________、_____________。 (3)酸浸过程中,lmol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式_____________________________。 (4)沉镍前c(Ni2+)=2.0 mol· L-1,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5mol·L-1],则需要加入Na2CO3固体的质量最少为______g。(保留小数点后1位) 11.化工生产中常利用硫酸厂煅烧黄铁矿石的烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)来制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),流程如 下: (1)将过程②中产生的气体通入下列溶液中,溶液会褪色的是________(填选项序号)。 a.品红溶液 b.紫色石蕊溶液 c.酸性KMnO4溶液 d.溴水 (2)过程①中,FeS和O2、H2SO4反应的离子方程式为______________________ (3)过程③中,需加入的物质是____________;反应的化学方程式为_____________________ 用溶液Y制绿矾时,可取少量Y溶液于试管中,向试管内加入少量的________________溶液,观察溶液是否变为________色,以验证其中是否含有Fe3+。 (4)在实验室里,完成过程④中的____________(填操作名称),需要使用酒精灯、三脚架、坩埚钳等,还需要的玻璃仪器有___________________________。 (5)过程⑥中,将溶液Z加热到70~80℃,目的是____________________________________________________。 (6)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验:①用分析天平称取2.700 g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥、称量,得固体质量为3.495 g。若该聚铁的主要成分为[Fe(OH)SO4]n,则聚铁样品中铁元素的质量分数为________。(假设杂质中不含铁元素和硫元素) 12.利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下。 试卷第19页,总19页 其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。 (1)实验室用18.4 mol·L-1的浓硫酸配制250 mL 4.8 mol·L-1的H2SO4溶液,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需_______________________ _。 (2)酸浸时,为了提高浸取率可采取的措施有_____________________________ ______________________________________________________(答出两点)。 (3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72—,写出此反应的离子方程式:_____________________________________________________________。 (4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下: 阳离子 Fe3+ Mg2+ Al3+ Cr3+ 开始沉淀时的pH 2.7 - - - 沉淀完全时的pH 3.7 11.1 8 9(>9溶解) 加入NaOH溶液使溶液呈碱性,Cr2O72—转化为CrO42—。滤液Ⅱ中阳离子主要有________;但溶液的pH不能超过8,其理由是_________________________。 (5)钠离子交换树脂的反应原理为Mn++nNaR―→MRn+nNa+,利用钠离子交换树脂除去的滤液Ⅱ中的金属阳离子是_______________________________。 (6)写出上述流程中用SO2进行还原时发生反应的化学方程式:__________________________________________________。 二、实验题 13.氧化铜矿石含有CuO和Cu2(OH) 2CO3,还含有Fe2O3、FeO和SiO2等。铜、铁是畜禽所必需的微量元素。某饲料厂联合生产硫酸铜和硫酸亚铁工艺流程如下: (1)氧化铜矿石粉碎的目的是 。氧化时加入的KMnO4的作用是 。 (2)写出“酸浸”中Cu2(OH) 2CO3发生反应的离子方程式 。 (3)“中和/过滤”中加入CuCO3的目的是 。 (4)流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有烧杯、 。 (5)加入铁屑的作用是 、 。 (6)下表和图为“烘干粉碎”的试验结果。 试卷第19页,总19页 表2中,m为CuSO4·5H2O晶体的质量,x为干燥后所得晶体中结晶水的个数。据此可确定由CuSO4·5H2O和FeSO4·7H2O脱水得流程中所示产品的适宜工艺条件分别为 , (分别指出两条件的温度和时间)。 14.锌焙砂是锌精矿经焙烧后所得的产物,主要含ZnO、ZnSO4,有少量FeO、CuO、NiO杂质,是炼锌最主要的原料。某科研小组设计了如下提取金属锌的实验流程: (1)酸浸时需要240 mL 4 mol·L-1 稀H2SO4,用18.4 mol·L-1 浓硫酸配制该稀H2SO4过程 中用到的玻璃仪器除烧杯、量筒、胶头滴管外,还要 、 ;酸浸得到的溶液中除Zn2+、Ni2+外,还含有的金属阳离子是 、 (填离子符号)。 (2)净化Ⅰ需要加入H2O2,加入H2O2时发生的离子反应方程式是 ;反应后控制溶液pH为4即沉淀完全,沉淀的主要成分是 。 (3)净化Ⅱ得到的Cu、Ni,需要进行洗涤操作,检验是否洗涤干净的方法是 ;本流程中可以循环利用的物质除锌外还有 、 。 (4)可用电解沉积硫酸锌溶液的方法制备锌,若在在阳极产生13.44L(标准状况下) 氧气,在阴极析出锌的质量为 。 (5)上述工艺中,如果不设计 “净化Ⅱ”,对提取金属锌造成的影响是____________________。 15.硫酸厂的烧渣主要成分是Fe2O3,其次含少量的SiO2和FeS。工业上利用硫酸厂烧渣经回收处理制得绿矾(FeSO4·7H2O)和一种聚铁胶体[Fe(OH)SO4]n。绿矾是治疗缺铁性贫血药品的重要成分,而聚铁胶体是重要的水处理剂。上述生产工艺流程如下: 试卷第19页,总19页 请通过分析回答下列相关问题: (1)灼烧产生的尾气对大气有污染,因此工业生产中必须进行回收处理,下列方法可行的是_______________: A.用氨水吸收 B. 直接用水吸收 C. 用浓硫酸吸收 D. 与空气混合用石灰石粉末悬浊液吸收 (2)操作Ⅲ是_____________、_______________、过滤、洗涤、干燥保存等; (3)在由溶液X制聚铁胶体过程中①调节pH及②控制温度目的是___________________。 (4)在反应釜中FeS、O2及稀H2SO4反应硫酸铁等物质,则反应的离子方程式为___________________________; (5)某研究性小组为探究绿矾(相对分子质量:278)在隔绝空气条件下加热分解反应的产物(已知分解产物全为氧化物),进行了如图所示的实验: ① 实验开始时,在点燃C处酒精喷灯之前应先打开活塞通CO2,其目的是_____________。 装置D的作用是______________________。 ②该组同学设计的装置存在着一个明显的缺陷是____________________________。 ③该组同学称取55.6 g绿矾按上图装置进行实验。待绿矾分解完全后,E瓶中产生了23.3 g白色沉淀。将C中固体产物投入足量稀硫酸中完全溶解得到溶液,取少量该溶液滴入KSCN溶液呈红色;另取少量该溶液滴入酸性KMnO4溶液,KMnO4溶液不褪色。据写出绿矾分解的化学方程式为__________________________。 16.用软锰矿(MnO2)、黄铁矿(FeS2)酸浸生产硫酸锰(MnSO4),并进一步电解制取二氧化锰(EMD)的工艺流程如下: I. 将软锰矿、黄铁矿和硫酸按一定比例放入反应釜中,搅拌,加热保温反应一定时间。 II. 向反应釜中加入MnO2、CaCO3试剂,再加入Na2S溶液除掉浸出液中的重金属。 III. 过滤,向滤液中加入净化剂进一步净化,再过滤,得到精制MnSO4溶液。 IV. 将精制MnSO4溶液送入电解槽,电解制得EMD。 请回答下列问题: (1)步骤I中搅拌、加热的目的是 。完成酸浸过程中反应的离子方程式: (2) 加入CaCO3将浸出液pH调至pH=5,从而除掉铁,请解释用CaCO3除铁的原理: 。(结合离子方程式解释) (3)步骤IV中用如图所示的电解装置电解精制的MnSO4溶液,生成EMD的是 试卷第19页,总19页 极(填“a”或“b”),生成EMD的电极反应式是 。 (4)EMD可用作碱性锌锰电池的材料。已知碱性锌锰电池的反应式为:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2。 下列关于碱性锌锰电池的说法正确的是 (填字母序号)。[来源 A.碱性锌锰电池是二次电池 B.碱性锌锰电池将化学能转化为电能 C.正极反应为:2MnO2+2H2O+2e-=2MnOOH+2OH- D.碱性锌锰电池工作时,电子由MnO2经外电路流向Zn极 17.用铝土矿(含30% SiO2、40.8% Al2O3和少量Fe2O3等)制取铝硅合金材料有湿法、干法等方法,其中干法制备的工艺流程如下: (1)若湿法处理铝土矿,用强酸浸取时,所得溶液中阳离子有 。 (2)焙烧除铁反应:4(NH4)2SO4 + Fe2O3 2NH4Fe(SO4)2 + 3H2O + 6NH3↑(Al2O3部分发生类似反应)。氧化物转化为硫酸盐的百分率与温度的关系如图,最适宜焙烧温度为 ,用电子式表示气体I的形成过程 。 (3)操作①包括:加水溶解、 。 (4)用焦炭还原SiO2、Al2O3会产生中间体SiC、Al4C3。写一个高温下中间体与Al2O3反应生成铝单质的化学方程式 。 (5)铝硅合金材料中若含铁,会影响其抗腐蚀性。原因是 。 (6)不计损失,投入1t铝土矿,当加入54kg纯铝后,铝硅合金中m:n = 。 18.氧化铜矿石含有CuO和Cu2(OH) 2CO3,还含有Fe2O3、FeO和SiO2等。铜、铁是畜禽所必需的微量元素。某厂生产硫酸铜和硫酸亚铁流程如下: (1)氧化铜矿石粉碎的目的是 。氧化时加入的KMnO4的作用是 。 (2)写出“酸浸”中Cu2(OH) 2CO3发生反应的化学方程式 。 (3)“中和/过滤”中加入CaCO3的目的是 。 (4)流程中多处涉及“过滤”,实验室中过滤需要使用的玻璃仪器有烧杯、 。 试卷第19页,总19页 (5)加入铁屑的作用是 、 。 (6)下表为硫酸铜晶体“烘干粉碎”的试验结果。 表中m为CuSO4·5H2O晶体的质量,x为干燥后所得晶体中结晶水个数。据此可确定由CuSO4·5H2O脱水得流程所示产品适宜工艺条件分别为 (指出条件的温度和时间)。 19.CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如图: 已知: ①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑ ②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110 ~120℃时,失去结晶水变成有毒的无水氯化钴。 ③物质的熔沸点随压强降低而降低 ④乙醚沸点为 34.6℃ ⑤部分阳离子以氢氧化物形式沉淀时溶液的pH见下表: 沉淀物 Fe(OH)3 Fe(OH)2 Co(OH)2 Al(OH)3 开始沉淀 2.3 7.5 7.6 3.4 完全沉淀 4.1 9.7 9.2 5.2 (1)在上述工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,从环保角度分析其主要优点为_______________________。 (2)加入碳酸钠调节pH至a ,a的范围是____________________________。 (3)操作Ⅰ包含3个实验基本操作,它们依次是_____________、______________和过滤。 (4)制得的CoCl2·6H2O在烘干时需减压烘干的原因是____________________________。 (5)在实验室,为了从上述产品中获得纯净的CoCl2·6H2O,通常先将产品溶解在乙醚中,通过过滤除去不溶性杂质后,再进行_________(填操作名称)。 (6)为测定产品中CoCl2·6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量。通过计算发现产品中CoCl2·6H2O的质量分数大于100%,其原因可能是______________。(答出一个原因即可) 试卷第19页,总19页 20.聚合氯化铝晶体是介于 AlCl3和 Al(OH)3之间的一种水溶性无机高分子聚合物, 是一种高效无机水处理剂, 其制备原料主要是铝加工行业的废渣--铝灰,它主要含 Al2O3、 Al,还有一些不溶于酸的杂质.聚合氯化铝生产工艺流程如下: (1)反应中副产品E是_________(用化学式表示); (2)生产过程中可循环使用的物质是_________(用化学式表示); (3)为使得到的晶体较纯净,生产过程中使pH升高的c 物质可选用_________(填编号); a. NaOH b. Al c.氨水 d. A12O3 e. NaAlO2 (4)聚合氯化铝晶体的化学式可表示为: [A12(OH)nCl6-n·xH2O]m,实验室为测定化学式中n的值,进行如下实验: ①称取 ag晶体,制成粉末,加热至质量不再变化时,得到bg氧化铝固体.此过程可能用到的下列仪器有___________;(填编号) a.蒸发皿 b.坩埚 c.研钵 d.试管 ②另取ag晶体,进行如下操作:用A 酸溶解→加足量AgNO3溶液→操作c →烘干→称量为c g 固体.试剂A为_______,操作C为_________(填操作名称).n=_________(用含a、b、c的代数式表示). 21.砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测。 (l)冶炼废水中砷元素主要以亚砷酸(H3 AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下: 已知:I .As2 S3与过量的S2一存在以下反应:As2S3(s)+3S2—(aq)2AsS33—(aq); II.亚砷酸盐的溶解性大于相应砷酸盐。 ①亚砷酸中砷元素的化合价为 ; ②砷酸的第一步电离方程式为 ; ③“一级沉砷”中FeSO4的作用是 ; ④“二级沉砷”中H2O2与含砷物质反应的化学方程式为 ; ⑤沉淀X为 (填化学式)。 (2)冶炼废渣中的砷元素主要以As2O3的形式存在,可用古氏试砷法半定量检测(As的最低检出限为3.0×10 -6g)。 步骤1:取10 g废渣样品,粉碎后与锌粉混合,加人H2 SO4共热,生成H3As气体。 步骤2:将H3As气体通人AgNO3溶液中,生成银镜和As2O3。 步骤3:取1g废渣样品,重复上述实验,未见银镜生成。 ①AsH3的电子式为 ; 试卷第19页,总19页 ②步骤2的离子方程式为 ; ③固体废弃物的排放标准中,砷元素不得高于4.0×10一5g·kg一1,请通过计算说明该排放的废渣中砷元素的含量 (填“符合”、“不符合”)排放标准,原因是 。 22.一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3•CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中.从废料中回收氧化钴(CoO)的工艺流程如下: (1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 . (2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴.则浸出钴的离子反应方程式为 (产物中只有一种酸根).请从反应原理分析不用盐酸浸出钴的主要原因 . (3)碳酸钠溶液在过程III和IV中所起作用有所不同,请分别用离子方程式表示在过程III、IV中起的作用: . 23.三氧化二锰(Mn2O3)在现代工业上位用广泛,在锂离子电池的制备中有重要的作用。 用软锰矿 (主要成分为MnO2)和硫锰矿(主要成分为MnS)制备高纯度Mn2O3的工艺流程如图所示。 (1) 反应①中会生成一种非金属单质,则该非金属单质是___________,该反应的还原剂是__________。(填化学式) (2) 操作X为蒸发浓缩、_____________、过滤、洗涤烘干。在洗涤操作中,常用酒精洗涤MnSO4 •H2O晶体,主要目的是______________。 (3) Mn2O3与MnO2类似,加热时也能与浓盐酸反应放出Cl2,该反应的离子方程式为__________。 24.二氧化铈(CeO2)是一种重要的稀土化合物。以氟碳铈矿(主要含CeFCO3)为原料制备 CeO2的一种工艺流程如下: 已知:①Ce4+能与F-结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+; ②在硫酸体系中Ce4+能被萃取剂[(HA)2 ]萃取,而Ce3+不能。 回答下列问题: (1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是_____________。 试卷第19页,总19页 (2)“酸浸”中会产生大量黄绿色气体,写出CeO2与盐酸反应的离子方程式:____________;为避免产生上述污染,请提出一种解决方案:_____________。 (3)“萃取”时存在反应:Ce4+ +n(HA)2Ce·(H2n-4A2n)+4H+。实验室中萃取时用到的主要玻璃仪器名称为____________;下图中D时分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比()。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:__________。 (4)“反萃取”中,在稀硫酸和H2O2的作用下CeO2转化为Ce3+。H2O2在该反应中作_________(填“催化剂”“氧化剂”或“还原剂”),每有1molH2O2参加反应,转移电子的物质的量为__________。 (5)“氧化”步骤的化学方程式为_____________。 (6)取上述流程中得到的CeO2产品0.4500 g,加硫酸溶解后,用0.1000mol/LFeSO4标准溶液滴定至终点时(铈被还原为Ce3+,其他杂质均不反应),消耗25.00 mL标准溶液。该产品中CeO2的质量分数为_________。 25.铬是一种银白色金属,化学性质稳定,以+2、+3和+6价为常见价态。工业上以铬铁矿(主要成分为FeO·Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产金属铬和重铬酸钠(Na2Cr2O7·2H2O),其主要工艺流程如下: 已知:①Na2Cr2O7是一种强氧化剂 ②常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42— ⑴工业上常采用热还原法制备金属铬,写出以Cr2O3为原料,利用铝热反应制取金属铬的化学方程式: ; ⑵酸化滤液D时,不选用盐酸的原因是 ; ⑶固体E的主要成分是Na2SO4,根据下图分析操作a为 ; 试卷第19页,总19页 ⑷已知含+6价铬的污水会污染环境。电镀厂产生的镀铜废水中往往含有一定量的Cr2O72—,处理该废水常用还原沉淀法,具体流程如下: ①Cr(OH)3的化学性质与Al(OH)3相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为 ; ②下列溶液中可以代替上述流程中Na2S2O3溶液的是 (填选项序号) A.FeSO4溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.Na2SO3溶液 ③上述流程中,每消耗0.1molNa2S2O3转移0.8mole—,则加入Na2S2O3溶液时发生反应的离子方程式为 ; ⑸根据有关国家标准,含CrO42—的废水要经化学处理,使其浓度降至5.0×10—7mol·L—1以下才能排放。用以下方法处理废水:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10—10],再加入可溶性硫酸盐处理多余的Ba2+。则加入可溶性钡盐后的废水中Ba2+的浓度应不小于 mol·L—1,废水处理后方能达到国家排放标准。 三、简答题 26.黄铜矿(CuFeS2)是冶炼铜及制备铁的氧化物的重要矿藏,常含有微量的金、银等。如图是以黄铜矿为主要原料生产铜、铁红(氧化铁)颜料的工艺流程图: (1)反应I的离子方程式为___________。 (2)CuCl难溶于水,但可与过量的Cl-反应生成溶于水的[CuCl2]-。该反应的离子方程式为___________。 (3)有大量Cl-存在时,Na2SO3可将CuCl2还原成[CuCl2]-。Na2SO3要缓慢滴加到溶液中的原因是___________。 (4)反应I——V五个反应中属于非氧化还原反应的是反应___________。 (5)已知Cu+在反应V中发生自身氧化还原反应,歧化为Cu2+和Cu,由w此可推知溶液A中的溶质为___________(填化学式)。 (6)含AsO43-的废水对环境造成严重污染,常用新制的氢氧化铁沉淀与之作用形成FeAsO4沉淀而除去,相同温度下溶解度:Fe(OH)3___________(填“<”“>”或“=”)FeAsO4。 (7)在酸性、有氧条件下,一种叫Thibacillus ferroxidans的细菌能将黄铜矿转化成硫酸盐,该过程中发生反应的离子方程式为___________。 27.目前全球范围内环境污染备受关注,化工生产中应大力倡导“绿色化学”和“原子经济”的理念,工业生产中的废物利用尤为重要。工业上生产高氯酸时,还同时生产了一种常见的重要含氯消毒剂和漂白剂亚氯酸钠(NaClO2),其工艺流程如下: 试卷第19页,总19页 已知:①NaHSO4溶解度随温度的升高而增大,适当条件下可结晶析出。②高氯酸是至今为止人们已知酸中的最强酸,沸点90 ℃。请回答下列问题: (1) 反应器Ⅰ中发生反应的化学方程式为_______,冷却的目的是____________。 (2) 反应器Ⅱ中发生反应的离子方程式为_____________。 (3) 通入反应器Ⅱ中的SO2用H2O2代替同样能生成NaClO2,请简要说明双氧水在反应中能代替SO2的原因是__________。 (4) Ca(ClO)2、ClO2、NaClO2等含氯化合物都是常用的消毒剂和漂白剂,是因为它们都具有___,请写出工业上用氯气和消石灰生产漂粉精的化学方程式:_______。 28.钛是一种重要的金属,以钛铁矿[主要成分为钛酸亚铁(FeTiO3),还含有少量Fe2O3]为原料制备钛的工艺流程如图所示: (1)钛铁矿与硫酸反应的化学方程式为___________________________。 (2)步骤Ⅰ中的“一系列操作”为_____________。 (3)步骤Ⅱ中发生反应的离子方程式为____________________;为提高TiO2·xH2O的产率,可采取的措施 有______(任写一种) (4)由TiO2获得金属Ti可用以下两种方法。 ①电解法:以石墨为阳极,TiO2为阴极,熔融CaO为电解质,其阴极的电极反应式为________。 ②热还原法:首先将TiO2、氯气和过量焦炭混合,高温反应生成TiCl4;然后用Mg还原TiCl4即可制取Ti。生成Ti的反应需在Ar气氛中,其原因为___________________________。 选做题,29和30题任选一题写在答题纸上,写清题号 29.高铁酸钾(K2FeO4)具有强氧化性,可作为水处理剂和高容量电池材料。工业上生产高铁酸钾的工艺流程如下: 已知K2FeO4具有下列性质:①可溶于水,微溶于KOH溶液,难溶于异丙醇;②在0℃-5℃,强碱性溶液中比较稳定;③在Fe3+和Fe(OH)3催化作用下发生分解;④在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2 请完成下列填空: (1)已知Cl2与KOH在低温下可制得KClO,请写出化学反应方程式_________________。 试卷第19页,总19页 (2)在“反应液Ⅰ”中加KOH固体的目的是_________________________________。 (3)生产K2FeO4的化学反应方程式为___________________________________________,制备K2FeO4时,须将Fe(NO3)3溶液缓慢滴加到碱性的KClO浓溶液中,并且不断搅拌,采用这种混合方式的原因是_________________________________________________。 (4)请补充完整由“反应液Ⅱ”得到K2FeO4晶体的实验步骤。(可选用的试剂:NaOH溶液、KOH溶液、蒸馏水和异丙醇) ① 向反应液Ⅱ中加入饱和________,在冰水浴中静置结晶后过滤,得K2FeO4粗产品; ② 将K2FeO4粗产品溶解在___________中,再次在冰水浴中静置结晶后过滤,得到较纯净的K2FeO4; ③ 将K2FeO4晶体再用少量__________洗涤,低温真空干燥,得到高铁酸钾成品。 (5)从“反应液Ⅱ”中分离出K2FeO4晶体后,可以得到的副产品有_________(写化学式)。 30.一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面,锂混杂于其中。从该废料中回收(CoO)的工艺流程如下: (1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为_______________。 (2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的化学反应方程式为(产物中只有一种酸根)__________。 (3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式________________________。 (4)碳酸钠溶液在过程III和IV中所起作用有所不同,请写出在过程IV中起的作用是______________________。 (5)在Na2CO3溶液中存在多种粒子,下列各粒子浓度关系正确的是______(填序号)。 A.c(Na+) = 2c(CO32-) B.c(Na+)>c(CO32-)> c(HCO3-) C.c(OH-)>c(HCO3-)>c(H+) D.c(OH-)-c(H+)=c(HCO3-) + 2c(H2CO3) 31.工业上“中温焙烧——钠化氧化法”回收电镀污泥中的铬已获技术上的突破。其工艺流程如下: 【查阅资料】 ①电镀污泥中含有Cr(OH)3、Al203、ZnO、CuO、NiO等物质;水浸后溶液中含有Na2CrO4、NaAlO2、Na2ZnO2等物质; ②Na2CrO4转化成Na2Cr2O7离子反应方程式为:2 CrO42-+2H+=Cr2O72-+H2O;③Na2SO4、Na2Cr2O7、Na2CrO4在不同温度下的溶解度如下表: 试卷第19页,总19页 请回答: (1)操作①的名称是_______,“水浸”后的溶液呈_______性; (2)“焙烧氧化”过程中Cr(OH)3转化成Na2CrO4的化学方程式为___________; (3)滤渣II的主要成分有Zn(OH)2和X,生成X的离子反应方程式__________; (4)“酸化浓缩”时,需继续加入H2SO4,然后_______、结晶、过滤。继续加入H2SO4目的是__________; (5)以铬酸钠为原料,电化学法制备重铬酸钠的实验装置如图所示。 ①阴极发生的电极反应式为:_____________; ②若测定阳极液中Na与Cr的物质的量之比值为d,则此时铬酸钠的转化率为___________。 32.锶(Sr)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与 Ca 和Ba同属于同族。 (1)Sr 的原子序数是 ,碱性:Sr(OH)2 Ba(OH)2(填“>”或“<”);锶的化学性质与钙和钡类似,用原子结构的观点解释其原因是 。 (2)碳酸锶是最重要的锶化合物。用含SrSO4和少量BaSO4、BaCO3、FeO、Fe2O3、Al2O3、SiO2的天青石制备SrCO3,工艺流程如下(部分操作和条件略): I.将天青石矿粉和Na2CO3溶液充分混合,过滤; II.将滤渣溶于盐酸,过滤; III.向Ⅱ所得滤液中加入浓硫酸,过滤; IV.向Ⅲ所得滤液中先加入次氯酸,充分反应后再用氨水调pH约为7,过滤; V.向Ⅳ所得滤液中加入稍过量NH4HCO3,充分反应后,过滤,将沉淀洗净,烘干,得到SrCO3。 已知:i.相同温度时的Ksp :BaSO4<SrCO3<SrSO4<CaSO4 ii.生成氢氧化物沉淀的pH 已知氢氧化亚铁的溶度积为1×10—15则Fe2+完全沉淀的pH值为 (完全沉淀时Fe2+的浓度小于1×10—5) ①I中,反应的化学方程式是 。 ②II中,能与盐酸反应溶解的物质有 。 ③加入次氯酸的有关离子方程式为 ;IV加入氨水的目的是 。 ④下列关于该工艺流程的说法正确的是 。 a.该工艺产生的废液含较多的Na+ 、Cl- 、SO42- 试卷第19页,总19页 b.V中反应时,升高温度一定可以提高SrCO3的生成速率 c.V中反应时,加入NaOH溶液一定可以提高NH4HCO3的利用率 33.工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下: 已知: 物质 SiCl4 AlCl3 FeCl3 FeCl2 沸点/℃ 57.6 180(升华) 300(升华) 1023 (1)步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多,其作用是_________________(只要求写出一种)。 (2)步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是________________。 (3)结合流程及相关数据分析,步骤V中加入铝粉的目的是________________。 (4)称取含Fe2O3和Al2O3的试样0.2000g,将其溶解在pH=2.0的热溶液中(50℃左右),以磺基水杨酸为指示剂,用0.02000 mol/L EDTA标准溶液滴定试样中的Fe3+,用去18.00 mL。然后将试液调至pH=3.5,加入上述EDTA标准溶液25.00 mL,并加热煮沸,使Al3+与EDTA完全反应,再调试液pH=4.5,以PAN(1-(2-吡啶偶氨)-2-萘酚)为指示剂,趁热用CuSO4标准溶液(每毫升含CuSO4·5H2O 0.005000g)返滴定,用去8.00 mL。计算试样中Fe2O3和Al2O3的质量分数。________________(写出计算过程) (已知:EDTA与Fe3+、Al3+、Cu2+均按物质的量之比1∶1进行反应) 试卷第19页,总19页 本卷由系统自动生成,请仔细校对后使用,答案仅供参考。 参考答案 1.【答题空1】+172.5【答题空2】CD【答题空3】2.7×10-3【答题空4】4. 17×10-7 【来源】【全国百强校word】河北省武邑中学2016-2017学年高二下学期开学考试化学试题 2.(1)第三周期IIA族(2分) (2)(2分);2Fe2++H2O2+2H+=2Fe3++2H2O(2分) (3)H2O2(1分);Fe(OH)3、Al(OH)3(2分);Na2O2(或NaClO)(1分) (4)①Mg2++2NH3·H2OMg(OH)2+2NH4+(2分,写成Mg2++2NH3·H2O=Mg(OH)2↓+2NH4+ 亦可)②镁离子与氨水的反应是吸热反应,温度升高,平衡正向移动(2分) 【来源】2017届广东省韶关市高三上高考调研理综化学试卷(带解析) 3.增大反应物接触面积(或增大反应速率或使反应更充分)2Fe(OH)2 + ClO- + H2O = 2Fe(OH)3 + Cl-FeO(OH)8.0≤pH<10.4125m2/81 【来源】【全国百强校】广东省广州市执信中学2016-2017学年高一上学期期期末考试化学试题 4.(1)FeCO3+H2SO4=FeSO4+CO2+H2O(2分);SiO2(2分);abc(2分); (2)Mn2++2OH-+ClO-=MnO2↓+Cl-+H2O(2分);Fe(OH)3(1分);Al(OH)3(1分); (3)CH2=C=CH2(1分) (4)4MgCO3·Mg(OH)2·5H2O5MgO+4CO2↑+6H2O 【来源】【百强校】2017届河北省武邑中学高三上第五次调研化学卷(带解析) 5.(13分)(1)BaSO4+2CBaS+2CO2↑;(2分) (1分);CO2+C2CO;(2分) (2)适当提高温度(或搅拌等);(1分) (3)CO2+H2O+Ba2++2HS-=BaCO3↓+2H2S↑;(2分) (4)6.4×103;(2分) (5)c(HS-)>c(Ba2+)>c(OH-)>c(H+)>c(S2-);(2分) (6)BaCO3 与胃酸中的盐酸反应生成可溶性的重金属盐BaCl2,会使人中毒;(1分) 【来源】2016-2017学年江西省南昌市八一中学等五校高二上联考二化学试卷(带解析) 6.(1)SiO2+2KOH=K2SiO3+H2O (2)6KOH+KClO3+3MnO2KCl+3K2MnO4+3H2O (3)66.7 % (4)减少过滤时的损耗(或防止降温过程中KMnO4析出而损耗) (5)过滤 温度过高KMnO4会分解 【来源】2014届高考化学二轮冲刺非选择题增分专练 化学工艺流程练习卷(带解析) 7.(1)2Fe3++Fe===3Fe2+ (2)b (3)过滤 (4)溶液中存在平衡:TiO2++2H2OH2TiO3+2H+,当加入热水稀释、升温后,平衡正向移动,生成H2TiO3 (5)MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O (6)①2O2--4e-=O2↑(或C+2O2--4e-=CO2↑) ②制备Ti时,发生反应:2CaO2Ca+O2↑,2Ca+TiO2Ti+2CaO,由此可见,CaO的总量不变(或制备Ti时,阴极发生反应;2Ca2++4e-===2Ca,阳极发生反应:2O2--4e-===O2↑,2Ca+TiO2Ti+2CaO,由此可见,CaO 答案第5页,总5页 本卷由系统自动生成,请仔细校对后使用,答案仅供参考。 的总量不变) 【来源】2014届高考化学二轮冲刺非选择题增分专练 化学工艺流程练习卷(带解析) 8.(1)Fe(OH)3、Mg(OH)2、CaCO3(前两个必填) 2.125×1021 (2)趁热过滤 36℃以上 (3)不可行 若“母液”循环使用,则溶液中c(Cl-)和c(SO42—)增大,最后所得产物Na2CO3中混有杂质 【来源】2014届高考化学二轮冲刺非选择题增分专练 化学工艺流程练习卷(带解析) 9.(1)增大接触面积 (或加快化学反应速率);使Fe2+转化为Fe3+; (2)Cu2(OH) 2CO3+H2SO4=2CuSO4+3H2O+CO2↑; (3)适当降低溶液的酸性,使Fe3+水解成沉淀而除出; (4)玻璃棒、漏斗; (5)使母液中Fe3+转化为Fe2+, 除去Cu2+,提高硫酸亚铁晶体的纯度; (6)160℃、3h。 【来源】2016-2017学年广东省惠州市高一上学期期末化学试卷(带解析) 10.5.0~6.7SiO2、CaSO4CaF2NiS+2HNO3+H2SO4=NiSO4+SO2↑+2NO↑+2H2O31.4 【来源】【全国百强校word】安徽省六安市第一中学2016-2017学年高二下学期开学考试化学试题 11.(1)acd (2)4FeS+3O2+12H+=4Fe3++6H2O+4S (3)Fe(或铁) Fe2(SO4)3+Fe=3FeSO4 硫氰化钾(或其他合理答案) 红 (4)蒸发结晶 蒸发皿、玻璃棒 (5)促进Fe3+的水解 (6)31.1 % 【来源】2014届高考化学二轮冲刺非选择题增分专练 化学工艺流程练习卷(带解析) 12. (1)250 mL容量瓶、胶头滴管 (2)升高反应温度、增大固体颗粒的表面积、加快搅拌速度等(答两点即可) (3)2Cr3++3H2O2+H2O===Cr2O72—+8H+ (4)Na+、Mg2+、Ca2+ pH超过8会使部分Al(OH)3溶解生成AlO2—,最终影响Cr(Ⅲ)的回收与再利用 (5)Ca2+、Mg2+ (6)3SO2+2Na2CrO4+12H2O===2CrOH(H2O)5SO4↓+Na2SO4+2NaOH 【来源】2014年化学高考题型专练十七 化学工艺流程题练习卷(带解析) 13.(1)增大接触面积,加快化学反应速率; (2)Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑; (3)适当降低溶液的酸性,使Fe3+水解成沉淀而除出; (4)玻璃棒、普通漏斗(2分,或漏斗); (5)使母液中Fe3+转化为Fe2+、除去Cu2+,提高硫酸亚铁晶体的纯度; (6)160℃、3h;125(±5)℃、4.0h。 【来源】2017届广东省惠州市高三上第三次调研化学试卷(带解析) 14.(1)250 mL容量瓶、玻璃棒;Cu2+、Fe2+ (2)H2O2+2Fe2++2H+=2Fe3++2H2O(2分);Fe(OH)3(1分) (3)取最后洗涤液少量,滴加BaCl2,若无白色沉淀,则洗干净(2分); H2SO4、ZnSO4(各1分,共2分) (4)78g(2分)(5)最终得到的产品中含Cu、Ni杂质(2分) 【来源】2017届福建省柘荣一中、宁德高级中学高三上联考二化学卷(带解析) 15.(1)AD;(2)蒸发浓缩,冷却结晶; (3)促使Fe3+充分水解并形成聚铁胶体; 答案第5页,总5页 本卷由系统自动生成,请仔细校对后使用,答案仅供参考。 (4)4FeS+3O2+12H+=4Fe3++4S↓+6H2O; (5)①排尽装置内的空气;防倒吸(或作安全瓶); ②没有尾气处理装置;③2(FeSO4·7H2O)Fe2O3+SO2↑+SO3↑+14H2O。 【来源】2017届湖南省怀化市高三上学期期中质检化学试卷(带解析) 16.(1)加快反应速率,充分接触 (2分) FeS2+4MnO2+8H+=4Mn2++Fe2++S+SO42-+4H2O(2分) (2)Fe3++3H2OFe(OH)3+3H+,加入CaCO3后,由于CaCO3+2H+=Ca2++CO2↑+H2O,使得Fe3+的水解平衡向正反应方向移动,Fe3+转化为Fe(OH)3沉淀而被除去。(写出一个离子方程式给1分,两个离子方程式2分,文字表述1分,共3分) (3)b(2分)Mn2++2H2O-2e-=MnO2+4H+(3分) (4)BC(2分)(漏选给1分,有错选不给分) 【来源】【百强校】2017届贵州省遵义航天中学高三模拟四化学卷(带解析) 17.(1)Al3+、Fe3+、H+;(2)300℃,; (3)过滤;(4)Al4C3+Al2O3=6Al+3CO↑或3SiC+Al2O3=3Si+2Al+3CO↑; (5)铁与铝形成原电池,加快了铝的腐蚀;(6)2:1。 【来源】【百强校】2017届安徽马鞍山二中安师大附中高三12月联考化学卷(带解析) 18.(1)增大接触面积 (或加快化学反应速率);使Fe2+转化为Fe3+; (2)Cu2(OH) 2CO3+H2SO4=2CuSO4+3H2O+CO2↑; (3)适当降低溶液的酸性,使Fe3+水解成沉淀而除出; (4)玻璃棒、漏斗; (5)使母液中Fe3+转化为Fe2+, 除去Cu2+,提高硫酸亚铁晶体的纯度;(6)160℃、3h。 【来源】2016-2017学年广东省惠州市高二上学期高二质量检测化学试卷(带解析) 19.(1)减少氮氧化物的排放,防止大气污染;(2)5.2~7.6;(3)蒸发浓缩、冷却结晶;(4)降低烘干温度,防止产品分解,变成有毒的无水氯化钴;(5)蒸馏;(6)样品中含有NaCl杂质(或烘干时失去了部分结晶水) 【来源】2017届广东省佛山一中高三上第二次段考化学试卷(带解析) 20.(1)H2(1分)(2)HCl(1分) (3)b、d(写全写对才给2分) (4)①b、c(写全写对才给2分) ②硝酸;过滤、洗涤; 【来源】2016-2017学年湖南省株洲长鸿实验学校等三校高一12月联考化学卷(带解析) 21.(1)①+3;②H3AsO4H++H2AsO4—; ③沉淀过量的S2—,使As2S3(s)+3S2—(aq)2AsS33—(aq)平衡左移,提高沉砷效果; ④H3AsO3+H2O2=H3AsO4+H2O;⑤CaSO4; (2)①; ②12Ag++2H3As+3H2O==12Ag↓+As2O3+12H+; 答案第5页,总5页 本卷由系统自动生成,请仔细校对后使用,答案仅供参考。 ③不符合,因为该废渣砷含量为(3.0×10-6g÷10g)×1000g/kg=3.0×10—4g/kg大于排入标准4.0×10一5g·kg一1。 【来源】2017届广东省肇庆市高三上学期二模化学试卷(带解析) 22. (1)2Al+2OH﹣+2H2O=+2AlO2﹣+3H2↑; (2)4Co2O3•CoO+S2O32﹣+22H+=12Co2++2SO42﹣+11H2O;Co2O3•CoO;可氧化盐酸产生Cl2污染环境; (3)2Al3++3CO32﹣+3H2O=2Al(OH)3↓+3CO2↑;Co2++CO32﹣=CoCO3↓; 【来源】【百强校】2017届湖南省衡阳市第八中学高三上质检二化学卷(带解析) 23.(1)S;MnS (2)冷却结晶;MnSO4•H2O在酒精中溶液度小,可减少MnSO4•H2O的损失 (3)Mn2O3+6H++2Cl-=2Mn2++Cl2↑+3H2O 【来源】2016-2017学年山西省临汾一中等三校高二上第二次联考化学试卷(带解析) 24.(1)增大固体与气体的接触面积,增大反应速率;提高原料的利用率。(2分) (2)2CeO2+2C1-+8H+=2Ce3++Cl2↑+4H2O;(2分)将HC1(盐酸)改用H2SO4酸浸(1分) (3)分液漏斗(1分)随着c(SO42-)增大,水层中Ce4+被SO42-结合成[CeSO4]2+,导致萃取平衡向生牛成[CeSO4]2+移动,D迅速减小,(2分)(4)还原剂(1分);2mol(1分); (5)2C(OH)3+NaClO+H2O=2Ce(OH)4+NaCl(2分)(6)95.56%(2分) 【来源】【百强校】2017届河北省衡水中学高三上五调考试化学卷(带解析) 25.(1)Cr2O3+2AlAl2O3+2Cr (2)盐酸中的Cl-会被氧化,产生Cl2 (3)蒸发结晶、趁热过滤 (4)①pH过高Cr(OH)3会与过量的NaOH反应 ②D(2分) ③3S2O32-+4Cr2O72-+26H+=8Cr3++6SO42-+13H2O ④c(Cr3+)·(10-9)3=6.3×10-31c(Cr3+)=6.3×10-4(1分)c(Cr3+)>10-5,所以没有沉淀完全 【来源】2017届广东省揭阳一中高三上学期期中化学试卷(带解析) 26.CuFeS2+3Fe3++Cl-=4Fe2++CuCl+2SCl-+CuCl=[CuCl2]-如果加入过快,部分SO32-会与生成的H+作用生成SO2导致原料损耗II、IVCuCl2、NaCl>4CuFeS2+4H++17O2=4Cu2++4Fe3++8SO42-+2H2O 【来源】【百强校】2017届河北省衡水中学高三上学期七调理综化学试卷(带解析) 27.3NaClO3+3H2SO4=HClO4+2ClO2↑+3NaHSO4+H2O降低NaHSO4的溶解度,使NaHSO4结晶析出2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2OH2O2有还原性也能把ClO2还原为NaClO2强氧化性2Cl2+2 Ca(OH )2=CaCl2+ Ca(ClO)2+2H2O 【来源】2017届山东省菏泽市高三上学期期末学分认定考试B卷化学试卷(带解析) 28.FeTiO3+2H2SO4=FeSO4+TiOSO4+2H2O蒸发浓缩、冷却结晶、过滤TiO2-+(x+1)H2O=TiO2·xH2O↓+2H+升温(或加入过量的水;加碱;任写一种)TiO2+4e-=Ti+2O2-防止Ti、Mg等被氧化 【来源】【百强校】2017届河北省冀州中学高三(高复班)上学期一轮检测(二)化学试卷(带解析) 29.Cl2+2KOH=KCl+KClO+H2O为下一步反应提供反应物,与反应液中过量的氯气继续反应,生成更多的KClO2Fe(NO3)3+3KClO+10KOH=2K2FeO4+6KNO3+3KCl+5H2O减少K2FeO4在过量Fe3+作用下的分解(或K2FeO4在低温、强碱性溶液中比较稳定等)KOH溶液KOH溶液异丙醇KNO3、KCl 答案第5页,总5页 本卷由系统自动生成,请仔细校对后使用,答案仅供参考。 【来源】【全国百强校】2017届江苏省盐城中学高三下学期开学考试化学试题(带解析) 30.A12+2OH-+2H2O= 2AlO2-+3H2↑4Co2O3·CoO + Na2S2O3+ llH2SO4= 12CoSO4 + Na2SO4 +11H2O2Al3++3CO32-+3H2O = 2Al(OH)3↓+3CO2↑调整pH,提供CO32-,使Co2+沉淀为CoCO3B C D 【来源】【全国百强校word】安徽省六安市第一中学2016-2017学年高二上学期期末考试化学试题 31.过滤碱4Cr(OH)3+ 4 Na2CO3+ 3O24Na2CrO4+4CO2+6H2OAlO2–+H++ H2OAl(OH)3↓蒸发浓缩促使反应2CrO42-+2H+Cr2O72-+H2O平衡向正方向移动2H2O+2e-=2OH-+H2↑(或2H++2e-=H2↑)2-d 【来源】【全国市级联考word】湖南省衡阳市2017届高三下学期第一次联考理综化学试题 32.(1)38;<;同一主族元素,原子最外层电子数相同,电子层数越多,原子半径越大,金属性越强,则最高价氧化物对应的水化物的酸性越强; (2)①SrSO4+Na2CO3=SrCO3+Na2SO4;②SrCO3、BaCO3、FeO、Fe2O3、Al2O3;③将Fe2+氧化为Fe3+,使Fe3+和Al3+沉淀完全;④ac。 【来源】2017届四川省绵阳南山中学高三12月月考化学试卷(带解析) 33.防止后续步骤生成的A1C13,水解或增大反应物的接触面积,加快反应速率Fe或铁除去FeCl3,提高A1C13纯度Fe2O314.4%;Al2O38.67% n(Fe2+)=n(EDTA)1=0.02×18×10-3=3.6×10-4mol n(EDTA)余= n(CuSO4)=(0.05×8) ÷250=1.6×10-4mol n(Al3+)=n(EDTA)2-n(EDTA)余=0.02×25×10-3-1.6×10-4=3.4×10-4mol w(Fe2O3)=[(0.5×3.6×10-4×160) ÷0.2] ×100%=14.4% w(Al2O3)=[(0.5×3.4×10-4×102) ÷0.2] ×100%=8.67% 【来源】【全国百强校word】江苏省淮阴中学2017届高三下学期期初考试化学试题 答案第5页,总5页查看更多