- 2021-05-14 发布 |
- 37.5 KB |
- 9页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考真题之氧化还原反应
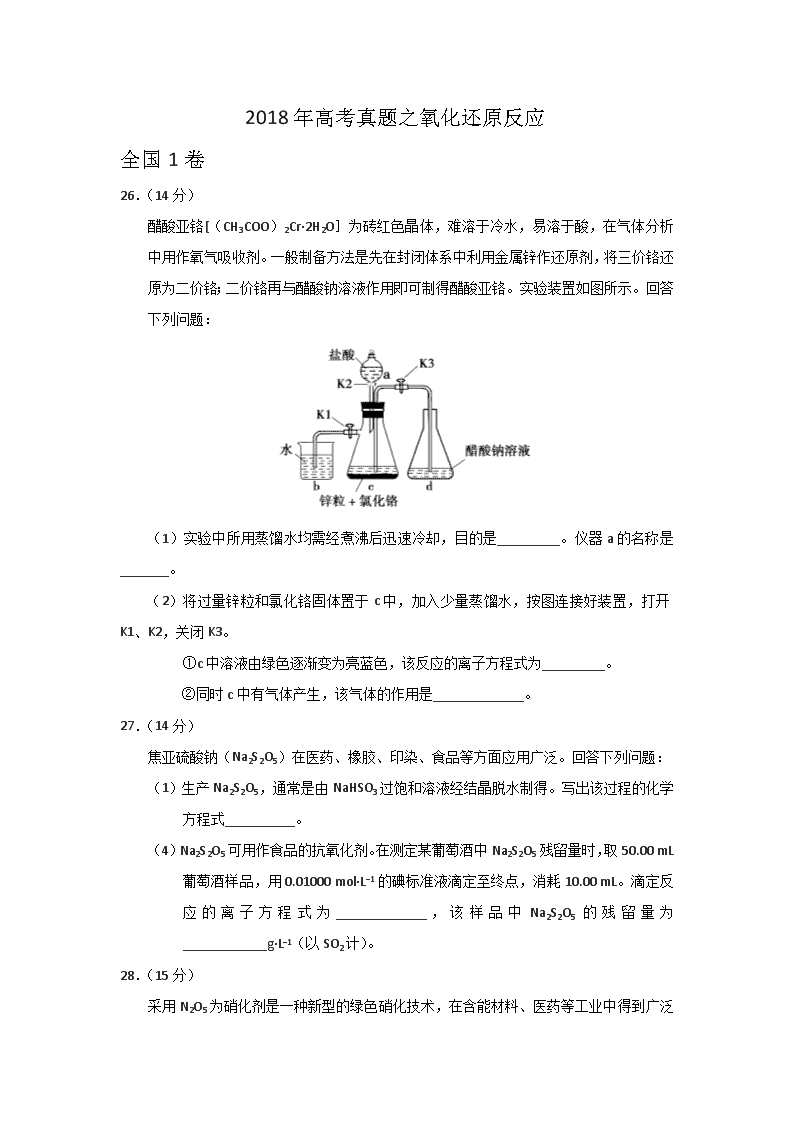
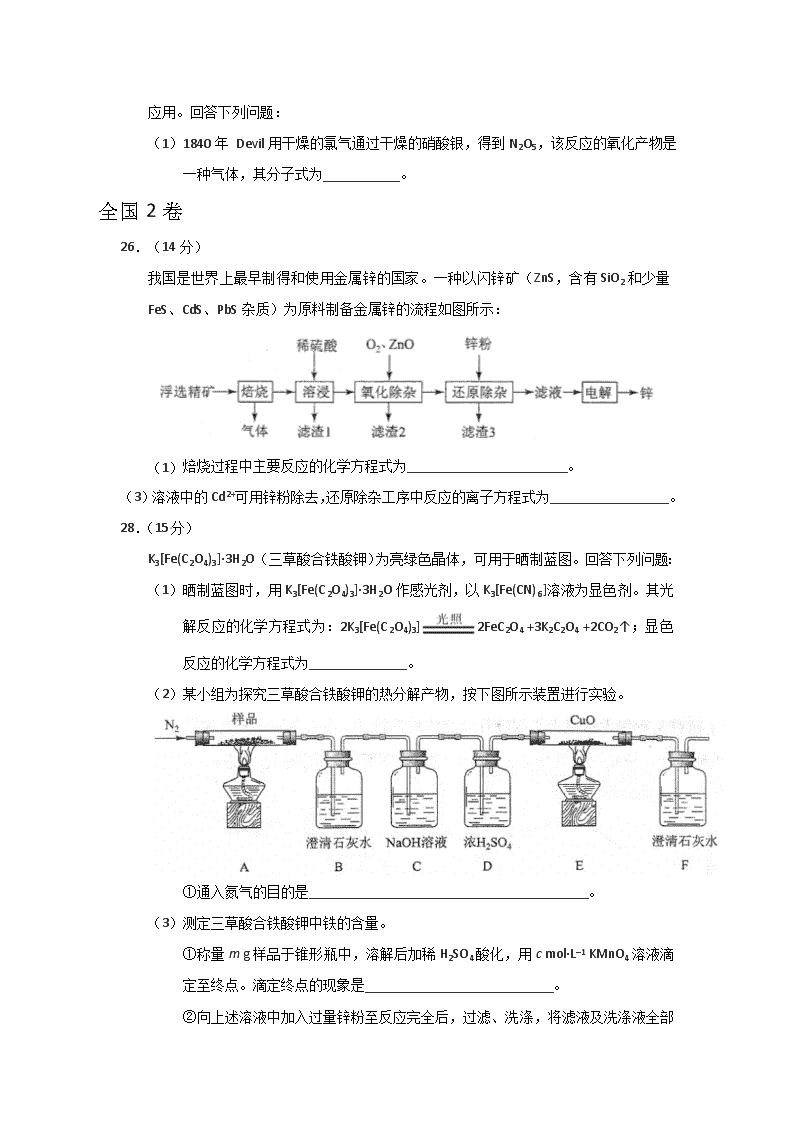
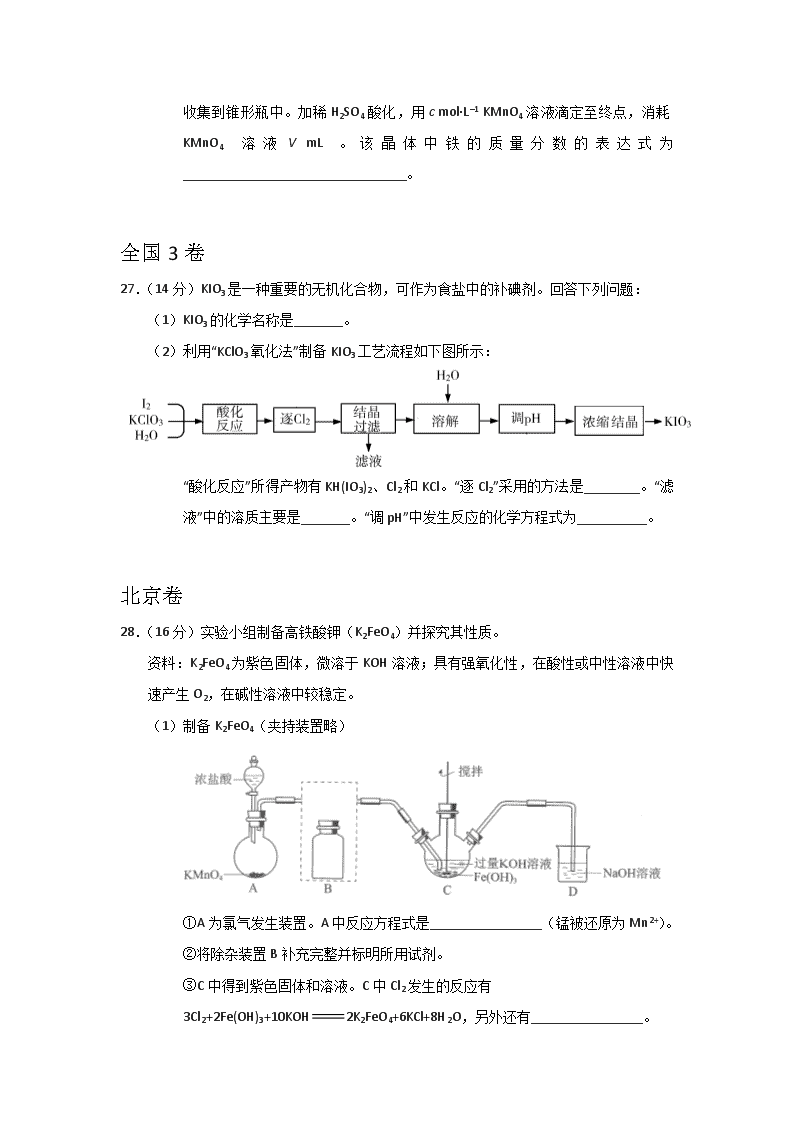
2018年高考真题之氧化还原反应 全国1卷 26.(14分) 醋酸亚铬[(CH3COO)2Cr·2H2O]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示。回答下列问题: (1)实验中所用蒸馏水均需经煮沸后迅速冷却,目的是_________。仪器a的名称是_______。 (2)将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置,打开K1、K2,关闭K3。 ①c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为_________。 ②同时c中有气体产生,该气体的作用是_____________。 27.(14分) 焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛。回答下列问题: (1)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。写出该过程的化学方程式__________。 (4)Na2S2O5可用作食品的抗氧化剂。在测定某葡萄酒中Na2S2O5残留量时,取50.00 mL葡萄酒样品,用0.01000 mol·L−1的碘标准液滴定至终点,消耗10.00 mL。滴定反应的离子方程式为_____________,该样品中Na2S2O5的残留量为____________g·L−1(以SO2计)。 28.(15分) 采用N2O5 为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。回答下列问题: (1)1840年 Devil用干燥的氯气通过干燥的硝酸银,得到N2O5,该反应的氧化产物是一种气体,其分子式为___________。 全国2卷 26.(14分) 我国是世界上最早制得和使用金属锌的国家。一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示: (1) 焙烧过程中主要反应的化学方程式为_______________________。 (3)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为_________________。 28.(15分) K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题: (1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3]2FeC2O4 +3K2C2O4 +2CO2↑;显色反应的化学方程式为______________。 (2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。 ①通入氮气的目的是________________________________________。 (3)测定三草酸合铁酸钾中铁的含量。 ①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L–1 KMnO4溶液滴定至终点。滴定终点的现象是___________________________。 ② 向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L–1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为________________________________。 全国3卷 27.(14分)KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。回答下列问题: (1)KIO3的化学名称是_______。 (2)利用“KClO3氧化法”制备KIO3工艺流程如下图所示: “酸化反应”所得产物有KH(IO3)2、Cl2和KCl。“逐Cl2”采用的方法是________。“滤液”中的溶质主要是_______。“调pH”中发生反应的化学方程式为__________。 北京卷 28.(16分)实验小组制备高铁酸钾(K2FeO4)并探究其性质。 资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。 (1)制备K2FeO4(夹持装置略) ①A为氯气发生装置。A中反应方程式是________________(锰被还原为Mn2+)。 ②将除杂装置B补充完整并标明所用试剂。 ③C中得到紫色固体和溶液。C中Cl2发生的反应有 3Cl2+2Fe(OH)3+10KOH2K2FeO4+6KCl+8H2O,另外还有________________。 (2)探究K2FeO4的性质 ①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案: 方案Ⅰ 取少量a,滴加KSCN溶液至过量,溶液呈红色。 方案Ⅱ 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 i.由方案Ⅰ中溶液变红可知a中含有______离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由________________产生(用方程式表示)。 ii.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是________________。 ②根据K2FeO4的制备实验得出:氧化性Cl2________(填“>”或“<”),而方案Ⅱ实验表明,Cl2和的氧化性强弱关系相反,原因是________________。 ③资料表明,酸性溶液中的氧化性>,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色。该现象能否证明氧化性>。若能,请说明理由;若不能,进一步设计实验方案。 理由或方案:________________。 天津卷 9.(18分)烟道气中的NOx是主要的大气污染物之一,为了监测其含量,选用如下采样和检测方法。回答下列问题: Ⅰ.采样 采样步骤: ①检验系统气密性;②加热器将烟道气加热至140℃;③打开抽气泵置换系统内空气;④采集无尘、干燥的气样;⑤关闭系统,停止采样。 (1)A中装有无碱玻璃棉,其作用是___________。 (2)C中填充的干燥剂是(填序号)___________。 a.碱石灰 b.无水CuSO4 c.P2O5 (3)用实验室常用仪器组装一套装置,其作用是与D(装有碱液)相同,在虚线框中画出该装置的示意图,标明气体的流向及试剂。 (4)采样步骤②加热烟道气的目的是___________。 Ⅱ.NOx含量的测定 将v L气样通入适量酸化的H2O2溶液中,使NOx完全被氧化为NO3−,加水稀释至100.00 mL。量取20.00 mL该溶液,加入v1 mL c1 mol·L−1 FeSO4标准溶液(过量),充分反应后,用c2 mol·L−1 K2Cr2O7标准溶液滴定剩余的Fe2+,终点时消耗v2 mL。 (5)NO被H2O2氧化为NO3−的离子方程式是___________。 (6)滴定操作使用的玻璃仪器主要有___________。 (7)滴定过程中发生下列反应: 3Fe2++NO3−+4H+NO↑+3Fe3++2H2O Cr2O72− + 6Fe2+ +14H+ 2Cr3+ +6Fe3++7H2O 则气样中NOx折合成NO2的含量为_________mg·m−3。 (8)判断下列情况对NOx含量测定结果的影响(填“偏高” 、“偏低”或“无影响 ”) 若缺少采样步骤③,会使测试结果___________。 若FeSO4标准溶液部分变质,会使测定结果___________。 江苏卷 19.(15分)以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下: 已知:①Cl2+2OH−ClO−+Cl−+H2O是放热反应。 ②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。 (1)步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________________________;实验中控制温度除用冰水浴外,还需采取的措施是____________________________________。 (2)步骤Ⅱ合成N2H4·H2O的装置如题19图−1所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________;使用冷凝管的目的是_________________________________。 (3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、、随pH的分布如题19图−2所示,Na2SO3的溶解度曲线如题19图−3所示)。 ①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3 溶液。实验中确定何时停止通SO2的实验操作为_________________。 ②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案: _______________________,用少量无水乙醇洗涤,干燥,密封包装。 参考答案 全国1卷 26.(14分) (1)去除水中溶解氧 分液(或滴液)漏斗 (2)①Zn+2Cr3+Zn2++2Cr2+ ②排除c中空气 27.(14分) (1)2NaHSO3Na2S2O5+H2O (4)+2I2+3H2O 2+4I-+6H+ 0.128 28.(15分) (1)O2 全国2卷 26.(14分) (1)ZnS+O2ZnO+SO2 (3)Zn+Cd2+Zn2++Cd 28.(15分) (1)3FeC2O4+2K3[Fe(CN)6]Fe3[Fe(CN)6]2+3K2C2O4 (2)①隔绝空气、使反应产生的气体全部进入后续装置 (3)①粉红色出现 ② 全国3卷 27.(14分) (1)碘酸钾 (2)加热 KCl KH(IO3)2+KOH2KIO3+H2O或(HIO3+KOHKIO3+H2O) 北京卷 28.(16分) (1)①2KMnO4+16HCl2MnCl2+2KCl +5Cl2↑+8H2O ② ③Cl2+2OH−Cl−+ClO−+H2O (2)①i. Fe3+ 4+20H+4Fe3++3O2↑+10H2O ii.排除ClO−的干扰 ②> 溶液酸碱性不同 ③理由:在过量酸的作用下完全转化为Fe3+和O2,溶液浅紫色一定是的颜色 方案:向紫色溶液b中滴加过量稀H2SO4,观察溶液紫色快速褪去还是显浅紫色学%科网 天津卷 9.(18分) (1)除尘 (2)c (3) (4)防止NOx溶于冷凝水 (5)2NO+3H2O2=2H++2NO3–+2H2O (6)锥形瓶、酸式滴定管 (7) (8)偏低 偏高 江苏卷 19.(15分) (1)3Cl2+6OH−5Cl−+ClO3−+3H2O 缓慢通入Cl2 (2)NaClO碱性溶液 减少水合肼的挥发 (3)①测量溶液的pH,若pH约为4,停止通SO2 ②边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH,pH约为10时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于34℃条件下趁热过滤查看更多