- 2021-05-13 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
全国高考化学《考试大纲》解读
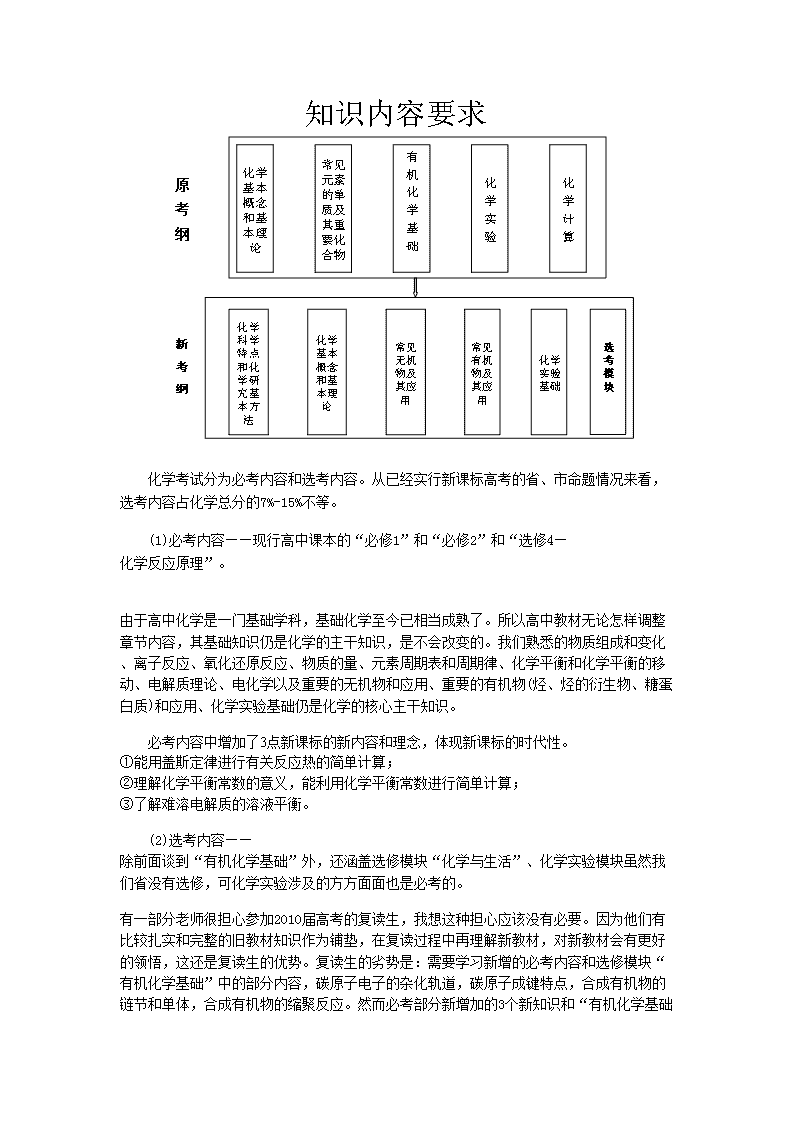
全国高考化学《考试大纲》解读 《考试大纲》是高考遵循的“宪法”,是专家命题的依据,是复习备考的“指挥棒”——大纲有多深,复习就多深;大纲有多难,复习就多难。不可雷池稍越,哪怕半点,也是无用之功;不可妄自疏漏,一毫之差,可致千里之谬。笔者认为,要点有三: 第一,把握考纲要求,务求全面通透。《考试大纲》上明确对(理综)化学部分有三个层次的要求:第1个层次是了解,要求对相关的化学知识有一个初步的认识,能够正确地复述、再现或直接使用,这部分内容不算是重点内容。在理综考试中,化学试题从原来的26道减到12道(2010年可能是11道),考试的重点肯定是化学学科的主干知识;特别重要的、理解比较深的内容理所当然成为考查的重点;第2个层次是理解,领会所学知识的含义,能够正确审查、解释、说明有关化学现象的问题;第3个层次是综合运用,运用所掌握知识进行必要的分析、类推、计算、解释、论证具体的问题。显然第2、3个层次的内容是我们复习的重点,应该把主要的精力和注意力都要放在这两个层次上。当然,对第1个层次了解的内容也不能说就不管了,至少应该有一个初步的认识和了解。 第二,关注考纲之变,及时调整方案。全国各地的教材不尽相同,甚至大相径庭;相应的考纲又分别随之调整,所以要格外注意考查范围的变化,现在各省市对高考的一些要求也有区别,一定要注意彻底地抛掉教材里没有的、《考试大纲》不要求的、必须靠记忆才能掌握的内容。有的考生在准备复习备考的时候总是不放心,有一些是教材里没有的、大纲上不要求的,老师在讲课的过程中为了扩充知识面或者为了使体系更加完整,就补充了一些内容。但是,综观这几年的高考题,考查的知识点没有超出课本范围的,也没有超出《考试大纲》要求的。 第三,重视题型示例,多做对比迁移。在《考试大纲》中,一些单独命题省市比较优秀、典型的题目也在题型示例里出现,这对我们复习准备高考的时候是有导向性的。所以要认真地去分析和研究,这些题目的难度要求、考查的范围以及知识点如何去考查,一定要吃透彻,才能全面地了解高考命题的大局大势,才能保证复习备考的时候有的放矢。 2010年湖南省高考理综将完全按照新课程标准的《考试大纲》进行命题。2010年化学学科新课程高考,有什么变化和新的要求? 一、考试范围和内容上的变化 化学考试分为必考内容和选考内容。从已经实行新课标高考的省、市命题情况来看,选考内容占化学总分的7%-15%不等。 (1)必考内容——现行高中课本的“必修1”和“必修2”和“选修4—化学反应原理”。 由于高中化学是一门基础学科,基础化学至今已相当成熟了。所以高中教材无论怎样调整章节内容,其基础知识仍是化学的主干知识,是不会改变的。我们熟悉的物质组成和变化、离子反应、氧化还原反应、物质的量、元素周期表和周期律、化学平衡和化学平衡的移动、电解质理论、电化学以及重要的无机物和应用、重要的有机物(烃、烃的衍生物、糖蛋白质)和应用、化学实验基础仍是化学的核心主干知识。 必考内容中增加了3点新课标的新内容和理念,体现新课标的时代性。 ①能用盖斯定律进行有关反应热的简单计算; ②理解化学平衡常数的意义,能利用化学平衡常数进行简单计算; ③了解难溶电解质的溶液平衡。 (2)选考内容——除前面谈到“有机化学基础”外,还涵盖选修模块“化学与生活”、化学实验模块虽然我们省没有选修,可化学实验涉及的方方面面也是必考的。 有一部分老师很担心参加2010届高考的复读生,我想这种担心应该没有必要。因为他们有比较扎实和完整的旧教材知识作为铺垫,在复读过程中再理解新教材,对新教材会有更好的领悟,这还 是复读生的优势。复读生的劣势是:需要学习新增的必考内容和选修模块“有机化学基础”中的部分内容,碳原子电子的杂化轨道,碳原子成键特点,合成有机物的链节和单体,合成有机物的缩聚反应。然而必考部分新增加的3个新知识和“有机化学基础” 中的部分内容,充其量用1个月时间就可以学完。从时间占用上完全不会影响2010年高考,就如同马拉松长跑中有的运动员减缓一下速度,喝些运动饮料一样。 二、新旧考试大纲的考核目标和能力要求的变化 差异处 旧课表考纲的 表达方式 新课标考纲的 表达方式 变化 关键词 我的 思考 (1) 考核 目标 (2) 能力 要求 化学科试题旨在测试考生对中学化学基础知识,基本技能的掌握情况和所应具有的观察能力、实验能力、思维能力和自学能力;试题还应注意考查考生初步运用所学化学知识,观察、分析生活、生产和社会中的种类有关化学问题的能力。 ①观察能力:对素材获取有关的感性知识和印象,并对其进行加工和记忆 ②实验能力 :基本操作;记录、得出结论;处理安全问题;识别和绘制装置图; 设计或评价简单实验方案 ③思维能力 :将知识点统摄整理;对它们分解、迁移转换、重组;将化学信息进行抽象归纳;利用数学工具,通过计算和推理 ④自学能力:接受新信息;新信息与课内已学过的有关知识结合起来;应用新信息 化学科考试,为了有利于选拔具有学习潜能和创新精神的考生,以能力测试为主导,将在测试考生进一步学习所必需的知识、技能和方法的基础上,全面检测考生的化学科学素养。化学科命题注重测量自主学习的能力,重视理论联系实际,关注与化学有关的科学技术、社会经济和生态环境的协调发展,以促进学生在知识和技能、过程和方法、情感、态度和价值观等方面的全面发展。 ①接受、吸收、整合化学信息的能力:对基础知识复述、再现、辨认;获取有关的感性知识和印象,并进行加工、吸收、有序存储;从新信息中提取实质内容,并经与已有知识块整合,重组为新知识块的能力。 ②分析问题和解决(解答)化学问题的能力 ③化学实验与探究能力:初步实践化学实验研究的一般过程;在解决简单化学问题的过程中,了解化学变化规律,并对化学现象提出科学合理的解释。 “双基”、 “四能力” “一初步 运用”→ 发现“学习 潜能和创 新精神”、“自主学 习的能力” “三维目 标”、 化学实验与探究能力 命题的风 格、方向、 各内容比 例、题境设 置、以及呈 现方式或 题型组合 将发生一 定变化→ 体现“两 重”即 重化学素 养和重综 合素质 例:影响化学反应速率的因素 旧课标: 1.(07·广东卷)把铝条放入盛有过量稀盐酸的试管中,不影响氢气产生速率的因素是( D ) (A)盐酸的浓度 (B)铝条的表面积 (C)溶液的温度 (D)加少量Na2SO4 2.(2000·广东卷)用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是( ) A.加热 B.不用稀硫酸,改用98%浓硫酸 C.滴加少量CuSO4溶液 D.不用铁片,改用铁粉 新课标: 1.(09·宁夏卷10)硫代硫酸钠溶液与稀硫酸反应的化学方程式为: Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是( D ) 实验 反应温 度/℃ Na2S2O3溶液 稀H2SO4 H2O V/mL c/(mol·L-1) V/mL c/(mol·L-1) V/mL A 25 5 0.1 10 0.1 5 B 25 5 0.2 5 0.2 10 C 35 5 0.1 10 0.1 5 D 35 5 0.2 5 0.2 10 答案D 2. 某探究小组利用丙酮的溴代反应()来研究反应物浓度与反应速率的关系。反应速率通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据: 分析实验数据所得出的结论不正确的是( D )w.w.w.k.s.5.u.c.o.m A. 增大增大 B. 实验②和③的相等 C. 增大增大 D. 增大,增大 3.(·09全国2卷27)(波及)w.w.w.k.s.5.u.c.o.m某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。 (1)根据左表中数据,在右图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线: t/min X/mol Y/mol Z/mol 0 1.00 1.00 0.00 1 0.90 0.80 0.20 3 0.75 0.50 0.50 5 0.65 0.30 0.70 9 0.55 0.10 0.90 10 0.55 0.10 0.90 14 0.55 0.10 0.90 (2) 体系中发生反应的化学方程式是___________________________; (3) 列式计算该反应在0-3min时间内产物Z的平均反应速率:____; 答案: 三、具体内容例析 (一)化学科学特点和化学研究基本方法 1.了解化学的主要特点是在原子、分子水平上认识物质。了解化学可以识别、改变和创造分子。 2.了解科学探究的基本过程,学习运用以实验和推理为基础的科学探究方法。认识化学是以实验为基础的一门科学。 3.了解物质的组成、结构和性质的关系。了解化学反应的本质、基本原理以及能量变化等规律。 4.了解定量研究的方法是化学发展为一门科学的重要标志。理解摩尔(mol)是物质的量的基本单位,可用于进行简单的化学计算。 5.了解科学、技术、社会的相互关系(如化学与生活、材料、能源、环境、生命过程、信息技术的关系等)。了解在化工生产中遵循“绿色化学”思想的重要性。 【试题举例】 例1(08·上海卷1)食品检验是保证食品安全的重要措施,下列不属于食品安全检测指标的是 A.淀粉的含量B.二氧化硫的含量 C.亚硝酸盐的含量D.甲醛的含量 【答案】A 【解析】食品安全检验就是检验对人体有害的物质。二氧化硫、甲醛、亚硝酸盐都是有毒物质,故选A。 例2 (09·山东卷9)下列叙述错误的是 A.合金材料中可能含有非金属元素 B.人造纤维,合成纤维和光导纤维都是有机高分子化合物 C.加热能杀死流感病毒是因为病毒的蛋白质受热变性 D.在汽车排气管上加装“催化转化器”是为了减少有害气体的排放 【答案】B 【解析】钢中含有碳元素;光导纤维的成分是SiO2;蛋白质受热而变性;在汽车排气管上加装“催化转化器”是为了把生成的CO、氮的氧化物转化为CO2、N2无害气体。 【我的感悟】平时应密切关注生活中与化学相关的热点问题,了解其原理。这类题考查的知识点多,但考查的内容往往较为简单,基本都是识记内容。 (二)化学基本概念和基本理论 1.物质的组成、性质和分类 (1)了解分子、原子、离子等概念的含义。了解原子团的定义。 (2)理解物理变化与化学变化的区别与联系。 (3)理解混合物和纯净物、单质和化合物、金属和非金属的概念。 (4)理解酸、碱、盐、氧化物的概念及其相互联系。 【试题举例】 例3 【答案】C 【我的感悟】对于相似易混淆的概念,应注意对比分析,找出其异同点。 2.化学用语及常用计量 (1)熟记并正确书写常见元素的名称、符号、离子符号。(2)熟悉常见元素的化合价。能根据化合价正确书写化学式(分子式),或根据化学式判断化合价。(3)了解原子结构示意图、分子式、结构式和结构简式的表示方法。(4)了解相对原子质量、相对分子质量的定义,并能进行有关计算。(5)理解质量守恒定律的含义。(6)能正确书写化学方程式和离子方程式,并能进行有关计算。 (7)了解物质的量的单位——摩尔(mol)、摩尔质量、气体摩尔体积、物质的量浓度、阿伏加德罗常数的含义。 (8)根据物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况下)之间的相互关系进行有关计算。 【试题举例】 例4 (08·宁夏卷11)短周期元素E的氯化物ECln的熔点为-78℃,沸点为59℃;若0.2molECln与足量的AgNO3溶液完全反应后可以得到57.4g的AgCl沉淀。下列判断错误的是 A.E是一种非金属元素 B.在ECln中E与Cl之间形成共价键 C.E的一种氧化物为EO2D.E位于元素周期表的IVA族 【答案】D 例5 (09·浙江卷9)已知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高。则下列溶液的沸点最高的是 A.0.01 mol/L的蔗糖溶液 B.0.01 mol/L的CaCl2溶液 C.0.02 mol/L的NaCl溶液 D.0.02 mol/L的CH3OOH溶液 【答案】C。 【解析】C中含0.04 mol离子,最多。 【我的感悟】近年来,该类题的命题角度新颖,题境公平,能有效控制题海战术的蔓延。 3.溶液 (1)了解溶液的含义。 (2)了解溶解度、饱和溶液的概念。 (3)了解溶液的组成。理解溶液中溶质的质量分数的概念,并能进行有关计算。 (4)了解配制一定溶质质量分数、物质的量浓度溶液的方法。 (5)了解胶体是一种常见的分散系。 【试题举例】 例6 (2009全国2卷7)下列关于溶液和胶体的叙述,正确的是 A. 溶液是电中性的,胶体是带电的 B. 通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动 C. 溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 D. 一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有 【答案】D 【解析】胶体本身是不带电,只是其表面积较大,吸附了溶液中的离子而带了电荷,故A项错;溶液中的溶质,要看能否电离,若是非电解质,则不导电,也即不会移动,B项错;布朗运动本身即是无规律的运动,C项错;丁达尔效应可以用来区分溶液和胶体,D项正确。 【我的感悟】这部分内容知识点较少,以考查基础知识为主。 4.物质结构和元素周期律 (1)了解元素、核素和同位素的含义。 (2)了解原子构成。了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。 (3)了解原子核外电子排布。 (4)掌握元素周期律的实质。了解元素周期表(长式)的结构(周期、族)及其应用。 (5)以第3周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系。 (6)以ⅠA和ⅦA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。 (7)了解金属、非金属在元素周期表中的位置及其性质递变的规律。 (8)了解化学键的定义。了解离子键、共价键的形成。 【试题举例】 例7(2009全国II)9. 某元素只存在两种天然同位素,且在自然界它们的含量相近,其相对原子质量为152.0,原子核外的电子数为63。下列叙述中错误的是 A. 它是副族元素 B. 它是第六周期元素 C. 它的原子核内有63个质子 D. 它的一种同位素的核内有89个中子 【答案】D 【解析】核外电子数等于其质子数,C项正确;用质子数分别减去各周期所含有的元素种类,63-2-8-8-18-18=9,显然其属于第六周期,从左到右的第9种,而第六周期中包含镧系,所以它应属于副族,A项、B项均正确;由于存在同位素,所以相对原子质量应是同位素的平均值,而不代表其中一种元素的质量数,故中子数不能用152-63=89来计算,D项错。 【我的感悟】元素的“位、构、性”是本章经常考查的内容,复习本专题时要从本质上把握好概念,抓住“位”、“构”、“性”之间的关系,掌握一点来推测另两点。 5.化学反应与能量 (1)了解氧化还原反应的本质是电子的转移。了解常见的氧化还原反应。 (2)了解化学反应中能量转化的原因,能说出常见的能量转化形式。 (3)了解化学能与热能的相互转化。了解吸热反应、放热反应、反应热等概念。 (4)了解热化学方程式的含义,能用盖斯定律进行有关反应热的简单计算。 (5)了解能源是人类生存和社会发展的重要基础。了解化学在解决能源危机中的重要作用。 (6)了解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。了解常见化学电源的种类及其工作原理。 (7)理解金属发生电化学腐蚀的原因,金属腐蚀的危害,防止金属腐蚀的措施。 【试题举例】 例8 (2008·海南卷)白磷与氧可发生如下反应:P4+5O2===P4O10 。已知断裂下列化学键需要吸收的能量分别为:P—Pa kJ·mol-1、P—Ob kJ·mol-1、P===Oc kJ·mol-1、O===Od kJ·mol-1。 根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是() A.(6a+5d-4c-12b) kJ·mol-1B.(4c+12b-6a-5d) kJ·mol-1 C.(4c+12b-4a-5d) kJ·mol-1D.(4a+5d-4c-12b) kJ·mol-1 【答案】A 【解析】1 mol P4中有6 mol P—P,反应中需要吸收6a kJ热量,5 mol O2中有5 mol O===O,反应中需要吸收5d kJ热量,1 mol P4O10中有4 mol P===O,12 mol P—O,生成1 mol P4O10放出(4c+12b)kJ热量,故ΔH=6a+5d-(4c+12b),则A正确。 【我的感悟】电化学部分复习时要注意“四池”(原电池、电解池、电镀池、精炼池)的对比,抓住概念及本质的东西加以分析和理解。 6.化学反应速率和化学平衡 (1)了解化学反应速率的概念、反应速率的定量表示方法。 (2)了解催化剂在生产、生活和科学研究领域中的重大作用。 (3)了解化学反应的可逆性。 (4)了解化学平衡建立的过程。理解化学平衡常数的含义,能够利用化学平衡常数进行简单的计算。 (5)理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,认识其一般规律。 (6)了解化学反应速率和化学平衡的调控在生活、生产和科学研究领域中的重要作用。 【试题举例】 例9 (09·天津卷5)人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2O2+HbCO,37 ℃时,该反应的平衡常数K=220。.HbCO的浓度达到HbO2浓度的0.02倍,导致人智力受损。据此,下列结论错误的是 A.CO与HbO2反应的平衡常数K=c(O2)·c(HbCO )/ c(CO)·c(HbCO2 ) B.人体吸入的CO越多,与血红蛋白结合的O2越少 C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损 D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动 【答案】C 【解析】A选项就是考查平衡常数的表达式,应该容易判断正确;B选项可根据方程式分析,CO浓度越大平衡右移,血红蛋白(Hb) 结合的O2越少;D选项同样可方程式分析,其实就是B选项的逆过程。C选项应该为.HbCO的浓度与HbO2浓度之比大于或等于0.02时,人的智力才会受损。 【我的感悟】本题考查化学平衡常数以及影响平衡移动因素等相关知识点,起点高但落脚点低,整题考生只要学会读题,找出语言表述的不同,即可得到正确答案。 7.电解质溶液 (1)了解电解质的概念。了解强电解质和弱电解质的概念。 (2)了解电解质在水溶液中的电离,以及电解质溶液的导电性。 (3)了解弱电解质在水溶液中的电离平衡。 (4)了解水的电离,离子积常数。 (5)了解溶液pH的定义。了解测定溶液pH的方法,能进行pH的简单计算。 (6)了解盐类水解的原理、影响盐类水解程度的主要因素、盐类水解的应用。 (7)了解离子反应的概念、离子反应发生的条件。了解常见离子的检验方法。 (8)了解难溶电解质的沉淀溶解平衡及沉淀转化的本质。 8.以上各部分知识的综合应用。 【试题举例】 例10(09·宁夏卷11)将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,其中错误的是 【答案】D 【解析】A选项氢氧化钠和醋酸发生中和反应,反应放热,当酸反应完成后,再加碱,相当于往热水中加入冷水,温度降低。B选项醋酸中滴加氢氧化钠酸性减弱pH增大。C选项醋酸中滴加氢氧化钠,相当于弱电解质溶液变成强电解质溶液,因此导电能力增加。D选项醋酸中滴加氢氧化钠,氢氧化钠和醋酸发生反应了,因此氢氧化钠开始时为0. 【我的感悟】离子反应、pH的有关计算、盐类水解规律、溶液中微粒关系是这部分的重点内容,也是常见考点。 (三)常见无机物及其应用(见课件) (四)常见有机物及其应用(见课件) 四、备考建议 高考制度的改革需要严谨的论证阶段,但高考试题的内容能够保证那些严格遵守办学规范的学校不吃亏,试题的难度和选择的视角会区别于题海战术时期。 为了有利于选拔具有学习潜能和创新精神的考生,新课标高考将更突出测量自主学习能力、理论联系实际、全面检测考生的化学科学素养。对于准备参加2010年高考的考生,绝不仅仅盯住新增加的知识点,而是在学习方法上作些改变适应新课标重视提倡的探究式学习,不仅重视学习结果,而且重视学习过程中探究科学研究的方法、科学态度和思想。为此希望在复习中重视以下几点: (1)切实抓好中学主干知识的深刻理解和灵活运用。对重要知识要做到知其然又知其所以然,做到概念清晰、理解深刻、运用灵活。 (2)注意接受、吸收、整合化学信息的能力,要能“通过实际事物、实验、现象、模型、图形、图表的观察进行加工、吸收的能力。”要能“从试题提供的新信息中,准确提取实质性内容,并与原有知识块整合、重组为新知识块的能力。” (3)注意“运用分析综合的方法,解决化学问题的能力。”并培养 “用化学术语、文字、图表等表达和解释化学问题的能力”。 (4)重视化学实验的基本方法、技能,重视探究能力的培养。 查看更多