- 2021-05-13 发布 |
- 37.5 KB |
- 30页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
全国八省联考湖北省2021年普通高中学业水平选择考适应性测试化学试题(含答案解析)
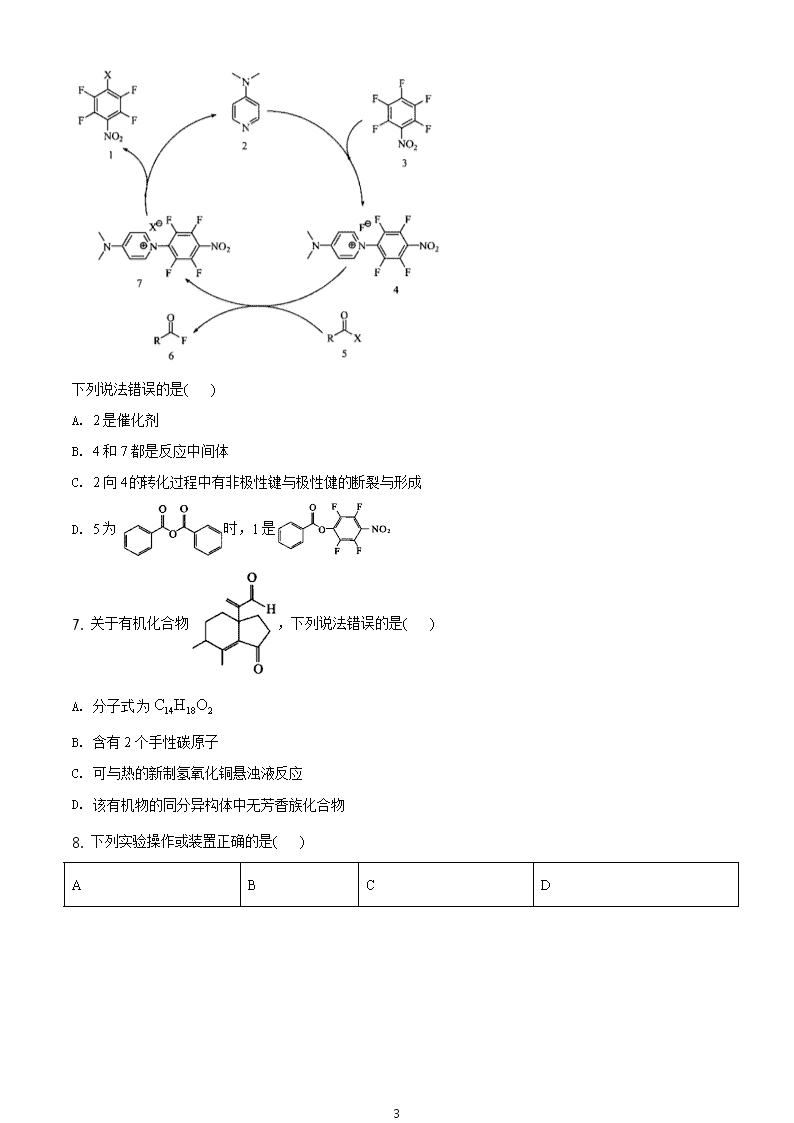
1 2021 年湖北省普通高中学业水平选择性模拟演练 化学 本试卷共 10 页,19 题。全卷满分 100 分。用时 75 分钟。 注意事项: 1.答题前,先将自己的姓名、准考证号、考场号、座位号填写在试卷和答题卡上,并将准考证 号条形码粘贴在答题卡上的指定位置。 2.选择题的作答:每小题选出答案后,用 2B 铅笔把答题卡上对应题目的答案标号涂黑.写在试 卷、草稿纸和答题卡上的非答题区域均无效。 3.非选择题的作答:用黑色签字笔直接答在答题卡上对应的答题区域内.写在试卷、草稿纸和 答题卡上的非答题区域均无效。 4.结束后,请将本试卷和答题卡一并上交。 可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 F 19 Mg 24 Si 28 S 32 Cl 35.5 Fe 56 Ni59 一、选择题:本题共 15 小题,每小题 3 分,共 45 分.在每小题给出的四个选项中,只有一项 是符合题目要求的。 1. 科学佩戴口罩对防控新冠病毒疫情有重要作用,生产一次性医用口罩的主要原料为聚丙烯树脂。下列说 法错误的是( ) A. 聚丙烯结构简式为 B. 由丙烯合成聚丙烯的反应类型为缩聚反应 C. 聚丙烯为热塑性合成树脂 D. 聚丙烯在自然环境中不容易降解 2. 14 6 C的衰变反应为 14 14 0 6 z -1C X+ e ,其半衰期(反应物的量被消耗到其初始量的一半需要的时间)为 5730 年。下列说法正确的是( ) A. 14 6 C与 14 z X 互为同位素 B. 14 6 C与 14 z X 的中子数相同 C. 12 6 C和 14 6 C的价层轨道电子数相差 2 D. 某考古样品中 14 6 C的量应为其 11460 年前的 1 4 3. AN 为阿伏加德罗常数的值。下列说法正确的是( ) 2 A. 21molH S 分子中,S 原子的价层电子对数目为 A4N B. 标准状况下, 2.24L 环己烷的分子数为 A0.1N C. -11L0.01mol L 溶液中, 和 的离子数目之和为 A0.01N D. 电极反应 - + 4 1-x 4LiFePO -xe =xLi +Li FePO ,每转移1mol 电子释放 A2N 个 +Li 4. 不能正确表示下列反应的离子方程式是( ) A. 将少量溴水滴入过量 2 3Na SO 溶液中: 2- - + 2- 2 2 3 4Br +H O+SO =2Br +2H +SO B. 将足量 2 4 3Fe SO 溶液滴入 2Mg(OH) 浊液中: 3 2 2 32Fe 3Mg(OH) 2Fe(OH) 3Mg C. 将过量 2SO 通入 2K S 溶液中: 2 2 2 35SO 2S 2H O 3S 4HSO D. 将葡萄糖溶液与足量银氨溶液共热: + - 2 4 3 2CH OH(CHOH) CHO+2 Ag NH +2OH Δ - + - 2 4 4 3 2CH OH(CHOH) COO +NH +2Ag +3NH +H O 5. 短周期元素 W、X、Y 和 Z 的原子序数依次增大。W 是宇宙中最丰富的元素, 2W X 是维持生命过程的 必需物质,WY 可用于玻璃的刻蚀, 2ZX 是酸雨的主要形成原因之一,室温下化合物 4ZY 是气体。下列说 法错误的是( ) A. Y 的第一电离能在四种元素中最大 B. 2W X 和 2ZX 的中心原子分别为 3sp 和 2sp 杂化 C. 2W X 的沸点高于 2W Z 的沸点 D. 4ZY 分子中原子均为 8 电子结构 6. 最新文献报道,有机小分子可催化多氟芳烃的取代反应,机理如图所示。 3 下列说法错误的是( ) A. 2 是催化剂 B. 4 和 7 都是反应中间体 C. 2 向 4的转化过程中有非极性键与极性健的断裂与形成 D. 5 为 时,1 是 7. 关于有机化合物 ,下列说法错误的是( ) A. 分子式为 14 18 2C H O B. 含有 2 个手性碳原子 C. 可与热的新制氢氧化铜悬浊液反应 D. 该有机物的同分异构体中无芳香族化合物 8. 下列实验操作或装置正确的是( ) A B C D 4 蒸发除去苯甲酸中的乙醇 除去水中的苯酚 实验室纯化工业乙酸乙酯 用氢氧化钠溶液滴定醋酸溶液 A. A B. B C. C D. D 9. B 和 Al 为同族元素,下列说法错误的是( ) A. 3BF 和 3AlF 都可以与 -F 形成配位键 B. 3 3H BO 为三元酸, 3Al(OH) 呈两性 C. 共价键的方向性使晶体 B 有脆性,原子层的相对滑动使金属 Al 有延展性 D. B 和 Al 分别与 N 形成的共价晶体,均具有较高硬度和熔点 10. 研究发现,在酸性乙醇燃料电池中加入硝酸,可使电池持续大电流放电,其工作原理如图所示。 下列说法错误的是( ) A. 加入 3HNO 降低了正极反应的活化能 B. 电池工作时正极区溶液的 pH 降低 C. 3 21molCH CH OH 被完全氧化时有 23molO 被还原 D. 负极反应为 - + 3 2 2 2CH CH OH+3H O-12e =2CO +12H 5 11. 下列实验的现象描述和结论都正确的是( ) 实验操作 实验现象 实验结论 A 将水滴入盛有 2 2Na O 固体的试管中,立即把带 火星的木条放在试管口 可观察到有气泡产生,木 条复燃 2 2Na O 固体遇水产生 2O B 向盛有 10 滴 1 30.1mol L AgNO 溶液的试管中 滴加 10.1mol L KCl 溶液至不再生成沉淀后, 再向其中滴加 -10.1mol L KI 溶液 先观察到白色沉淀,后沉 淀颜色变为黄色 sp sp(AgCl) (AgI)K K< C 向两支盛有少量溴的四氯化碳溶液的试管中分 别加入适量苯和通入足量乙烯 溶液均褪色 溴与苯和乙烯都能发生 反应 D 向两支盛有 1 44mL0.01mol L KMnO 溶液的 试管中分别加入 12mL0.1mol L 和 1 2 2 42mL0.2mol L H C O 溶液 前者比后者褪色快 其他条件不变,反应物浓 度增加,反应速率增大 A. A B. B C. C D. D 12. 在碱性溶液中, 2+Cu 可以与缩二脲形成紫色配离子,其结构如图所示。 下列说法错误的是( ) A. 该配离子与水分子形成氢键的原子只有 N 和 O B. 该配离子中铜离子的配位数是 4 C. 基态 Cu 原子的价电子排布式是 10 13d 4s D. 该配离子中非金属元素的电负性大小顺序为 O>N>C>H 6 13. 已知 x 1-xNi Mg O 晶体属立方晶系,晶胞边长 a。将 +Li 掺杂到该晶胞中,可得到一种高性能的 p 型太阳 能电池材料,其结构单元如图所示。 假定掺杂后的晶胞参数不发生变化,下列说法正确的是( ) A. 该结构单元中 O 原子数为 3 B. Ni 和 Mg 间的最短距离是 2 a2 C. Ni 的配位数为 4 D. 该物质的化学式为 0.5 1.12 2.38 4Li Mg Ni O 14. 水泥是人类最伟大的发明之一,主要成分为硅酸三钙(3CaO∙SiO2)。将其与适量的水反应,形成相互交 联的结构,反应式如下 2(3CaO∙SiO2)+6H2O=3CaO∙2SiO2∙3H2O+3Ca(OH)2 ∆H<0。但是,需要避免交联过程 热膨胀及产生的水蒸气在建筑结构中造成空隙。我国三峡大坝的建设者在全世界首创了以冰代水的浇灌方 法,有效解决了这一问题,保证了大坝建筑质量。下列说法错误的是( ) A. 水泥由黏土和石灰石等研磨、煅烧制得 B. 水泥生产过程中加入石膏,可以调节水泥的硬化速率 C. 水的作用是提供结晶水以稳定交联结构 D. 以冰代水的优点是减少了热膨胀及水蒸气的产生 15. 25℃时,按下表配制两份溶液. 一元弱酸溶液 加入的 NaOH 溶液 混合后所得溶液 1HA 10.0mL0.20mol L 15.0mL0.20mol L 溶液Ⅰ pH=5.0 1HB10.0mL0.20mol L 15.0mL0.20mol L 溶液Ⅱ pH=4.0 下列说法错误的是( ) A. 溶液Ⅰ中, - + + -c A >c Na >c H >c OH 7 B. Ⅰ和Ⅱ的 pH 相差 1.0,说明 a a K (HA) =10K (HB) C. 混合Ⅰ和Ⅱ: + + - - -c Na +c H =c A +c(B )+c(OH ) D. 混合Ⅰ和Ⅱ: c(HA)>c(HB) 二、非选择题:本题共 4 小题,共 55 分。 16. 无水 3FeCl 是常用的芳香烃取代反应催化剂,它具有易水解、易升华的性质。铁粉与氯气反应制备无水 3FeCl 的实验装置如图所示: E 和 G 用来收集产物。回答下列问题: (1)通入氯气后,A 中观察到有酸雾产生,C 中 2 5P O 的作用是_______。 (2)在 E、G 处收集产物是利用了 3FeCl _______的性质。 (3)实验过程中若 F 处出现堵塞,则在 B 处可观察到的现象是_______。可通过_______(填简单操作),使实 验能继续进行。 (4)Ⅰ中反应的离子方程式为_______。 (5)某同学用 5.60g 干燥铁粉制得无水 3FeCl 样品13.00g ,该次实验的产率是_______。 (6)实验室中还常用 2SOCl 与 3 2FeCl 6H O 晶体共热制备无水 3FeCl ,其化学反应方程式为_______.检验水合 三氯化铁原料中是否存在 2FeCl 的试剂是_______。 17. 熟地吡喃酮是从中药熟地中提取的有效成分,化合物 F 是合成熟地吡喃酮的一种中间体,合成路线如 图所示。 8 已知: 回答下列问题: (1)F 中含氧官能团的名称是_______。 (2)A→B 的反应类型为_______。 (3)C 的核磁共振氢谱有_______组吸收峰。 (4)D的结构简式是_______。 (5)E 和 F_______同分异构体(填“是”或“不是”)。 (6)化合物 是合成抗菌药磺胺甲 唑的一种中间体,写出以乙二酸和丙酮 ( )为原料合成该化合物的反应方程式_______(其他无机及有机试剂任选)。 18. 甲烷和水蒸气催化制氢主要有如下两个反应: ① 4 2 2CH (g)+H O(g)=CO(g)+3H (g) ΔH=+206kJ/mol ② 2 2 2CO(g)+H O(g)=CO (g)+H (g) ΔH=-41kJ/mol 恒定压强为100kPa 时,将 n(CH4)∶n(H2O)=1∶3 的混合气体投入反应器中,平衡时,各组分的物质的量分 数与温度的关系如图所示。 9 回答下列问题: (1)写出 4CH 与 2CO 生成 2H 和 CO 的热化学方程式:_______。 (2)关于甲烷和水蒸气催化制氢反应,下列叙述正确的是_______(填标号)。 A.恒温、恒容条件下,加入惰性气体,压强增大,反应速率加快 B.恒温、恒容条件下,加入水蒸气,活化分子百分数增大,反应速率加快 C.升高温度,活化分子百分数增大,有效碰撞频率增大,反应速率加快 D.加入合适的催化剂,降低反应温度也能实现单位时间转化率不变 (3)系统中 2H 的含量,在 700℃左右出现峰值,试从化学平衡的角度解释出现峰值的原因: ①低于 700℃,_______; ②高于 700℃,_______。 (4)已知投料比为 n(CH4)∶n(H2O)=1∶3 的混合气体,p=100kPa 。600℃时, 4CH 的平衡转化率为_______, 反应①的平衡常数的计算式为 pK = _______( pK 是以分压表示的平衡常数,分压=总压×物质的量分数)。 19. 某化学兴趣小组通过查阅文献,设计了从某厂阳极泥(成分为 Cu、Ag2Se、Au、Pt)中回收贵重金属的工 艺,其流程如图所示。 10 回答下列问题: (1)写出“焙烧”时,生成 2SeO 的化学反应方程式_______。 (2)“滤液”中的金属阳离子有_______;“酸浸氧化”中通入氧气的目的是_______、_______。 (3)“酸溶”时 Pt、Au 分别转化为 2- 6PtCl 和 - 4AuCl ,写出 Au 溶解的离子方程式_______。 (4)可从“有机层”回收的金属是_______。实验室“萃取分液”的玻璃仪器有_______、_______。 (5)电解 4 3 2NH Au SO 溶液回收 Au 的阴极反应式为_______。 11 2021 年湖北省普通高中学业水平选择性模拟演练 化学 本试卷共 10 页,19 题。全卷满分 100 分。用时 75 分钟。 注意事项: 1.答题前,先将自己的姓名、准考证号、考场号、座位号填写在试卷和答题卡上,并将准考证 号条形码粘贴在答题卡上的指定位置。 2.选择题的作答:每小题选出答案后,用 2B 铅笔把答题卡上对应题目的答案标号涂黑.写在试 卷、草稿纸和答题卡上的非答题区域均无效。 3.非选择题的作答:用黑色签字笔直接答在答题卡上对应的答题区域内.写在试卷、草稿纸和 答题卡上的非答题区域均无效。 4.结束后,请将本试卷和答题卡一并上交。 可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 F 19 Mg 24 Si 28 S 32 Cl 35.5 Fe 56 Ni59 一、选择题:本题共 15 小题,每小题 3 分,共 45 分.在每小题给出的四个选项中,只有一项 是符合题目要求的。 1. 科学佩戴口罩对防控新冠病毒疫情有重要作用,生产一次性医用口罩的主要原料为聚丙烯树脂。下列说 法错误的是( ) A. 聚丙烯结构简式为 B. 由丙烯合成聚丙烯的反应类型为缩聚反应 C. 聚丙烯为热塑性合成树脂 D. 聚丙烯在自然环境中不容易降解 【答案】B 【解析】 【分析】 【详解】A.聚丙烯由丙烯(CH2=CHCH3)通过加聚反应制得,结构简式为 ,A 正确; B.聚丙烯由丙烯(CH2=CHCH3)通过加聚反应制得,B 错误; C.由聚丙烯的结构可知聚丙烯为线型结构,具有热塑性,C 正确; D.聚丙烯结构中化学键为单键,不易被氧化、不能水解,因此聚丙烯在自然环境中不容易降解,D 正确; 答案选 B。 12 2. 14 6 C的衰变反应为 14 14 0 6 z -1C X+ e ,其半衰期(反应物的量被消耗到其初始量的一半需要的时间)为 5730 年。下列说法正确的是( ) A. 14 6 C与 14 z X 互为同位素 B. 14 6 C与 14 z X 的中子数相同 C. 12 6 C和 14 6 C的价层轨道电子数相差 2 D. 某考古样品中 14 6 C的量应为其 11460 年前的 1 4 【答案】D 【解析】 【分析】 由 14 14 0 6 z -1C X+ e ,可知 z=7,X 为 N,因此 14 14 0 6 7 -1C N+ e 。 【详解】A.z=7, 14 6 C与 14 z X 质子数不相同,不互为同位素,A 错误; B. 14 6 C与 14 z X 的中子数分别为 14-6=8、14-7=7,中子数不同,B 错误; C. 12 6 C和 14 6 C的核外电子数均为 6,核外电子排布相同,价层轨道电子数相同,C 错误; D.根据半衰期的定义,某考古样品中 14 6 C的量应为其 5730 年前的 1 2 ,为 5730×2=11460 年前的 1 4 ,D 正确; 答案选 D。 3. AN 为阿伏加德罗常数的值。下列说法正确的是( ) A. 21molH S 分子中,S 原子的价层电子对数目为 A4N B. 标准状况下, 2.24L 环己烷的分子数为 A0.1N C. -11L0.01mol L 溶液中, 和 的离子数目之和为 A0.01N D. 电极反应 - + 4 1-x 4LiFePO -xe =xLi +Li FePO ,每转移1mol 电子释放 A2N 个 +Li 【答案】A 【解析】 【分析】 13 【详解】A.H2S 中 S 的价层电子对数=2+ 6-2 1 2 =4,因此 21molH S 分子中,S 原子的价层电子对数目为 A4N , A 正确; B.标准状况下,环己烷不是气体,因此无法计算,B 错误; C. -11L0.01mol L 溶液中,根据物料守恒可知 、 、 的总物质的量为 0.01mol,因此 和 的离子数目之和小于 A0.01N ,C 错误; D.由 - + 4 1-x 4LiFePO -xe =xLi +Li FePO 可知,每转移 xmol 电子,释放 xmolLi+,因此每转移1mol 电子释 放 AN 个 +Li ,D 错误; 答案选 A。 4. 不能正确表示下列反应的离子方程式是( ) A. 将少量溴水滴入过量 2 3Na SO 溶液中: 2- - + 2- 2 2 3 4Br +H O+SO =2Br +2H +SO B. 将足量 2 4 3Fe SO 溶液滴入 2Mg(OH) 浊液中: 3 2 2 32Fe 3Mg(OH) 2Fe(OH) 3Mg C. 将过量 2SO 通入 2K S 溶液中: 2 2 2 35SO 2S 2H O 3S 4HSO D. 将葡萄糖溶液与足量银氨溶液共热: + - 2 4 3 2CH OH(CHOH) CHO+2 Ag NH +2OH Δ - + - 2 4 4 3 2CH OH(CHOH) COO +NH +2Ag +3NH +H O 【答案】A 【解析】 【分析】 【详解】A. 2 3Na SO 过量,溴和亚硫酸根发生氧化还原反应生成的 H+和过量的 2- 3SO 反应生成 H2O 和 SO2, 反应的离子方程式为 2- - 2- 2 3 2 3 4Br +3SO +H O=2Br +2HSO +SO ,A 错误; B.氢氧化铁的溶度积远远小于氢氧化镁的溶度积,因此氢氧化镁能转换为氢氧化铁,即将足量 2 4 3Fe SO 溶液滴入 2Mg(OH) 浊液中: 3 2 2 32Fe 3Mg(OH) 2Fe(OH) 3Mg ,B 正确; 14 C.将过量 2SO 通入 2K S 溶液中,二氧化硫和硫离子发生氧化还原反应生成硫和亚硫酸氢钾,反应的离子方 程式为 2 2 2 35SO 2S 2H O 3S 4HSO ,C 正确; D.葡萄糖中的醛基能被银氨溶液氧化,发生银镜反应,反应的离子方程式为 + - 2 4 3 2CH OH(CHOH) CHO+2 Ag NH +2OH Δ - + 2 4 4 3 2CH OH(CHOH) COO +NH +2Ag +3NH +H O ,D 正确; 答案选 A。 5. 短周期元素 W、X、Y 和 Z 的原子序数依次增大。W 是宇宙中最丰富的元素, 2W X 是维持生命过程的 必需物质,WY 可用于玻璃的刻蚀, 2ZX 是酸雨的主要形成原因之一,室温下化合物 4ZY 是气体。下列说 法错误的是( ) A. Y 的第一电离能在四种元素中最大 B. 2W X 和 2ZX 的中心原子分别为 3sp 和 2sp 杂化 C. 2W X 的沸点高于 2W Z 的沸点 D. 4ZY 分子中原子均为 8 电子结构 【答案】D 【解析】 【分析】 W 是宇宙中最丰富的元素,则 W 是 H; 2W X 是维持生命过程的必需物质,则 X 为 O;WY 可用于玻璃的 刻蚀,则 WY 为 HF,Y 为 F; 2ZX 是酸雨的主要形成原因之一,且 Z 的原子序数比 Y 大,则 Z 为 S;综 上所述,W、X、Y 和 Z 分别为 H、O、F、S,据此解答。 【详解】A.一般规律:非金属性越强,第一电离能越大,第ⅡA 族、第ⅤA 族元素的第一电离能比同周期 相邻元素大,因此 F 的第一电离能在四种元素中最大,A 正确; B.H2O 中 O 的价层电子对数为 2+ 6-2 1 2 =4,SO2 中 S 的价层电子对数为 2+ 6-2 2 2 =3,因此 H2O 和 SO2 的中心原子分别为 3sp 和 2sp 杂化,B 正确; C.O 和 S 属于同主族元素,但 H2O 分子间存在氢键,而 H2S 分子间不存在氢键,因此 H2O 的沸点高于 H2S 的沸点,C 正确; D.SF4 中,S的最外层电子数为 10,D 错误; 答案选 D。 6. 最新文献报道,有机小分子可催化多氟芳烃的取代反应,机理如图所示。 15 下列说法错误的是( ) A. 2 是催化剂 B. 4 和 7 都是反应中间体 C. 2 向 4 的转化过程中有非极性键与极性健的断裂与形成 D. 5 为 时,1 是 【答案】C 【解析】 【分析】 分析图可知反应历程为:2+3→4,4+5→6+7,7→1+2,总反应为:3+5→7,2 是催化剂,4 和 7 是反应中间 体。 【详解】A.由分析可知,2 是催化剂,A 正确; B.由分析可知,4 和 7 都是反应中间体,B 正确; C.由图可知,2 向 4 的转化过程中有碳氟键断裂,有碳氮键形成,即有极性键的断裂和形成,无非极性键 的断裂与形成,C 错误; D.5 到 1 的总变化为 4 中-NO2 对位的 C 上的原子团被 X 取代,若 5 为 ,则 X 为 , 则 1 是 ,D 正确; 答案选 C。 16 7. 关于有机化合物 ,下列说法错误的是( ) A. 分子式为 14 18 2C H O B. 含有 2 个手性碳原子 C. 可与热的新制氢氧化铜悬浊液反应 D. 该有机物的同分异构体中无芳香族化合物 【答案】D 【解析】 【分析】 【详解】A.由结构式可知该有机物分子式为 14 18 2C H O ,A 正确; B.含有 2 个手性碳原子,如图 ,B 正确; C.该有机物含醛基,可与热的新制氢氧化铜悬浊液反应,C 正确; D.该分子的不饱和度为 6,苯环不饱和度为 4,则该有机物的同分异构体中一定有芳香族化合物,D 错误; 答案选 D。 8. 下列实验操作或装置正确的是( ) A B C D 蒸发除去苯甲酸中的乙醇 除去水中的苯酚 实验室纯化工业乙酸乙酯 用氢氧化钠溶液滴定醋酸溶液 17 A. A B. B C. C D. D 【答案】C 【解析】 【分析】 【详解】A.蒸发多用于固液分离,乙醇和苯甲酸为液液分离,苯甲酸沸点高于乙醇的沸点,应该应用蒸馏 的方法,故 A 错误; B.苯酚微溶于水,水中苯酚形成乳浊液,故不能用过滤分离,故 B 错误; C.杂质沸点低于乙酸乙酯采用蒸馏的方法纯化效果更好,装置无错误,故 C 正确; D.氢氧化钠溶液为碱性,应该用碱式滴定管而不是酸式滴定管,故 D 错误; 故选 C。 9. B 和 Al 为同族元素,下列说法错误的是( ) A. 3BF 和 3AlF 都可以与 -F 形成配位键 B. 3 3H BO 为三元酸, 3Al(OH) 呈两性 C. 共价键的方向性使晶体 B 有脆性,原子层的相对滑动使金属 Al 有延展性 D. B 和 Al 分别与 N 形成的共价晶体,均具有较高硬度和熔点 【答案】B 【解析】 【分析】 【详解】A. 3BF 和 3AlF 中 B 和 Al 均有空轨道, -F 有孤电子,因此 3BF 和 3AlF 都可以与 -F 形成配位键,A 正确; B. 3 3H BO 为一元弱酸, 3Al(OH) 为两性氢氧化物,具有两性,B 错误; C.晶体 B 为共价晶体,共价键的方向性使晶体 B 有脆性,Al 为金属晶体,原子层的相对滑动使金属 Al 有延展性,C 正确; D.B 和 Al 分别与 N 通过共价键形成共价晶体,共价晶体具有较高硬度和熔点,D 正确; 答案选 B。 10. 研究发现,在酸性乙醇燃料电池中加入硝酸,可使电池持续大电流放电,其工作原理如图所示。 18 下列说法错误的是( ) A. 加入 3HNO 降低了正极反应的活化能 B. 电池工作时正极区溶液的 pH 降低 C. 3 21molCH CH OH 被完全氧化时有 23molO 被还原 D. 负极反应为 - + 3 2 2 2CH CH OH+3H O-12e =2CO +12H 【答案】B 【解析】 【分析】 乙醇燃料电池中,通入乙醇的一极为负极,电极反应式为 - + 3 2 2 2CH CH OH+3H O-12e =2CO +12H ,通入 氧 气 的 一 极 为 正 极 , 由 工 作 原 理 图 可 知 , 正 极 发 生 反 应 - + 3 2HNO +3e +3H =NO +2H O , 2 2 34NO+3O +2H O=4HNO ,二者加合可得 - + 2 2O +4e +4H =2H O ,则 3HNO 在正极起催化作用,据此分 析解答。 【详解】A. 由分析知, 3HNO 在正极起催化作用,作催化剂,则加入 3HNO 降低了正极反应的活化能, 故 A 正确; B. 电池工作时正极区的总反应为 - + 2 2O +4e +4H =2H O ,则溶液中氢离子浓度减小,pH 增大,故 B 错误; C. 根据得失电子守恒可知, 3 21molCH CH OH 被完全氧化时,转移 12mol 电子,则有 23molO 被还原, 故 C 正确; D. 由分析知,负极反应为 - + 3 2 2 2CH CH OH+3H O-12e =2CO +12H ,故 D 正确; 故选 B。 11. 下列实验的现象描述和结论都正确的是( ) 19 实验操作 实验现象 实验结论 A 将水滴入盛有 2 2Na O 固体的试管中,立即把带 火星的木条放在试管口 可观察到有气泡产生,木 条复燃 2 2Na O 固体遇水产生 2O B 向盛有 10 滴 1 30.1mol L AgNO 溶液的试管中 滴加 10.1mol L KCl 溶液至不再生成沉淀后, 再向其中滴加 -10.1mol L KI 溶液 先观察到白色沉淀,后沉 淀颜色变为黄色 sp sp(AgCl) (AgI)K K< C 向两支盛有少量溴的四氯化碳溶液的试管中分 别加入适量苯和通入足量乙烯 溶液均褪色 溴与苯和乙烯都能发生 反应 D 向两支盛有 1 44mL0.01mol L KMnO 溶液的 试管中分别加入 12mL0.1mol L 和 1 2 2 42mL0.2mol L H C O 溶液 前者比后者褪色快 其他条件不变,反应物浓 度增加,反应速率增大 A. A B. B C. C D. D 【答案】A 【解析】 【分析】 【详解】A. 2 2Na O 与水反应生成氢氧化钠和氧气,将水滴入盛有 2 2Na O 固体的试管中,立即把带火星 的木条放在试管口,可观察到有气泡产生,木条复燃,证明 2 2Na O 固体遇水产生了 2O ,故 A 正确; B. 向盛有 10 滴 1 30.1mol L AgNO 溶液的试管中滴加 10.1mol L KCl 溶液,生成 AgCl 白色沉淀,至不 再生成沉淀后,再向其中滴加 -10.1mol L KI 溶液,可观察到白色沉淀转化为黄色沉淀,即生成了 AgI,证 明 AgI 比 AgCl 更难溶,则 sp sp(AgCl) (AgI)K K> ,故 B 错误; C. 苯不与溴发生反应,则加入苯的溴的四氯化碳溶液不会褪色,故 C 错误; D. 向两支盛有 1 44mL0.01mol L KMnO 溶液的试管中分别加入 12mL0.1mol L 和 20 1 2 2 42mL0.2mol L H C O 溶液,前者草酸的浓度小,反应速率慢,褪色时间长,故 D 错误; 故选 A。 12. 在碱性溶液中, 2+Cu 可以与缩二脲形成紫色配离子,其结构如图所示。 下列说法错误的是( ) A. 该配离子与水分子形成氢键的原子只有 N 和 O B. 该配离子中铜离子的配位数是 4 C. 基态 Cu 原子的价电子排布式是 10 13d 4s D. 该配离子中非金属元素的电负性大小顺序为 O>N>C>H 【答案】A 【解析】 【分析】 【详解】A.根据其结构可知,该配离子中的 N 和 O 可与水分子中的 H 形成氢键,而水分子中的 O 也可与 配离子中的 H 形成氢键,A 错误; B.根据配离子的结构可知,铜离子的配位数为 4,B 正确; C.根据铜原子的电子排布式可知,基态 Cu 原子的价电子排布式是 10 13d 4s ,C 正确; D.根据同一周期,主族元素的电负性从左到右逐渐增大,同一主族,元素的电负性从上到下呈现减小的趋 势,非金属元素电负性大小排列顺序可知,该配离子中非金属元素的电负性大小顺序为 O>N>C>H ,D 正 确; 故选 A。 13. 已知 x 1-xNi Mg O 晶体属立方晶系,晶胞边长 a。将 +Li 掺杂到该晶胞中,可得到一种高性能的 p 型太阳 能电池材料,其结构单元如图所示。 21 假定掺杂后的晶胞参数不发生变化,下列说法正确的是( ) A. 该结构单元中 O 原子数为 3 B. Ni 和 Mg 间的最短距离是 2 a2 C. Ni 的配位数为 4 D. 该物质的化学式为 0.5 1.12 2.38 4Li Mg Ni O 【答案】B 【解析】 【分析】 【详解】A.由均摊法可知该结构单元中 O 原子数=1+12× 1 4 =4,A 错误; B.由图可知,Ni 和 Mg 间的最短距离为晶胞面对角线的一半,即 2 21 (a +a )2 = 2 a2 ,B 正确; C.由晶胞可知 Ni 的配位数为 6,C 错误; D.1 个晶胞中 Li 的个数=1×0.5=0.5,Mg 的个数=2×0.5+1× 1 8 =1.125,Ni 的个数=7× 1 8 +3×0.5=2.375,O 的 个数=4,因此该物质的化学式为 0.5 1.125 2.375 4Li Mg Ni O ,D 错误; 答案选 B。 14. 水泥是人类最伟大的发明之一,主要成分为硅酸三钙(3CaO∙SiO2)。将其与适量的水反应,形成相互交 联的结构,反应式如下 2(3CaO∙SiO2)+6H2O=3CaO∙2SiO2∙3H2O+3Ca(OH)2 ∆H<0。但是,需要避免交联过程 热膨胀及产生的水蒸气在建筑结构中造成空隙。我国三峡大坝的建设者在全世界首创了以冰代水的浇灌方 法,有效解决了这一问题,保证了大坝建筑质量。下列说法错误的是( ) A. 水泥由黏土和石灰石等研磨、煅烧制得 B. 水泥生产过程中加入石膏,可以调节水泥的硬化速率 C. 水的作用是提供结晶水以稳定交联结构 D. 以冰代水的优点是减少了热膨胀及水蒸气的产生 22 【答案】C 【解析】 【分析】 【详解】A.水泥由石灰石和粘土等混合,经高温煅烧制得,A 说法正确; B.水泥生产过程中加入石膏的目的是为了调节水泥的凝结硬化速度,调整水泥的凝结时间,B 说法正确; C.水与硅酸三钙(3CaO∙SiO2)发生化学反应,生成的产物形成相互交联的结构,C 说法错误; D.硅酸三钙(3CaO∙SiO2)与水反应放热,以冰代水减少了热膨胀及水蒸气产生的气泡,保证建筑质量,D 说 法正确; 答案为 C。 15. 25℃时,按下表配制两份溶液. 一元弱酸溶液 加入的 NaOH 溶液 混合后所得溶液 1HA 10.0mL0.20mol L 15.0mL0.20mol L 溶液Ⅰ pH=5.0 1HB10.0mL0.20mol L 15.0mL0.20mol L 溶液Ⅱ pH=4.0 下列说法错误的是( ) A. 溶液Ⅰ中, - + + -c A >c Na >c H >c OH B. Ⅰ和Ⅱ的 pH 相差 1.0,说明 a a K (HA) =10K (HB) C. 混合Ⅰ和Ⅱ: + + - - -c Na +c H =c A +c(B )+c(OH ) D. 混合Ⅰ和Ⅱ: c(HA)>c(HB) 【答案】B 【解析】 【分析】 根据酸碱用量可知溶液Ⅰ为等浓度的 HA 和 NaA 混合溶液,溶液Ⅱ为 HB 和 NaB 的混合溶液,且溶液Ⅰ和 溶液Ⅱ中 HA、NaA、HB、NaB 的浓度相等。 【详解】A.由电荷守恒可知溶液Ⅰ中 + + - -c Na +c H =c OH +c A ,pH=5.0,则 + -c H c OH> , 因此 - + + -c A >c Na >c H >c OH ,A 正确; 23 B.溶液Ⅰ的 pH=5.0 ,溶液Ⅱ的 pH=4.0 ,则 HB 的电离常数大于 HA 的电离常数, a a K (HA) 1 10K (HB) < < ,B 错误; C.由电荷守恒可知混合Ⅰ和Ⅱ有 + + - - -c Na +c H =c A +c(B )+c(OH ) ,C 正确; D.由于 HB 的电离常数大于 HA 的电离常数,则混合Ⅰ和Ⅱ后有: c(HA)>c(HB) ,D 正确; 答案选 B。 二、非选择题:本题共 4 小题,共 55 分。 16. 无水 3FeCl 是常用的芳香烃取代反应催化剂,它具有易水解、易升华的性质。铁粉与氯气反应制备无水 3FeCl 的实验装置如图所示: E 和 G 用来收集产物。回答下列问题: (1)通入氯气后,A 中观察到有酸雾产生,C 中 2 5P O 的作用是_______。 (2)在 E、G 处收集产物是利用了 3FeCl _______的性质。 (3)实验过程中若 F 处出现堵塞,则在 B 处可观察到的现象是_______。可通过_______(填简单操作),使实 验能继续进行。 (4)Ⅰ中反应的离子方程式为_______。 (5)某同学用 5.60g 干燥铁粉制得无水 3FeCl 样品13.00g ,该次实验的产率是_______。 (6)实验室中还常用 2SOCl 与 3 2FeCl 6H O 晶体共热制备无水 3FeCl ,其化学反应方程式为_______.检验水合 三氯化铁原料中是否存在 2FeCl 的试剂是_______。 【答案】 (1). 除去酸雾 (2). 易升华 (3). B 处有气泡产生 (4). 适当加热 F 处 (5). Cl2+2OH-=Cl-+ClO-+H2O (6). 80.00% (7). 3 2FeCl 6H O +6SOCl2=FeCl3+12HCl+6SO2 (8). 铁氰化 钾 【解析】 24 【分析】 潮湿的氯气通过浓硫酸时,水与浓硫酸相遇放出大量的热使三氧化硫逸出,三氧化硫遇到瓶内的空气中水 蒸气形成酸雾,C 中五氧化二磷的作用是除去酸雾,干燥的氯气和铁粉在 D 中反应生成氯化铁,因氯化铁 易升华,到达 E、G 后重新凝华收集得到氯化铁,反应不完的氯气用 I 中 NaOH 溶液吸收,H 中无水氯化钙 防止 I 中水蒸气进入 G 中使氯化铁水解。 【详解】(1)由分析可知,C 中 2 5P O 的作用是除去酸雾; (2)在 E、G 处收集产物是利用了 3FeCl 易升华的性质; (3)实验过程中若 F 处出现堵塞,则氯气将到达 B 处,看到有气泡产生,然后进入 NaOH 溶液中与 NaOH 反 应;氯化铁易升华,则可通过适当加热 F 处,使实验能继续进行; (4)Ⅰ中未反应完的氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,反应的离子方程式为 Cl2+2OH-=Cl-+ClO-+H2O; (5)由 2Fe+3Cl2 Δ 2FeCl3 可知,每 2molFe 反应生成 2mol FeCl3,则 5.60g(0.1mol)干燥铁粉理论上可制得 0.1molFeCl3,质量为 0.1mol×162.5g/mol=16.25g,因此该次实验的产率是 13.00g 100%16.25g =80.00%; (6)若直接加热 3 2FeCl 6H O ,氯化铁会水解得氢氧化铁和 HCl,HCl 挥发,促进氯化铁水解,最终得到氢氧 化铁,实验室中常用 2SOCl 与 3 2FeCl 6H O 晶体共热制备无水 3FeCl ,说明该过程产生了 HCl 抑制了氯化铁 水解,结合原子守恒可知该反应的化学方程式为 3 2FeCl 6H O +6SOCl2=FeCl3+12HCl+6SO2;亚铁离子与铁氰 化钾相遇产生蓝色沉淀,因此检验水合三氯化铁原料中是否存在 2FeCl 的试剂是铁氰化钾溶液。 17. 熟地吡喃酮是从中药熟地中提取的有效成分,化合物 F 是合成熟地吡喃酮的一种中间体,合成路线如 图所示。 25 已知: 回答下列问题: (1)F 中含氧官能团的名称是_______。 (2)A→B 的反应类型为_______。 (3)C 的核磁共振氢谱有_______组吸收峰。 (4)D 的结构简式是_______。 (5)E 和 F_______同分异构体(填“是”或“不是”)。 (6)化合物 是合成抗菌药磺胺甲 唑的一种中间体,写出以乙二酸和丙酮 ( )为原料合成该化合物的反应方程式_______(其他无机及有机试剂任选)。 【答案】 (1). 醚键、羟基 (2). 酯化(取代)反应 (3). 6 (4). (5). 是 (6). CH3CH2OH 与 HOOCCOOH Δ浓硫酸 CH3CH2OOCCOOCH2CH3 与 2 (1)NaH (2)H O 【解析】 【分析】 C 与 CH3-COCl 发生已知的反应,结合 F 的结构简式,可知 CH3-CO-取代 C 中醚键相邻碳原子上的氢原子, 26 则 D 为 。 【详解】(1)根据 F 的结构简式,含氧官能团的名称是醚键、羟基; (2)A→B 为 A 与甲醇在浓硫酸加热的条件下发生酯化反应,反应类型为酯化(取代)反应; (3)C 为对称结构 ,其中 C2H5-有 2 组氢原子,-OCH3 有 1 组,苯环上 1 组,-CH2COOCH3 有 2 组氢原子,核磁共振氢谱有 6 组; (4)D 的结构简式为 ; (5)E 和 F 的分子式均为 C14H16O4,其结构不同,互为同分异构体; (6)生成化合物 ,需要 与乙二酸二乙酯反应制取,乙二酸二乙酯则需要乙二 酸与足量的乙醇反应制取,流程为 CH3CH2OH 与 HOOCCOOH Δ浓硫酸 CH3CH2OOCCOOCH2CH3 与 2 (1)NaH (2)H O 。 18. 甲烷和水蒸气催化制氢主要有如下两个反应: ① 4 2 2CH (g)+H O(g)=CO(g)+3H (g) ΔH=+206kJ/mol ② 2 2 2CO(g)+H O(g)=CO (g)+H (g) ΔH=-41kJ/mol 恒定压强为100kPa 时,将 n(CH4)∶n(H2O)=1∶3 的混合气体投入反应器中,平衡时,各组分的物质的量分 数与温度的关系如图所示。 27 回答下列问题: (1)写出 4CH 与 2CO 生成 2H 和 CO 的热化学方程式:_______。 (2)关于甲烷和水蒸气催化制氢反应,下列叙述正确的是_______(填标号)。 A.恒温、恒容条件下,加入惰性气体,压强增大,反应速率加快 B.恒温、恒容条件下,加入水蒸气,活化分子百分数增大,反应速率加快 C.升高温度,活化分子百分数增大,有效碰撞频率增大,反应速率加快 D.加入合适的催化剂,降低反应温度也能实现单位时间转化率不变 (3)系统中 2H 的含量,在 700℃左右出现峰值,试从化学平衡的角度解释出现峰值的原因: ①低于 700℃,_______; ②高于 700℃,_______。 (4)已知投料比为 n(CH4)∶n(H2O)=1∶3 的混合气体,p=100kPa 。600℃时, 4CH 的平衡转化率为_______, 反应①的平衡常数的计算式为 pK = _______( pK 是以分压表示的平衡常数,分压=总压×物质的量分数)。 【答案】 (1). 4 2 2CH (g)+CO (g)=2CO(g)+2H (g) ΔH=247kJ/mol (2). C (3). 由于正反应方向吸 热,随着温度的升高,反应向正反应方向进行的程度较大,氢气的物质的量逐渐增大 (4). 随着反应的 进行,一氧化碳的物质的量增大,发生反应②,反应②正反应放热,当温度升高时,平衡逆向移动,使氢 气的物质的量减小 (5). 77.78% (6). 5859.375 【解析】 28 【分析】 【详解】(1)① 4 2 2CH (g)+H O(g)=CO(g)+3H (g) ΔH=+206kJ/mol ② 2 2 2CO(g)+H O(g)=CO (g)+H (g) ΔH=-41kJ/mol 根据盖斯定律,①-②,ΔH=+206kJ/mol+41kJ/mol=247kJ/mol,得到 4CH 和 2CO 生成 2H 和 CO 的热化学方 程式: 4 2 2CH (g)+CO (g)=2CO(g)+2H (g) ΔH=247kJ/mol; (2)由反应 4 2 2CH (g)+H O(g)=CO(g)+3H (g) ΔH=+206kJ/mol; A.恒温、恒容条件下,加入惰性气体,总压强增大,各物质的分压不变,各气体的浓度没变,化学反应速 率不变,故 A 不符合题意; B.恒温、恒容条件下,加入水蒸气,活化分子百分数不变,单位体积活化分子数增加,有效碰撞几率增大, 反应速率加快,故 B 不符合题意; C.升高温度,活化分子百分数增大,有效碰撞频率增大,反应速率加快,故 C 符合题意; D.反应为吸热反应,加入合适的催化剂,缩短达到平衡的时间,但不影响平衡的移动,单位时间内气体的 转化率不变;降低反应温度,平衡逆向移动,单位时间内气体的转化率减小,故 D 不符合题意; 答案选 C; (3)①温度低于 700℃时,由于正反应方向吸热,随着温度的升高,反应向正反应方向进行的程度较大,氢 气的物质的量逐渐增大; ②温度高于 700℃,随着反应的进行,一氧化碳的物质的量增大,发生反应②,反应②正反应放热,当温度 升高时,平衡逆向移动,使氢气的物质的量减小; (4)已知投料比为 4 2n(CH ):n(H O)=1:3 的混合气体,设甲烷的初始物质的量为 1mol,水蒸气的物质的量为 3mol,设转化的甲烷的物质的量为 x,设转化的一氧化碳的物质的量为 y, 4 2 2 (mol) 1 3 0 0 CH (g) + H (mo O(g) CO(g) + 3H l) x x x 3x (mol) 1-x 3-x x g 3x ( ) 开始 变化 平衡 2 2 2CO(g) + H O(g) CO (g) + H (g) (mol) x 3-x 0 3x (mol) y y y y (mol) x-y 3-x-y y 3x+y 开始 变化 平衡 由图可知,600℃时,CH4 的物质的量分数为 0.04,各气体的总物质的量为 1-x+3-x-y+x+3x+y=4+2x, 29 1-x 1-x+3-x+x+3x = 1-x 4+2x =0.04,解得 x= 7 9 mol, 4CH 的平衡转化率为 7 mol9 1mol ×100%=77.78%; 600℃时,由图可知,p=100kPa ,平衡时 H2 的物质的量分数为 0.50,可以得到: 21+y9 50 9 =0.5,解得 y= 4 9 mol, 平衡时 CO 的物质的量= 7 9 mol- 4 9 mol= 1 3 mol,CO 的物质的量分数为 1 3 50 9 =0.06,CH4 的物质的量分数为 0.04, H2O 的物质的量分数为 0.32,H2 的物质的量分数为 0.50,反应①的平衡常数的计算式为 Kp= 3 2 2 4 p (H )p(CO) p(H O)p(CH ) = 3(100 0.5) (100 0.06) (100 0.32) (100 0.04) =5859.375。 19. 某化学兴趣小组通过查阅文献,设计了从某厂阳极泥(成分为 Cu、Ag2Se、Au、Pt)中回收贵重金属的工 艺,其流程如图所示。 回答下列问题: (1)写出“焙烧”时,生成 2SeO 的化学反应方程式_______。 (2)“滤液”中的金属阳离子有_______;“酸浸氧化”中通入氧气的目的是_______、_______。 (3)“酸溶”时 Pt、Au 分别转化为 2- 6PtCl 和 - 4AuCl ,写出 Au 溶解的离子方程式_______。 (4)可从“有机层”回收的金属是_______。实验室“萃取分液”的玻璃仪器有_______、_______。 (5)电解 4 3 2NH Au SO 溶液回收 Au 的阴极反应式为_______。 【答案】 (1). 2Ag2Se+3O2=2 2SeO +2Ag2O (2). Cu2+、Ag+ (3). 氧化可能存在的 Cu、 2SeO (4). 防止硝酸产生的 NO 排放到空气中污染空气 (5). 2Au+3Cl2+2Cl-=2 - 4AuCl (6). Pt (7). 烧杯 (8). 分液漏斗 (9). Au3++3e-=Au 【解析】 【分析】 30 阳极泥(成分为 Cu、Ag2Se、Au、Pt)通入氧气焙烧得 CuO、Ag2O、SeO2、Au、Pt,Se 以 SeO2 形式除去,烧 渣成分为 CuO、Ag2O、Au、Pt;将烧渣酸浸氧化,CuO、Ag2O 溶解,滤液为硝酸铜、硝酸银溶液,滤渣为 Au、Pt;酸溶时,Au、Pt 转化为[AuCl4]-、[PtCl6]2-,用磷酸三丁酯萃取-分液,得到 H2[PtCl6]的有机溶液, 水层为 H[AuCl4]-(aq),加入 KOH、(NH4)2SO3 转化为 NH4[Au(SO3)2]。 【 详 解 】 (1)“ 焙 烧 ” 时 , Ag2Se 被 氧 气 氧 化 生 成 2SeO 和 Ag2O , 反 应 的 化 学 反 应 方 程 式 为 2Ag2Se+3O2=2 2SeO +2Ag2O; (2)由分子可知“滤液”中的金属阳离子有 Cu2+、Ag+;烧渣中可能还含有 Cu、 2SeO ,与硝酸直接反应会产生 NO 有毒气体,因此“酸浸氧化”中通入氧气的目的是氧化可能存在的 Cu、 2SeO ;防止硝酸产生的 NO 排放 到空气中污染空气; (3)“酸溶”时 Pt、Au 分别转化为 2- 6PtCl 和 - 4AuCl ,则 Au 溶解的离子方程式为 2Au+3Cl2+2Cl-=2 - 4AuCl ; (4)由分析可知,可从“有机层”回收的金属是 Pt;实验室“萃取分液”的玻璃仪器有烧杯;分液漏斗; (5)电解 4 3 2NH Au SO 溶液回收 Au 的阴极反应式为 Au3++3e-=Au。查看更多