- 2021-05-13 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学实验综合大题解析
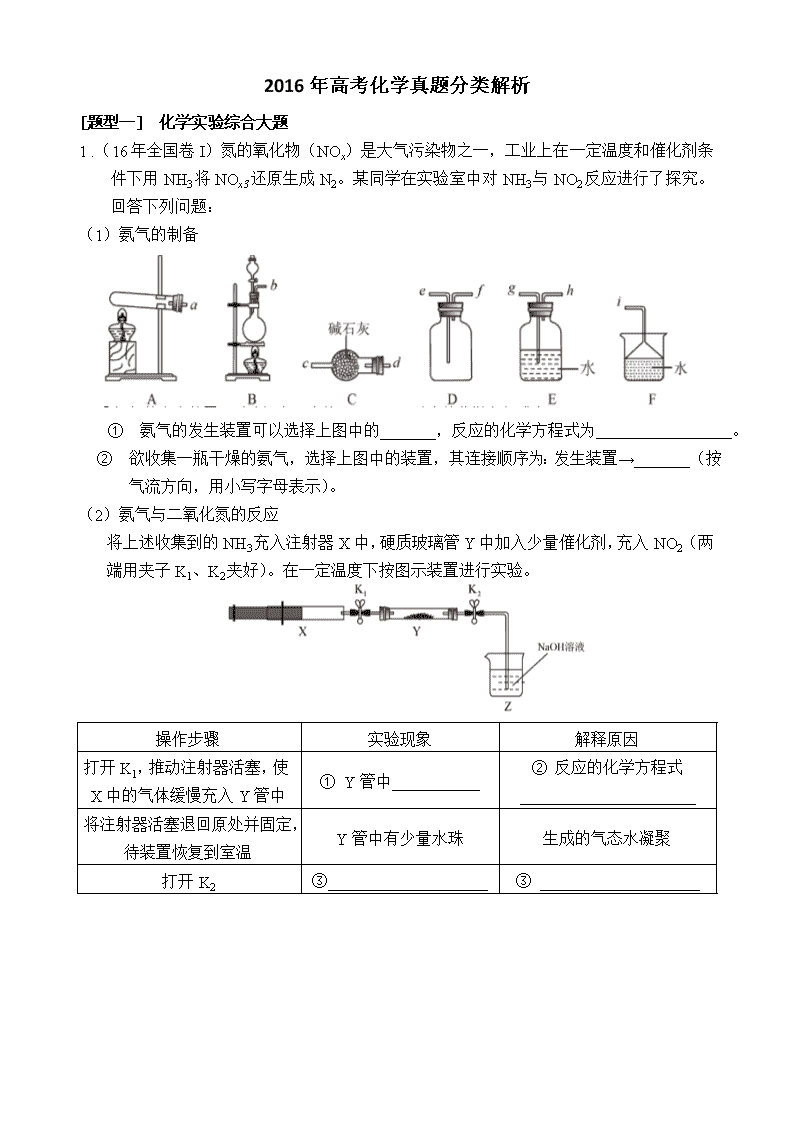
2016年高考化学真题分类解析 [题型一] 化学实验综合大题 1 .(16年全国卷I)氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx3还原生成N2。某同学在实验室中对NH3与NO2反应进行了探究。回答下列问题: (1)氨气的制备 ① 氨气的发生装置可以选择上图中的 _______,反应的化学方程式为 。 ② 欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→_______(按气流方向,用小写字母表示)。 (2)氨气与二氧化氮的反应 将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。 操作步骤 实验现象 解释原因 打开K1,推动注射器活塞,使X中的气体缓慢充入Y管中 ① Y管中___________ ② 反应的化学方程式 ______________________ 将注射器活塞退回原处并固定,待装置恢复到室温 Y管中有少量水珠 生成的气态水凝聚 打开K2 ③____________________ ③ ____________________ 2 .(16年全国卷II)某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题: (1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol/L 的溶液。在FeCl2溶液中需加入少量铁屑,其目的是_____________。 (2)甲组同学取2 mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为________________。 (3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL 煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用 是_____________。 (4)丙组同学取10 ml 0.1 mol·L-1KI溶液,加入6 mL 0.1 mol·L-1 FeCl3溶液混合。分别取 2 mL 此溶液于3支试管中进行如下实验: ① 第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层显紫色; ② 第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀; ③ 第三支试管中加入1滴KSCN溶液,溶液变红。 实验②检验的离子是________(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有______(填离子符号),由此可以证明该氧化还原反应为_______。 (5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为___________________________;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成,产生气泡的原因是______________________,生成沉淀的原因是__________________________(用平衡移动原理解释)。 【答案】 3 .(16年全国卷III) 过氧化钙微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂。以下是一种制备过氧化钙的实验方法。回答下列问题: (一)碳酸钙的制备 (1)步骤①加入氨水的目的是 。小火煮沸的作用是使沉淀颗粒长大, 有利于___ 。 (2)右图是某学生的过滤操作示意图,其操作不规范的是______(填标号)。 a.漏斗末端颈尖未紧靠烧杯壁 b.玻璃棒用作引流 c.将滤纸湿润,使其紧贴漏斗壁 d.滤纸边缘高出漏斗 e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度 (二) 过氧化钙的制备 CaCO3滤液白色晶体 (3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈____性(填“酸”、“碱”或“中”)。将溶液煮沸,趁热过滤。将溶液煮沸的作用是___________。 (4)步骤③中反应的化学方程式为 ,该反应需要在冰浴下进行,原因是 。 (5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是_______。 (6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是 ,产品的缺点是 。 【答案】 4、(2016年 北京卷)以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。 实验 试剂 现象 滴管 试管 2 mL 0.2 mol·L−1 Na2SO3溶液 饱和Ag2SO4溶液 Ⅰ.产生白色沉淀 0.2 mol·L−1 CuSO4 Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 0.1 mol·L−1 Al2(SO4)3溶液 Ⅲ.开始无明显变化,继续滴加产生白色沉淀 (1)经检验,现象Ⅰ中的白色沉淀是Ag2SO3。用离子方程式解释现象Ⅰ:____________。 (2)经检验,现象Ⅱ的棕黄色沉淀中不含SO42−,含有Cu+、Cu2+和SO32−。 已知:Cu+Cu +Cu2+,Cu2+CuI↓(白色)+I2。 ① 用稀硫酸证实沉淀中含有Cu+的实验现象是_____________。 ① 通过下列实验证实,沉淀中含有Cu2+和SO32−。 ② a. 白色沉淀A是BaSO4,试剂1是____________。 b. 证实沉淀中含有Cu+和SO32−的理由是 。 (3)已知:Al2(SO3)3在水溶液中不存在。经检验,现象Ⅲ的白色沉淀中无SO42−,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色。 ① 推测沉淀中含有亚硫酸根和________。 ② 对于沉淀中亚硫酸根的存在形式提出两种假设: i. 被Al(OH)3所吸附; ii. 存在于铝的碱式盐中。对假设ii设计了对比实验,证实了假设ii成立。 a. 将对比实验方案补充完整。 步骤二:_____________(按上图形式呈现)。 (4)根据实验,亚硫酸盐的性质有___________。盐溶液间反应的多样性与________有关。 5、(2016 江苏卷)过氧化钙(CaO2·8H2O)是一种在水产养殖中广泛使用的供氧剂。 (1)Ca(OH)2悬浊液与H2O2溶液反应可制备CaO2·8H2O。 Ca(OH)2+H2O2+6H2OCaO2·8H2O 反应时通常加入过量的Ca(OH)2,其目的是_____________。 (2) 向池塘水中加入一定量的CaO2·8H2O后,池塘水中浓度增加的离子有_____ (填序号)。 A.Ca2+ B.H+ C.CO32- D.OH- (3) 水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置;加入适量稀H2SO4,待MnO(OH)2与I-完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下: O2MnO(OH)2 I2 S4O62- ① 写出O2将Mn2+氧化成MnO(OH)2的离子方程式: 。 ② 取加过一定量CaO2·8H2O的池塘水样100.00 mL,按上述方法测定水样的溶解氧, 消耗0.01000 mol·L-1 Na2S2O3标准溶液13.50 mL。计算该水样中的溶解氧(用mg·L-1表示),写出计算过程。 5、(2016 江苏卷选做)焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中、受热时均易分解。实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如下图所示。 当溶液pH约为4时,停止反应。在20℃左右静置结晶。生成Na2S2O5的化学方程式为 2NaHSO3=Na2S2O5+H2O (1) SO2与Na2CO3溶液反应生成NaHSO3和CO2,其离子方程式为____________________。 (2)装置Y的作用是______________________________。 (3)析出固体的反应液经减压抽滤、洗涤、25℃-30℃干燥,可获得Na2S2O5固体。 ① 组成减压抽滤装置的主要仪器是布氏漏斗、________________和抽气泵。 ② 依次用饱和SO2水溶液、无水乙醇洗涤Na2S2O5固体。用饱和SO2水溶液洗涤的目的是_________________。 (4)实验制得的Na2S2O5固体中含有一定量的Na2SO3 和Na2SO4,其可能的原因是______。 6、(2106上海卷)乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用a装置来制备。 完成下列填空: (1).实验时,通常加入过量的乙醇,原因是______________。加入数滴浓硫酸即能起催化作用,但实际用量多于此量,原因是_______________ ;浓硫酸用量又不能过多,原因是____________ 。 (2).饱和Na2CO3溶液的作用是_______________ 。 (3).反应结束后,将试管中收集到的产品倒入分液漏斗中,_________、________,然后分液。 (4).若用b装置制备乙酸乙酯,其缺点有__________ 、__________ 。由b装置制得的乙酸乙酯产品经饱和碳酸钠溶液和饱和食盐水洗涤后,还可能含有的有机杂质是________,分离乙酸乙酯与该杂质的方法是_______________。 【答案】 (1)增大反应物浓度,使平衡向生成酯的方向移动,提高脂的产率。(合理即给分) 浓H2SO4能吸收生成的水,使平衡向生成酯的方向移动,提高酯的产率。 浓H2SO4具有强氧化性和脱水性,会使有机物碳化,降低酯的产率。 (2)中和乙酸、溶解乙醇、减少乙酸乙酯在水中的溶解 (3)振荡、静置 (4)原料损失较大、易发生副反应 乙醚;蒸馏 7、(2016 四川卷)CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl2·2H2O制备CuCl,并进行相关探究。 【资料查阅】 【实验探究】该小组用下图所示装置进行实验(夹持仪器略)。 请回答下列问题: (1)仪器X的名称是__________。 (2)实验操作的先后顺序是a→______→c(填操作的编号) a.检查装置的气密性后加入药品 b.熄灭酒精灯,冷却 c.在“气体入口”处干燥HCl d.点燃酒精灯,加热 e.停止通入HCl,然后通入N2 (3)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是_______。 (4)装置D中发生的氧化还原反应的离子方程式是________________。 (5)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析: ① 若杂质是CuCl2,则产生的原因是_______________ ② 若杂质是CuO,则产生的原因是________________。 8、(2016 天津卷)水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg/L,我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5mg/L。某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO。 1、测定原理: 碱性体积下,O2将Mn2+氧化为MnO(OH)2:① 2Mn2++O2+4OH- = 2MnO(OH)2↓,酸性条件下,MnO(OH)2将I-氧化为I2:② MnO(OH)2+I-+H+→Mn2++I2+H2O(未配平),用Na2S2O3标准溶液滴定生成的I2,③2S2O32-+I2=S4O62-+2I- 2、测定步骤 a. 安装装置,检验气密性,充N2排尽空气后,停止充N2。 b.向烧瓶中加入200ml水样 c.向烧瓶中依次迅速加入1mlMnSO4无氧溶液(过量)2ml碱性KI无氧溶液(过量),开启搅拌器,至反应①完全。 d. 搅拌并向烧瓶中加入2ml硫酸无氧溶液至②完全,溶液为中性或若酸性。 e.从烧瓶中取出40.00ml溶液,以淀粉作指示剂,用0.001000mol/LNa2S2O3溶液进行滴定,记录数据。 f.…… g.处理数据(忽略氧气从水样中的溢出量和加入试剂后水样体积的变化)。 回答下列问题: (1)配置以上无氧溶液时,除去所用溶剂水中氧的简单操作为__________。 (2)在橡胶塞处加入水样及有关试剂应选择的仪器为__________。 ①滴定管 ②注射器 ③量筒 (3)搅拌的作用是__________。 (4)配平反应②的方程式,其化学计量数依次为__________。 (5)步骤f为__________。 (6)步骤e中达到滴定终点的标志为__________。若某次滴定消耗Na2S2O3溶液4.50ml,水样的DO=__________mg/L(保留一位小数)。作为饮用水源,此次测得DO是否达标:__________(填是或否) (7)步骤d中加入硫酸溶液反应后,若溶液pH过低,滴定时会产生明显的误差,写出产生此误差的原因(用离子方程式表示,至少写出2个)__________。 9、(2016 浙江)无水MgBr2可用作催化剂。实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图1,主要步骤如下: 步骤1 三颈瓶中装入10 g镁屑和150 mL无水乙醚;装置B中加入15 mL液溴。 步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。 步骤3 反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。 步骤4 常温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160 ℃分解得无水MgBr2产品。 已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性。 ②MgBr2+3C2H5OC2H5MgBr2·3C2H5OC2H5 请回答: (1) 仪器A的名称是________。实验中不能用干燥空气代替干燥N2,原因是___ __ ____ _ _。 (2)如将装置B改为装置C(图2),可能会导致的后果是____ 。 (3)步骤3中,第一次过滤除去的物质是___________。 (4)有关步骤4的说法,正确的是___________。 A. 可用95%的乙醇代替苯溶解粗品 B.洗涤晶体可选用0℃的苯 C. 加热至160℃的主要目的是除去苯 D.该步骤的目的是除去乙醚和可能残留的溴 (5)为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式: Mg2++ Y4-=Mg Y2- ① 滴定前润洗滴定管的操作方法是___ 。 ② 测定前,先称取0.2500g无水MgBr2产品,溶解后,用0.0500 mol·L-1的EDTA标 准溶液滴定至终点,消耗EDTA标准溶液26.50 mL,则测得无水MgBr2产品的纯度是______(以质量分数表示)。查看更多