- 2021-08-24 发布 |
- 37.5 KB |
- 16页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020-2021学年高二化学新教材人教版必修第二册教师用书:第 2 课时 硫酸
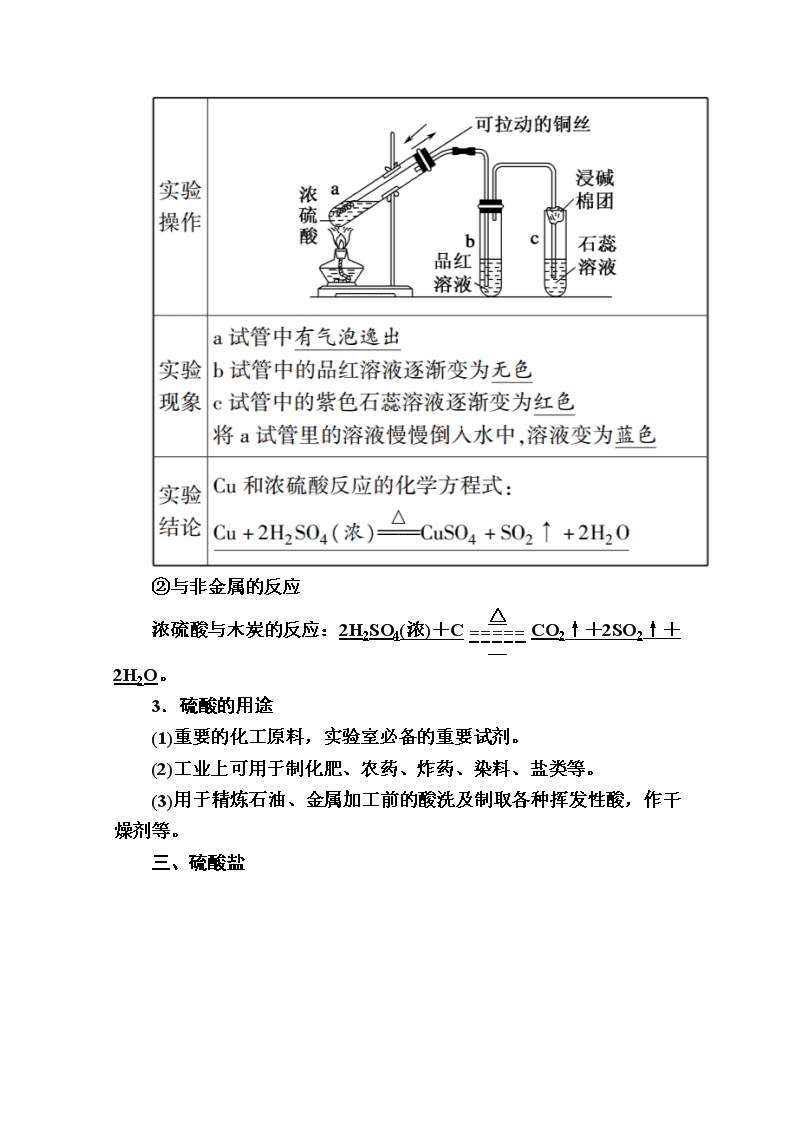
www.ks5u.com 第2课时 硫酸 课前自主预习 一、硫酸的制备 1.古代制法 加热胆矾(CuSO4·5H2O)或绿矾(FeSO4·7H2O)制取硫酸。 2.现代工业制法——接触法 二、硫酸的性质 1.稀硫酸的化学性质 具有酸的通性,溶于水完全电离:H2SO4===2H++SO。 2.浓硫酸的特性 (1)吸水性 浓硫酸能够吸收气体、液体中的水分子及固体中的结晶水,故常用作干燥剂。 (2)脱水性 浓硫酸能按水的组成比脱去纸、棉布、木条等有机物中的氢、氧元素。 向蔗糖中加入浓硫酸时,观察到的现象有: ①蔗糖变黑; ②蔗糖体积膨胀,变成疏松多孔的海绵状的炭; ③放出有刺激性气味的气体。 (3)强氧化性 ①与金属的反应:除金、铂以外的绝大多数金属都能与浓硫酸作用。 常温下,Fe、Al遇浓硫酸发生钝化。 与铜反应的实验探究 ②与非金属的反应 浓硫酸与木炭的反应:2H2SO4(浓)+CCO2↑+2SO2↑+2H2O。 3.硫酸的用途 (1)重要的化工原料,实验室必备的重要试剂。 (2)工业上可用于制化肥、农药、炸药、染料、盐类等。 (3)用于精炼石油、金属加工前的酸洗及制取各种挥发性酸,作干燥剂等。 三、硫酸盐 课堂互动探究 硫酸的制备 工业上接触法制硫酸的主要设备及生产流程如下图: 根据上图回答下列问题: (1)填写下列各进口或出口物质的名称: A含硫矿石(如FeS2);B炉渣;C二氧化硫、氧气;D尾气(SO2、O2)。 (2)接触法制硫酸分为三个阶段,填写下表: 浓硫酸与稀硫酸 1.浓硫酸与稀硫酸的比较 2.浓硫酸与稀硫酸的鉴别方法 (1)取少量蒸馏水,向其中加入少量试样,能够放出大量热的为浓硫酸,反之为稀硫酸。 (2)观察状态:为黏稠状液体的是浓硫酸,而黏稠度较小的是稀硫酸。 (3)取体积相等的两液体,用手掂掂,质量较大的是浓硫酸。 (4)取少量试样,向其中加入铁片,若能够产生大量气泡的则为稀硫酸:Fe+H2SO4===FeSO4+H2↑ ;若无明显现象(钝化),则为浓硫酸。 (5)用玻璃棒分别蘸取试样在纸上写字,立即变黑(浓硫酸的脱水性)的为浓硫酸,另一种为稀硫酸。 浓硫酸的特性 1.浓硫酸吸水性和脱水性的区别 浓硫酸吸水是把物质本身中自由的水或结晶水吸收。浓硫酸脱水是把本身不含水的有机物中的氢元素和氧元素按水的组成比脱去。所以二者的本质区别是物质中有没有现成的水分子。 浓硫酸能够吸收空气中的水分和其他物质表面的水分,因此浓硫酸常用作干燥剂。但是它不能用来干燥碱性气体(如NH3)和强还原性气体(如H2S)。 2.浓硫酸的强氧化性的表现 (1)Fe、Al的钝化。 常温下,当Fe、Al等较活泼金属遇到浓硫酸时,会与浓硫酸发生反应,表面生成一层致密的氧化物薄膜而出现“钝化”现象。 (2)与不活泼金属和非金属的反应。 由于浓硫酸具有强氧化性,故存在与稀硫酸不同的化学性质,能够与不活泼金属或非金属发生反应,反应过程中有如下规律: ①反应要加热; ②还原产物一般是SO2。一般金属被氧化为高价态的硫酸盐,非金属被氧化为高价态氧化物或含氧酸; ③浓硫酸与金属反应时,既表现酸性又表现强氧化性,而与非金属反应时,只表现强氧化性; ④随着反应的进行,浓硫酸浓度变小,一旦变为稀硫酸,反应就停止。 典例题组训练 题组一 硫酸的制备 1.在硫酸的工业制法中,下列生产操作与说明生产操作的主要原因二者都正确的是( D ) A.黄铁矿煅烧前要粉碎,因为大块黄铁矿不能燃烧 B.从沸腾炉出来的气体只有SO2 C.SO2氧化成SO3,SO2能全部转化为SO3 D.SO3用98.3%的浓H2SO4吸收,目的是防止形成酸雾,以便使SO3吸收完全 解析:将黄铁矿粉碎是使其增大与空气的接触面积,使燃烧更快、更充分,并不是大块黄铁矿不能燃烧。从沸腾炉出来的气体除SO2外,还有杂质气体、O2等。SO2转化为SO3为可逆反应,正、逆反应同时进行,故SO2不可能全部转化为SO3。SO3转化为H2SO4,若直接用水吸收,会形成大量酸雾,导致SO3吸收不完全,工业生产中用98.3%的浓硫酸作为吸收剂,则不会出现酸雾,吸收SO3更充分。 2.(双选)右图为工业制硫酸的三设备之一的吸收塔。下列说法错误的是( BC ) A.从①处通入SO3,整个吸收操作采取逆流的形式 B.从②处喷出98.3%的硫酸,瓷环的作用是防止暴沸 C.从③处导出的气体只含有少量SO2,可直接排入大气 D.从④处流出的是更浓的硫酸 解析:首先明确该装置(设备)在吸收SO3过程中是采用逆流原理进行吸收的,即98.3%的硫酸是从吸收塔顶喷下,而SO3 是从吸收塔底部通入的。这样有利于气、液的充分接触,吸收效果好,而不是防止暴沸。从吸收塔上部导出的气体是N2、没有起反应的O2和少量SO2,直接排入大气会污染环境,所以应用吸收剂吸收或循环使用。 工业制硫酸的注意事项 (1)在沸腾炉中煅烧黄铁矿时,要把矿石粉碎,目的是增大黄铁矿与O2的接触面积,使反应加快,提高原料利用率。 (2)炉气进入接触室前要净化,目的是除去炉气中的杂质,防止催化剂中毒及对设备造成不利影响。 (3)接触室内使用热交换器的目的是利用SO2和O2反应放出的热量预热输入设备的气体,冷却反应后的气体。 (4)在吸收塔内用98.3%的浓H2SO4吸收SO3而不是用水吸收的原因是用水吸收SO3时,易形成酸雾,吸收速率慢,而用98.3%的浓H2SO4吸收SO3时,吸收SO3的速率快,不形成酸雾,吸收完全。 题组二 浓硫酸的性质 3.浓硫酸具有以下五种性质: A.强酸性 B.强氧化性 C.高沸点、难挥发性 D.脱水性 E.吸水性 以下过程主要表现了浓硫酸的哪些性质? (1)热的浓硫酸与铜片反应AB(填字母,下同)。 (2)热的浓硫酸与木炭反应B。 (3)浓硫酸干燥H2、O2、Cl2、HCl和SO2等气体E。 (4)常温下可以用铁或铝的容器贮存浓硫酸B。 (5)胆矾放在盛浓硫酸的干燥器中变成白色粉末E。 (6)不能用浓硫酸干燥HBr、HI和H2S等气体B。 (7)浓硫酸使湿润的蓝色石蕊试纸先变红后变黑AD。 解析:(1)浓硫酸在加热条件下将不活泼的金属铜转化成硫酸铜,不仅表现了浓硫酸的强氧化性,还表现了酸性。(2)热的浓硫酸与木炭反应,只体现强氧化性。(3)浓硫酸吸收待干燥气体中的水蒸气,表现吸水性。(4)常温下,浓硫酸和铝、铁反应,在金属表面生成一层致密的氧化物薄膜,阻止内部的金属和浓硫酸继续反应,体现了浓硫酸的氧化性。(5)浓硫酸能吸收胆矾晶体中的结晶水,使之变成无水硫酸铜白色粉末,表现吸水性。(6)浓硫酸具有强氧化性,而HBr、HI、H2S具有强还原性。(7)浓硫酸既具有酸的通性,可使酸碱指示剂变色,又具有脱水性,可使有机物炭化。 吸水性与脱水性的区别: 题组三 浓硫酸的强氧化性 4.用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验操作不合理的是( D ) A.上下移动①中铜丝可控制SO2的量 B.②中选用品红溶液验证SO2的生成 C.③中选用NaOH溶液吸收多余的SO2 D.为确认CuSO4生成,向①中加水,观察颜色 解析:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O,当向上移动①中铜丝时,铜丝与浓H2SO4脱离接触,反应停止;当向下移动时,铜丝与浓H2SO4接触,生成SO2,故可以控制SO2的量,A项正确;SO2可使品红溶液褪色,加热后又恢复红色,因此可以使用品红溶液检验SO2,B项正确;SO2直接排放会污染大气,可用NaOH溶液吸收,SO2+2NaOH===Na2SO3+H2O,C项正确;反应后,①中仍含有大量的H2SO4,直接向①中加水,容易使水沸腾而溅出,造成危险。应待①中溶液冷却后,把试管①中的液体慢慢倒入盛有少量水的另一支试管中,溶液变蓝,可以确认CuSO4的生成,D项错误。 5.在化学课上,围绕浓硫酸的化学性质进行了如下实验探究:将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀。然后加入适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体。请回答: (1)生成的黑色(单质)物质是C(填化学式)。 (2)这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的主要污染物之一,这种刺激性气味的气体成分是SO2(填化学式),这种黑色物质继续与浓硫酸作用,产生两种气体的化学方程式为C+2H2SO4(浓)CO2↑+2SO2↑+ 2H2O。 (3)据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有CD(填序号)。 A.酸性 B.吸水性 C.脱水性 D.强氧化性 (4)将实验(2)产生的刺激性气味气体通入品红溶液,可以看到品红溶液褪色,说明这种气体具有漂白性;将(2)中产生的刺激性气味的气体通入水中可生成一种不稳定、易分解的酸,请写出该反应的化学方程式SO2+H2OH2SO3。 解析:(1)蔗糖的化学式为C12H22O11,向蔗糖中加入浓硫酸,浓硫酸将蔗糖中的H、O以2 1的组成脱去,生成的黑色单质为C。(2)黑色物质为C,C继续与浓硫酸反应生成CO2、SO2和H2O,产生的两种气体为CO2和SO2,CO2是无色无味的气体,SO2是无色有刺激性气味的气体,刺激性气味的气体成分为SO2,C与浓硫酸加热时反应的化学方程式为C+2H2SO4(浓)CO2↑+2SO2↑+2H2O。(3)由蔗糖逐渐变黑说明浓硫酸具有脱水性,由C与浓硫酸反应产生两种气体说明浓硫酸具有强氧化性,该过程说明浓硫酸具有脱水性和强氧化性,C、D正确。(4)实验(2)产生的刺激性气味气体为SO2,SO2具有漂白性,SO2通入品红溶液中,可以看到品红溶液褪色。SO2属于酸性氧化物,通入水中SO2会与水反应生成不稳定、易分解的H2SO3,反应的化学方程式为SO2+H2OH2SO3。 足量的活泼金属Zn与浓硫酸反应时,开始阶段浓硫酸体现其强氧化性,产生SO2气体,随着反应的进行,当浓硫酸变为稀硫酸时,Zn与稀硫酸反应产生H2。 在常温下,铁、铝遇到浓H2SO4钝化,但是加热条件下,不会钝化。 核心素养 1.浓H2SO4的特性 2.浓硫酸与Cu、C反应的化学方程式: Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O、 C+2H2SO4(浓)CO2↑+2SO2↑+2H2O。 3.常温下,铁、铝遇浓H2SO4钝化,可用铝(或铁)槽车运输浓硫酸。 提醒:①H2SO4是高沸点、难挥发性的强酸,利用这一性质可以制取HCl和HF:H2SO4(浓)+NaClNaHSO4+HCl↑,CaF2+H2SO4===CaSO4+2HF↑。 ②由“量变”引起的“质变”:金属(如Cu、Zn等)与浓H2SO4反应时,要注意H2SO4浓度对反应产物的影响。开始阶段产生SO2气体,随着反应的进行,H2SO4的浓度变小,最后变为稀H2SO4,Cu与稀H2SO4不反应,Zn与稀H2SO4反应生成H2而不是SO2。 【例1】 (双选)下列关于硫酸的叙述中,正确的是( ) A.浓硫酸具有脱水性,因而能使蔗糖炭化 B.浓硫酸有强氧化性,可贮存在铝、铁容器中 C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体 D.稀释浓硫酸时,应将水沿着器壁慢慢加入浓硫酸中,并用玻璃棒不断搅拌 【解析】 使蔗糖炭化,表现浓硫酸的脱水性,A正确;浓硫酸虽具有强氧化性,但可与铝、铁在常温下发生钝化反应,在表面生成一层致密的氧化膜,故可贮存在铝、铁容器中,B正确;浓硫酸与氨气反应,不能用于干燥氨气,C错误;浓硫酸密度比水大,稀释浓硫酸时,应防止酸液飞溅,应将浓硫酸沿着器壁慢慢加入水中,并用玻璃棒不断搅拌,D错误。 【答案】 AB 【例2】 (1)用过量的锌与浓H2SO4反应,某同学认为除了生成SO2外,还有H2产生,理由是_____________________________。 (2)用过量铜片与含0.2 mol H2SO4的浓H2SO4共热足够长时间,甲认为产生的SO2少于0.1 mol,理由是__________________; 而乙同学认为产生的SO2为0.1 mol,理由是_____________。 (3)实验证明在低温下铜不能与O2反应,也不能与稀H2SO4共热发生反应,但工业上却是将废铜屑倒入热的稀H2SO4中并通入空气来制备CuSO4溶液的。铜屑在此状态下被溶解的化学方程式为_________________________________________________________。 利用铜制备CuSO4的另一种方法为_____________________ (用化学方程式表示)。以上两种方法________(填“前”或“后”)者较好,原因是___________________________________。 【解析】 浓H2SO4与金属反应时,随着反应的进行,H2SO4的量不断减少,硫酸由浓变稀,稀H2SO4可与锌反应产生氢气,但稀H2SO4不与铜反应。在稀H2SO4存在的条件下,Cu与O2在加热条件下反应生成碱性氧化物CuO,并迅速溶解在热的稀H2SO4中生成CuSO4。 【答案】 (1)Zn过量,随着反应的进行,浓H2SO4变稀,稀H2SO4可与Zn反应产生H2 (2)由反应Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O可知,若0.2 mol H2SO4全部反应可生成0.1 mol SO2,但随着反应的进行,浓H2SO4变稀,而稀H2SO4与铜不反应加热时间足够长,水比硫酸易挥发,硫酸始终保持较高浓度,直至与铜完全反应 (3)2Cu+2H2SO4(稀)+O22CuSO4+2H2O Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O 前 若制得1 mol CuSO4,第一种方法只需1 mol H2SO4,而第二种方法则要用2 mol H2SO4,而且生成的SO2会造成大气污染 查看更多