(新课标)广西2020高考化学二轮复习 专题四 化学实验 第11讲 化学实验基础学案
1
第 11 讲 化学实验基础
选择题(本题包括 16 个小题,共 100 分)
1.保存下列试剂的试剂瓶上,应贴标志 和 的是( )
A.乙醇 B.浓硫酸
C.氢氧化钠 D.盐酸
答案 B
解析乙醇不具有氧化性和腐蚀性,A 错误。浓硫酸是强氧化剂,同时具有腐蚀性,B 正确。氢氧化钠
只具有腐蚀性,不具有强氧化性,C 错误。盐酸不具有强氧化性,D 错误。
2.已知 FeCO3 与砂糖混用可以作补血剂。某校化学小组同学在实验室里制备 FeCO3 的流程如图所
示。下列说法正确的是( )
A.过滤操作需要用到的玻璃仪器只有烧杯和漏斗
B.沉淀过程中有 NH3 放出
C.可利用 KSCN 溶液检验 FeSO4 溶液是否变质
D.产品 FeCO3 在空气中高温分解可得到纯净的 FeO
答案 C
解析过滤操作中用漏斗过滤,用玻璃棒引流,烧杯盛放溶液,所以过滤操作常用的玻璃仪器有烧杯、
漏斗和玻璃棒,A 错误。FeSO4 与 NH4HCO3 发生的反应为 Fe2++2HC FeCO3↓+H2O+CO2↑,则沉淀过
程中有 CO2 气体放出,B 错误。Fe2+变质会生成 Fe3+,则检验 FeSO4 溶液是否变质可利用 KSCN 溶液,C
正确。Fe2+在空气中加热易被氧化为 Fe3+,所以 FeCO3 在空气中高温分解不能得到 FeO,D 错误。
3.(2017 浙江化学选考,10)下列说法不正确的是( )
A.实验室应将钠保存在煤油中
B.分液漏斗和容量瓶在使用前都要检漏
C.可用酒精代替 CCl4 萃取碘水中的碘单质
D.金属镁失火不可用水来灭火
答案 C
解析钠能与氧气、水反应,故应隔绝空气保存,且钠的密度比煤油的大,故可以保存在煤油中,A 正
确。分液漏斗和容量瓶使用前都需查漏,B 正确。酒精与水互溶,故不能用酒精来萃取碘水中的
碘,C 错误。金属镁能与热水反应生成氢气会引起爆炸,故金属镁失火不能用水来灭火,D 正确。
2
4.(2017 天津理综,4)以下实验设计能达到实验目的的是( )
选项 实验目的 实验设计
A 除去 NaHCO3 固体中的 Na2CO3 将固体加热至恒重
B 制备无水 AlCl3 蒸发 Al 与稀盐酸反应后的溶液
C 重结晶提纯苯甲酸 将粗品水溶、过滤、蒸发、结晶
D 鉴别 NaBr 和 KI 溶液 分别加新制氯水后,用 CCl4 萃取
答案 D
解析 NaHCO3 受热易分解,而 Na2CO3 受热不易分解,故 A 项错;AlCl3 易水解,故蒸发 Al 与稀盐酸反应
后的溶液得不到 AlCl3 而是得到 Al(OH)3,B 项错;苯甲酸常温下微溶于水,故提纯苯甲酸时,应将粗
品在加热条件下溶于水,趁热过滤,冷却结晶,C 项错;氯水与 NaBr 和 KI 反应分别生成 Br2、I2,两者
都易溶于 CCl4,分别在 CCl4 层中显橙红色、紫红色,D 项正确。
5.下列选用的相关仪器、用品不符合实验要求的是( )
A B C D
准确量取 19.01 mL
水 新制氯水的保存 测定 0.1 mol·L-1Na2CO3 溶液
的 pH
分离水和乙酸乙
酯
25 mL 酸式滴定管 带玻璃塞的棕色细口
瓶 镊子、pH 试纸、表面皿 分液漏斗、烧杯
答案 C
解析滴定管的测量精度为 0.01 mL,A 正确。新制氯水见光易分解,且易挥发,具有强氧化性,应用带
玻璃塞的棕色细口瓶盛放,B 正确。测定溶液 pH 时,应用玻璃棒蘸取待测液,点在 pH 试纸上,再与标
准比色卡对照,不能用镊子,C 错误。水与乙酸乙酯不相溶,可用分液的方法进行分离,故需用分液漏
斗,D 正确。
6.下列实验操作、现象和对应的实验结论均正确的是( )
选
项 实验操作和现象 实验结论
A 检验某溶液中是否含有 S 时,向溶液中滴加用盐酸酸化的 BaCl2
溶液,有白色沉淀生成 该溶液中一定含有 S
B 检验输送氯气的管道是否发生泄漏时,用一根玻璃棒蘸取浓氨水,
然后靠近管道
有白烟产生时说明管道
发生泄漏
C 检验 FeCl3 溶液中是否含有 Fe2+时,向溶液中滴加 KMnO4 酸性溶
液,溶液变为无色 该溶液中一定含有 Fe2+
D
向 2 mL 0.1 mol·L-1 硝酸银溶液中加入 1 mL 0.1 mol·L-1
NaCl 溶液,出现白色沉淀,再加入几滴 0.1 mol·L-1 Na2S 溶液,有
黑色沉淀生成
该现象说明相同温度下
Ksp(Ag2S)
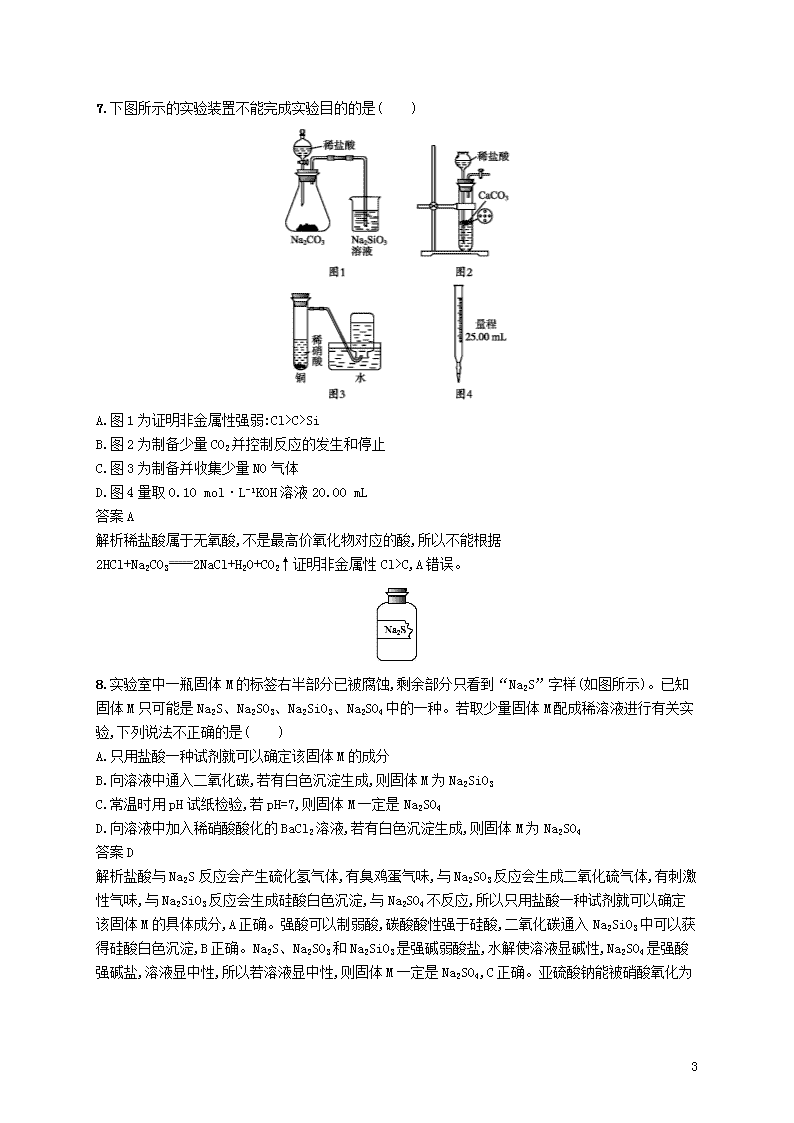
C>Si
B.图 2 为制备少量 CO2 并控制反应的发生和停止
C.图 3 为制备并收集少量 NO 气体
D.图 4 量取 0.10 mol·L-1KOH 溶液 20.00 mL
答案 A
解析稀盐酸属于无氧酸,不是最高价氧化物对应的酸,所以不能根据 2HCl+Na2CO3
2NaCl+H2O+CO2↑证明非金属性 Cl>C,A 错误。
8.实验室中一瓶固体 M 的标签右半部分已被腐蚀,剩余部分只看到“Na2S”字样(如图所示)。已知
固体 M 只可能是 Na2S、Na2SO3、Na2SiO3、Na2SO4 中的一种。若取少量固体 M 配成稀溶液进行有关实
验,下列说法不正确的是( )
A.只用盐酸一种试剂就可以确定该固体 M 的成分
B.向溶液中通入二氧化碳,若有白色沉淀生成,则固体 M 为 Na2SiO3
C.常温时用 pH 试纸检验,若 pH=7,则固体 M 一定是 Na2SO4
D.向溶液中加入稀硝酸酸化的 BaCl2 溶液,若有白色沉淀生成,则固体 M 为 Na2SO4
答案 D
解析盐酸与 Na2S 反应会产生硫化氢气体,有臭鸡蛋气味,与 Na2SO3 反应会生成二氧化硫气体,有刺激
性气味,与 Na2SiO3 反应会生成硅酸白色沉淀,与 Na2SO4 不反应,所以只用盐酸一种试剂就可以确定
该固体 M 的具体成分,A 正确。强酸可以制弱酸,碳酸酸性强于硅酸,二氧化碳通入 Na2SiO3 中可以获
得硅酸白色沉淀,B 正确。Na2S、Na2SO3 和 Na2SiO3 是强碱弱酸盐,水解使溶液显碱性,Na2SO4 是强酸
强碱盐,溶液显中性,所以若溶液显中性,则固体 M 一定是 Na2SO4,C 正确。亚硫酸钠能被硝酸氧化为
4
硫酸钠,所以加入硝酸酸化的 BaCl2 溶液,Na2SO3 溶液也会产生白色沉淀,所以不能确定是 Na2SO4,D
错误。
9.对下列物质中的杂质(括号内为杂质)的检验、除杂所使用的试剂均正确的是( )
选项 物质及杂质 检验 除杂
A 乙酸乙酯(乙酸) Na2CO3 溶液 NaOH 溶液
B NaHCO3 溶液(Na2CO3) Ca(OH)2 溶液 过量 CO2
C CO2(HCl) AgNO3 溶液(含稀硝酸) 饱和 NaHCO3 溶液
D CO(NO2) 观察颜色或湿润的 KI 淀粉试纸 水
答案 C
解析氢氧化钠不仅可以除去乙酸,而且也可以使乙酸乙酯水解,A 错误。氢氧化钙不仅可以与碳酸钠
反应生成沉淀,而且也可以与碳酸氢钠反应生成沉淀,B 错误。水能除去二氧化氮,但是还能生成另
外一种气体一氧化氮,D 错误。
10.(2017 北京理综,10)根据 SO2 通入不同溶液中的实验现象,所得结论不正确的是( )
选项 实验 现象 结论
A 含 HCl、BaCl2 的 FeCl3 溶液 产生白色沉淀 SO2 有还原性
B H2S 溶液 产生黄色沉淀 SO2 有氧化性
C 酸性 KMnO4 溶液 紫色溶液褪色 SO2 有漂白性
D Na2SiO3 溶液 产生胶状沉淀 酸性:H2SO3>H2SiO3
答案 C
解析 A 项,发生反应:2Fe3++SO2+2H2O 2Fe2++4H++S 、S +Ba2+ BaSO4↓,在第一步反应中二
氧化硫被氧化为硫酸,体现了 SO2 的还原性,A 项正确;B 项,发生反应:SO2+2H2S 3S↓+2H2O,其中
SO2 作氧化剂,体现氧化性,B 项正确;C 项,SO2 通入酸性 KMnO4 溶液中,SO2 被酸性高锰酸钾溶液氧化,
体现了 SO2 的还原性而非漂白性,C 项错误;D 项,发生反应:SO2+H2O+Na2SiO3 H2SiO3↓+Na2SO3,说
明亚硫酸的酸性强于硅酸的酸性,D 项正确。
11.下列实验基本操作或对事故的处理方法不正确的是( )
A.给盛有液体的烧瓶加热时,需要加碎瓷片或沸石
B.发现实验室中有大量的可燃性气体泄漏时,应立即开窗通风
C.酒精灯内的酒精不能超过酒精灯容积的
D.不慎将少量浓硫酸溅到皮肤上,应立即用水冲洗,然后涂抹 10%的 NaOH 溶液
答案 D
解析给盛有液体的烧瓶加热时,需要加碎瓷片或沸石以防暴沸,A 正确。开窗通风以减小可燃性气体
的浓度,以防爆炸,B 正确。灯内酒精量过多,易造成灯内酒精被引燃,可能出现灯内发生剧烈燃烧而
爆炸,C 正确。NaOH 具有强腐蚀性,会造成二次伤害,D 错误。
12.下列有关仪器的名称、图形、操作的叙述均正确的是( )
5
选
项 A B C D
名
称
250 mL
容量瓶 分液漏斗 酸式
滴定管 冷凝管
图
形
操
作
定容时仰视刻度线,则配得
的溶液浓度偏小
用酒精萃取碘
水中的碘
可用于量取
Na2CO3 溶液
蒸馏实验中将蒸气冷
凝为液体
答案 A
解析定容时仰视刻度线,则所配制的溶液体积大于 250 mL,溶液浓度偏小,A 正确。酒精能与水以任
意比互溶,不能作为萃取剂,B 错误。碳酸钠溶液呈碱性,应用碱式滴定管量取,C 错误。蒸馏实验中
蒸气冷凝时冷凝水应下进上出,D 错误。
13.下列实验操作或原理正确的是( )
A.检查
气密性
B.提纯
Fe(OH)3
胶体
C.分离
CCl4 中的 I2
D.定容
答案 A
解析通入气体,产生液面差,如果液面差不变,说明气密性良好,A 正确。氢氧化铁胶体能透过滤纸,
应采用渗析方法进行分离,B 错误。碘单质受热易升华,应采用蒸馏方法进行分离,C 错误。胶头滴
管不能伸入到容量瓶中,D 错误。
14.(2017 江苏化学,13)根据下列实验操作和现象所得到的结论正确的是( )
选
项 实验操作和现象 实验结论
A 向苯酚溶液中滴加少量浓溴水、振荡,无白色沉淀 苯酚浓度
小
B 向久置的 Na2SO3 溶液中加入足量 BaCl2 溶液,出现白色沉淀;再
加入足量稀盐酸,部分沉淀溶解
部分
Na2SO3
被氧化
C 向 20%蔗糖溶液中加入少量稀硫酸,加热;再加入银氨溶液,未
出现银镜
蔗糖未水
解
D 向某黄色溶液中加入淀粉 KI 溶液,溶液呈蓝色 溶液中含
Br2
6
答案 B
解析 A 项,该实验中所用苯酚溶液的浓度要小,否则生成的三溴苯酚会溶于苯酚溶液中,所以没有生
成白色沉淀可能是由于苯酚的浓度太大,错误;B 项,Na2SO3 与 BaCl2 反应生成 BaSO3 白色沉淀,该沉
淀可以溶于盐酸,沉淀部分溶解,说明有 BaSO4 存在,即原久置的 Na2SO3 溶液中部分 Na2SO3 被氧化,正
确;C 项,银镜反应需要在碱性条件下进行,错误;D 项,该黄色溶液还可能为含 Fe3+的溶液,Fe3+可将
I-氧化为 I2,淀粉遇 I2 变蓝色,错误。
15.某无色气体,可能含 HCl、CO2、NO2、HI、SO2、HBr 中的一种或几种。将其通入氯水中,得到无
色透明溶液。把溶液分成两份,向一份中加入盐酸酸化的 BaCl2 溶液,出现白色沉淀;另一份加入硝
酸酸化的 AgNO3 溶液,也有白色沉淀生成。对于原无色气体的推断一定正确的是( )
A.一定存在 HCl
B.一定存在 SO2
C.肯定没有 CO2
D.不能肯定是否含有 NO2、HI
答案 B
解析原气体无色,则肯定不存在 NO2;混合气体通入氯水中得到无色透明溶液,原气体中一定不存在
HI、HBr;一份溶液中加入盐酸酸化的 BaCl2 溶液,出现白色沉淀,该白色沉淀为硫酸钡,则原气体中
一定含有 SO2;另一份溶液中加入硝酸酸化的 AgNO3 溶液,也有白色沉淀生成,该白色沉淀为 AgCl,但
由于氯水引进了 Cl-,所以无法确定原气体中是否含有 HCl。根据以上分析可知,A、D 错误,B 正确;
根据题干中信息无法确定是否含有二氧化碳气体,C 错误。
16.下列有关实验的叙述正确的是( )
A.可用碱式滴定管量取 12.85 mL 的 KMnO4 溶液
B.实验室蒸馏石油可用如图甲所示实验装置
C.取用金属钠或钾时,没用完的钠或钾要放回原瓶
D.配制 500 mL 0.4 mol·L-1NaCl 溶液,必要的仪器如图乙所示
答案 C
解析 KMnO4 溶液具有强氧化性,不能用碱式滴定管量取,A 错误。甲中温度计水银球应位于蒸馏烧瓶
支管口处,B 错误。金属钠或钾很活泼,易与空气中的氧气、水蒸气反应,没用完的钠或钾要放回原
瓶以隔绝空气,C 正确。配制 500 mL 0.4 mol·L-1NaCl 溶液,不需要分液漏斗,而需要 500 mL 容量
瓶,D 错误。