- 2021-05-14 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考江苏卷化学试题解析正式原卷
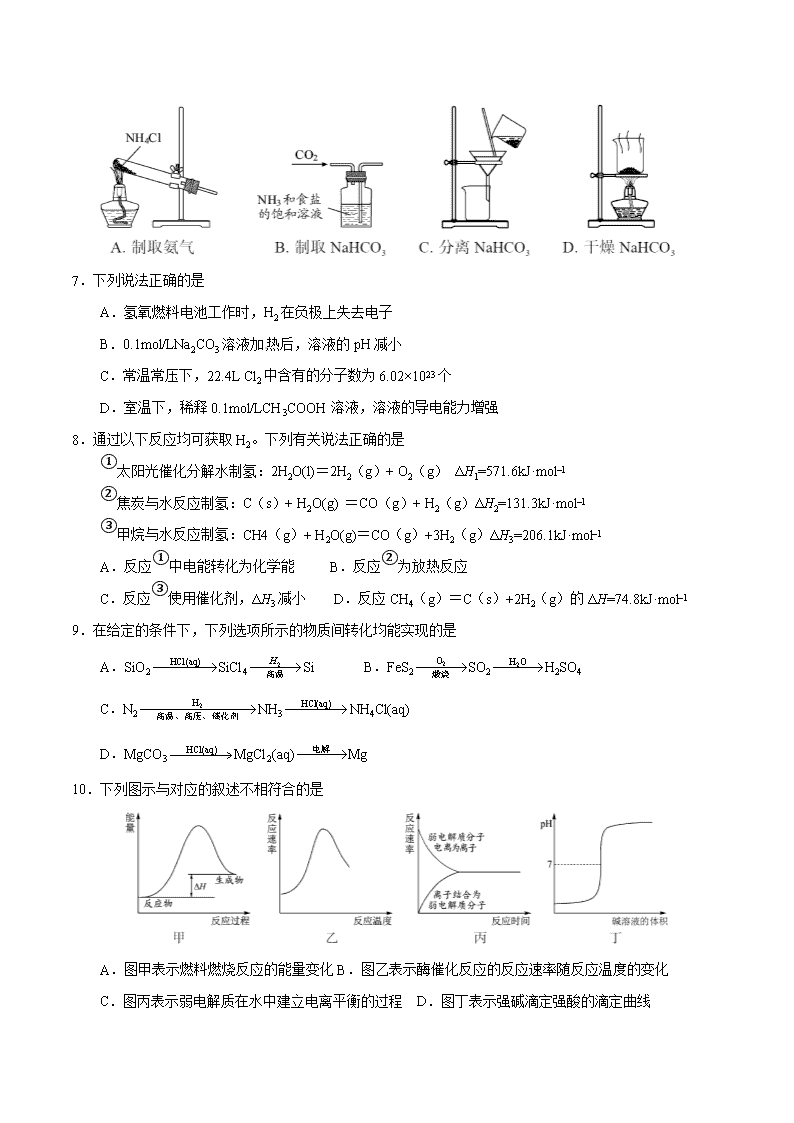
2016年普通高等学校全国统一招生考试(江苏卷) 可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32 Cl 35.5 K 39 Ca 40 Mn 55 Fe 56 I 127 一、单项选择题:本题共10小题,每小题2分,共计20分,每小题只有一个选项符合题意。 1.大气中CO2含量的增加会加剧“温室效应”。下列活动会导致大气中CO2含量增加的是 A.燃烧煤炭供热 B.利用风力发电 C.增加植被面积 D.节约用电用水 2.下列有关化学用语表示正确的是 A.中子数为10的氧原子: B.Mg2+的结构示意图: C.硫化钠的电子式: D.甲酸甲酯的结构简式:C2H4O2 3.下列有关物质的性质与用途具有对应关系的是 A.SO2具有氧化性,可用于漂白纸浆 B.NH4HCO3受热易分解,可用作氮肥 C.Fe2(SO4)3易溶于水,可用作净水剂 D.Al2O3熔点高,可用作耐高温材料 4.短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层有6个电子,Y是迄今发现的非金属性最强的元素,在周期表中Z位于IA族,W与X属于同一主族。下列说法正确的是 A.元素X、W的简单阴离子具有相同的电子层结构 B.由Y、Z两种元素组成的化合物是离子化合物 C.W的简单气态氢化物的热稳定性比Y的强 D.原子半径:r(X)<r(Y)<r(Z)<r(W) 5.下列指定反应的离子方程式正确的是 A.将铜插入稀硝酸中:Cu+4H++2NO3 -=Cu2++2NO2↑+H2O B.向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe=2Fe3+ C.向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3﹒H2O=Al(OH)3↓+3NH4+ D.向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+3Na+ 6.根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是 7.下列说法正确的是[来源:学科网] A.氢氧燃料电池工作时,H2在负极上失去电子 B.0.1mol/LNa2CO3溶液加热后,溶液的pH减小 C.常温常压下,22.4L Cl2中含有的分子数为6.02×1023个 D.室温下,稀释0.1mol/LCH3COOH溶液,溶液的导电能力增强 8.通过以下反应均可获取H2。下列有关说法正确的是 ①太阳光催化分解水制氢:2H2O(l)=2H2(g)+ O2(g) ΔH1=571.6kJ·mol–1 ②焦炭与水反应制氢:C(s)+ H2O(g) =CO(g)+ H2(g)ΔH2=131.3kJ·mol–1 ③甲烷与水反应制氢:CH4(g)+ H2O(g)=CO(g)+3H2(g)ΔH3=206.1kJ·mol–1 A.反应①中电能转化为化学能 B.反应②为放热反应 C.反应③使用催化剂,ΔH3减小 D.反应CH4(g)=C(s)+2H2(g)的ΔH=74.8kJ·mol–1 9.在给定的条件下,下列选项所示的物质间转化均能实现的是 A.SiO2SiCl4Si B.FeS2SO2H2SO4 C.N2NH3NH4Cl(aq) D.MgCO3MgCl2(aq)Mg 10.下列图示与对应的叙述不相符合的是 A.图甲表示燃料燃烧反应的能量变化B.图乙表示酶催化反应的反应速率随反应温度的变化 C.图丙表示弱电解质在水中建立电离平衡的过程 D.图丁表示强碱滴定强酸的滴定曲线 不定项选择题:本题包括5 小题,每小题4 分,共计20 分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0 分;若正确答案包括两个选项,只选一个且正确的得2 分,选两个且都正确的得满分,但只要选错一个,该小题就得0 分。 11.化合物X是一种医药中间体,其结构简式如图所示。下列有关化合物X的说法正确的是 A.分子中两个苯环一定处于同一平面 B.不能与饱和Na2CO3溶液反应 C.在酸性条件下水解,水解产物只有一种 D.1 mol化合物X最多能与2 molNaOH反应 12.制备(NH4)2Fe(SO4)2·6H2O的实验中,需对过滤出产品的母液(pH<1)进行处理。常温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是 A.通入过量Cl2:Fe2+、H+、NH4+、Cl-、SO42- B.加入少量NaClO溶液:NH4+、Fe2+、H+、SO42-、ClO- C.加入过量NaOH溶液:Na+、Fe2+、NH4+、SO42-、OH- D.加入过量NaClO和NaOH的混合溶液:Na+、SO42-、Cl-、ClO-、OH- 13.根据下列实验操作和现象所得到的结论正确的是 选项 实验操作和现象 结论 A 室温下,向苯酚钠溶液中通入足量CO2,溶液变浑浊。 碳酸的酸性比苯酚的强 B 室温下,向浓度均为0.1 mol·L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀。 Ksp(BaSO4)< Ksp(CaSO4) C 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色。 Fe3+的氧化性比I2的强 D 室温下,用pH试纸测得:0.1mol·L-1 Na2SO3溶液的pH约为10;0.1mol·L-1 NaHSO3溶液的pH约为5。 HSO3-结合H+的能力比 SO32-的强 14.H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+ c(HC2O4-)+ c(C2O42-)=0.100 mol·L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如右图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是 A.pH=2.5的溶液中:c(H2C2O4)+ c(C2O42-)> c(HC2O4-) B.c(Na+)=0.100 mol·L-1的溶液中:c(H+)+c(H2C2O4)=c (OH-)+ c(C2O42-) C.c(HC2O4-)= c(C2O42-)的溶液中:c(Na+)>0.100 mol·L-1+ c(HC2O4-) D.pH=7的溶液中:c(Na+)>2c(C2O42-) 15.一定温度下,在3个体积均为1.0 L的恒容密闭容器中反应2H2(g)+CO(g)CH3OH(g) 达到平衡。下列说法正确的是 A.该反应的正反应放热B.达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大 C.达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍 D.达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大 16.(12分)以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下: (1)氯化过程控制电石渣过量,在75℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2,少量Ca(ClO)2 分解为CaCl2和O2。 ①生成Ca(ClO)2的化学方程式为 ▲ 。 ②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有 ▲ (填序号)。 A.适当减缓通入Cl2速率 B.充分搅拌浆料 C.加水使Ca(OH)2完全溶解 (2)氯化过程中Cl2 转化为Ca(ClO3)2的总反应方程式为 6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+6H2O 氯化完成后过滤。 ①滤渣的主要成分为 ▲ (填化学式)。 ②滤液中Ca(ClO3)2与CaCl2的物质的量之比 n[Ca(ClO3)2] ∶n[CaCl2] ▲ 1∶5 (填“>”、“<”或“=”)。 (3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3,若溶液中KClO3的含量为100g▪L-1,从该溶液中尽可能多地析出KClO3固体的方法是 ▲ 。 17.(15分)化合物H是合成抗心律失常药物决奈达隆的一种中间体,可通过以下方法合成:[来源:学科网] (1)D中的含氧官能团名称为____________(写两种)。 (2)F→G的反应类型为___________。 (3)写出同时满足下列条件的C的一种同分异构体的结构简式:_________。 ①能发生银镜反应;②能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应; ③分子中只有4种不同化学环境的氢。 (4)E经还原得到F,E的分子是为C14H17O3N,写出E的结构简式:___________。 (5)已知:①苯胺()易被氧化 ② 请以甲苯和(CH3CO)2O为原料制备,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。 18.(12分)过氧化钙(CaO2·8H2O)是一种在水产养殖中广泛使用的供氧剂。 (1)Ca(OH)2悬浊液与H2O2溶液反应可制备CaO2·8H2O。 Ca(OH)2+H2O2+6 H2O=CaO2·8H2O 反应时通常加入过量的Ca(OH)2,其目的是_____________。 (2)向池塘水中加入一定量的CaO2·8H2O后,池塘水中浓度增加的离子有____________(填序号)。 A.Ca2+ B.H+ C.CO32- D.OH− (3)水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置;加入适量稀H2SO4,待MnO(OH)2与I−完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下: ①写出O2将Mn2+氧化成MnO(OH)2的离子方程式;_____________。 ②取加过一定量CaO2·8H2O的池塘水样100.00 mL,按上述方法测定水中溶解氧量,消耗0.01000 mol·L−1 Na2S2O3标准溶液13.50 mL。计算该水样中的溶解氧(用mg·L−1表示),写出计算过程。 19.(15分)实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如下: (1)酸溶过程中主要反应的热化学方程式为 MgCO3(s)+2H+(aq)===Mg2+(aq)+CO2(g)+H2O(l) ΔH=-50.4 kJ·mol-1 Mg2SiO4(s)+4H+(aq)===2 Mg2+(aq)+H2SiO3(s)+H2O(l) ΔH=-225.4 kJ·mol-1 酸溶需加热的目的是______;所加H2SO4不宜过量太多的原因是_______。 (2)加入H2O2氧化时发生发应的离子方程式为___________。 (3)用右图所示的实验装置进行萃取分液,以除去溶液中的Fe3+。 ①实验装置图中仪器A的名称为_______。[来源:Z&xx&k.Com] ②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂,______、静置、分液,并重复多次。 (4)请补充完整由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水, ______,过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO3·3H2O。 [已知该溶液中pH=8.5时Mg(OH)2开始沉淀;pH=5.0时Al(OH)3沉淀完全]。 20.(14分)铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物。 (1)铁炭混合物在水溶液中可形成许多微电池。将含有Cr2O72-的酸性废水通过铁炭混合物,在微电池正极上Cr2O72-转化为Cr3+,其电极反应式为_____________。 (2)在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图所示0。 ①当铁炭混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+,其原因是__________。 ②当铁炭混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是_____________。 (3)纳米铁粉可用于处理地下水中的污染物。 ①一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4-(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4-,其离子方程式为 。 ②纳米铁粉与水中NO3-反应的离子方程式为4Fe+NO3-+10H+=4Fe2++NH4++3H2O 研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是 。 ③相同条件下,纳米铁粉去除不同水样中NO3-的速率有较大差异(见右图),产生该差异的可能原因是 。 21.(12分)【选做题】本题包括A、B两小题,请选定其中一个小题,并在相应的答题区域内作答。若多做,则按A小题评分。 A.[物质结构与性质] [来源:学科网] [Zn(CN)4]2-在水溶液中与HCHO发生如下反应: 4HCHO+[Zn(CN)4]2-+4H++4H2O===[Zn(H2O)4]2++4HOCH2CN (1)Zn2+基态核外电子排布式为____________________。 (2)1 mol HCHO分子中含有σ键的数目为____________mol。 (3)HOCH2CN分子中碳原子轨道的杂化类型是______________。 (4)与H2O分子互为等电子体的阴离子为________________。 (5)[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键。不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为_____________。 B.[实验化学] 焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中、受热时均易分解。实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如下图所示。 当溶液pH约为4时,停止反应,在20℃左右静置结晶。生成Na2S2O5的化学方程式为 2NaHSO3===Na2S2O5+H2O (1)SO2与Na2CO3溶液反应生成NaHSO3和CO2,其离子方程式为____________________。 (2)装置Y的作用是______________________________。 (3)析出固体的反应液经减压抽滤、洗涤、25℃~30℃干燥,可获得Na2S2O5固体。 ①组成减压抽滤装置的主要仪器是布氏漏斗、________________和抽气泵。 ②依次用饱和SO2水溶液、无水乙醇洗涤Na2S2O5固体。用饱和SO2水溶液洗涤的目的是______。 (4)实验制得的Na2S2O5固体中含有一定量的Na2SO3和Na2SO4,其可能的原因是______。查看更多