- 2021-05-14 发布 |
- 37.5 KB |
- 17页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
博林教育2018高考化学工业流程题强化训练
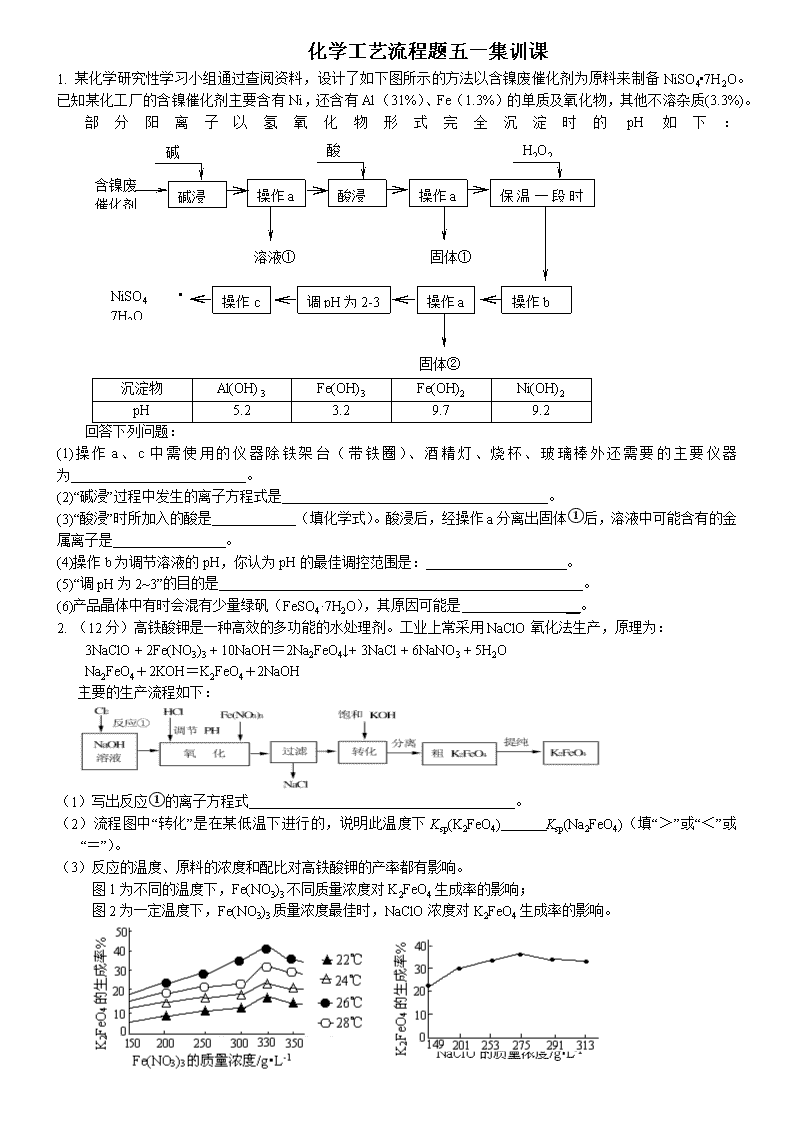
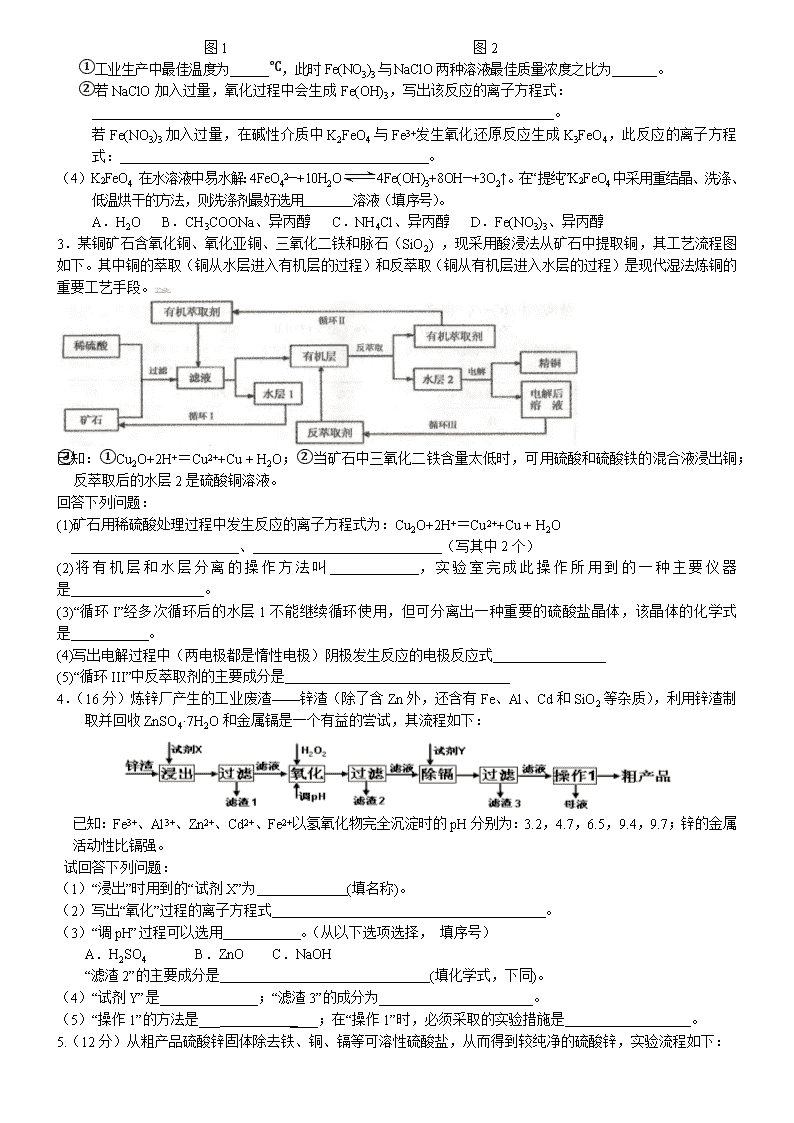
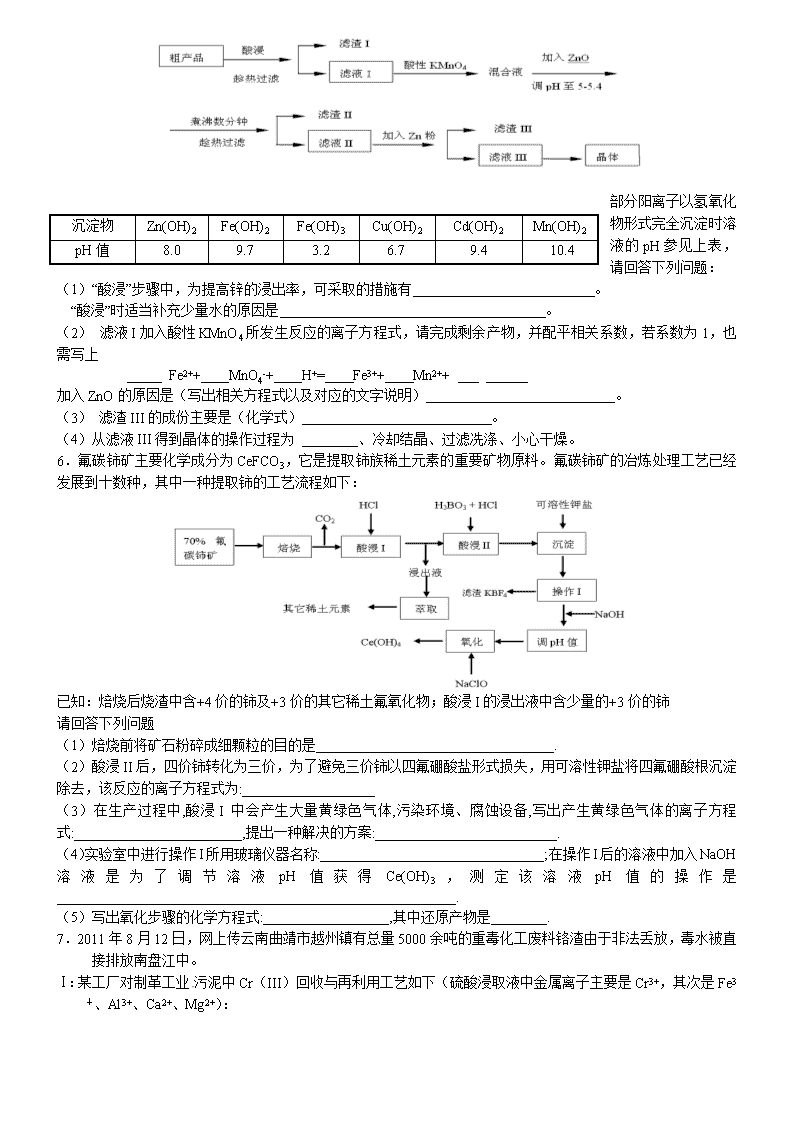
化学工艺流程题五一集训课 1. 某化学研究性学习小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O。已知某化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。 部分阳离子以氢氧化物形式完全沉淀时的pH如下:固体② 含镍废 催化剂 碱液 酸液 碱浸 操作b 保温一段时间 操作a 酸浸 操作a H2O2 调pH为2-3 操作c 溶液① 固体① 操作a NiSO4•7H2O 晶体 沉淀物 Al(OH)3 Fe(OH)3 Fe(OH)2 Ni(OH)2 pH 5.2 3.2 9.7 9.2 回答下列问题: (1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为 。 (2)“碱浸”过程中发生的离子方程式是 。 (3)“酸浸”时所加入的酸是 (填化学式)。酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是 。 (4)操作b为调节溶液的pH,你认为pH的最佳调控范围是: 。 (5)“调pH为2~3”的目的是 。 (6)产品晶体中有时会混有少量绿矾(FeSO4·7H2O),其原因可能是 __。 2. (12分)高铁酸钾是一种高效的多功能的水处理剂。工业上常采用NaClO氧化法生产,原理为: 3NaClO + 2Fe(NO3)3 + 10NaOH=2Na2FeO4↓+ 3NaCl + 6NaNO3 + 5H2O Na2FeO4+2KOH=K2FeO4+2NaOH 主要的生产流程如下: (1)写出反应①的离子方程式 。 (2)流程图中“转化”是在某低温下进行的,说明此温度下Ksp(K2FeO4) Ksp(Na2FeO4)(填“>”或“<”或“=”)。 (3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。 图1为不同的温度下,Fe(NO3)3不同质量浓度对K2FeO4生成率的影响; 图2为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响。 图1 图2 ①工业生产中最佳温度为 ℃,此时Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为 。 ②若NaClO加入过量,氧化过程中会生成Fe(OH)3,写出该反应的离子方程式: 。 若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式: 。 (4)K2FeO4 在水溶液中易水解:4FeO42—+10H2O4Fe(OH)3+8OH—+3O2↑。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 溶液(填序号)。 A.H2O B.CH3COONa、异丙醇 C.NH4Cl、异丙醇 D.Fe(NO3)3、异丙醇 3.某铜矿石含氧化铜、氧化亚铜、三氧化二铁和脉石(SiO2) ,现采用酸浸法从矿石中提取铜,其工艺流程图如下。其中铜的萃取(铜从水层进入有机层的过程)和反萃取(铜从有机层进入水层的过程)是现代湿法炼铜的重要工艺手段。Ks5u 已知:①Cu2O+2H+=Cu2++Cu + H2O;②当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜; ③反萃取后的水层2是硫酸铜溶液。 回答下列问题: (1)矿石用稀硫酸处理过程中发生反应的离子方程式为:Cu2O+2H+=Cu2++Cu + H2O 、 (写其中2个) (2)将有机层和水层分离的操作方法叫 ,实验室完成此操作所用到的一种主要仪器是 。 (3)“循环I”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐晶体,该晶体的化学式是 。 (4)写出电解过程中(两电极都是惰性电极)阴极发生反应的电极反应式 (5)“循环III”中反萃取剂的主要成分是 4.(16分)炼锌厂产生的工业废渣——锌渣(除了含Zn外,还含有Fe、Al、Cd和SiO2等杂质),利用锌渣制取并回收ZnSO4·7H2O和金属镉是一个有益的尝试,其流程如下: 已知:Fe3+、Al3+、Zn2+、Cd2+、Fe2+以氢氧化物完全沉淀时的pH分别为:3.2,4.7,6.5,9.4,9.7;锌的金属活动性比镉强。 试回答下列问题: (1)“浸出”时用到的“试剂X”为 (填名称)。 (2)写出“氧化”过程的离子方程式 。 (3)“调pH”过程可以选用 。(从以下选项选择, 填序号) A.H2SO4 B.ZnO C.NaOH “滤渣2”的主要成分是 (填化学式,下同)。 (4)“试剂Y”是______________;“滤渣3”的成分为______________________。 (5)“操作1”的方法是___ ____;在“操作1”时,必须采取的实验措施是 。 5.(12分)从粗产品硫酸锌固体除去铁、铜、镉等可溶性硫酸盐,从而得到较纯净的硫酸锌,实验流程如下: 沉淀物 Zn(OH)2 Fe(OH)2 Fe(OH)3 Cu(OH)2 Cd(OH)2 Mn(OH)2 pH值 8.0 9.7 3.2 6.7 9.4 10.4 部分阳离子以氢氧化物形式完全沉淀时溶液的pH参见上表,请回答下列问题: (1)“酸浸”步骤中,为提高锌的浸出率,可采取的措施有 。 “酸浸”时适当补充少量水的原因是 。 (2) 滤液I加入酸性KMnO4所发生反应的离子方程式,请完成剩余产物,并配平相关系数,若系数为1,也需写上 Fe2++ MnO4-+ H+= Fe3++ Mn2++ 加入ZnO的原因是(写出相关方程式以及对应的文字说明) 。 (3) 滤渣III的成份主要是(化学式) 。 (4)从滤液III得到晶体的操作过程为 、冷却结晶、过滤冼涤、小心干燥。 6.氟碳铈矿主要化学成分为CeFCO3,它是提取铈族稀土元素的重要矿物原料。氟碳铈矿的冶炼处理工艺已经发展到十数种,其中一种提取铈的工艺流程如下: 已知:焙烧后烧渣中含+4价的铈及+3价的其它稀土氟氧化物;酸浸I的浸出液中含少量的+3价的铈 请回答下列问题 (1)焙烧前将矿石粉碎成细颗粒的目的是__________________________________. (2)酸浸II后,四价铈转化为三价,为了避免三价铈以四氟硼酸盐形式损失,用可溶性钾盐将四氟硼酸根沉淀除去,该反应的离子方程式为:___________________ (3)在生产过程中,酸浸I 中会产生大量黄绿色气体,污染环境、腐蚀设备,写出产生黄绿色气体的离子方程式:________________________,提出一种解决的方案:__________________________. (4)实验室中进行操作I所用玻璃仪器名称:________________________________;在操作I后的溶液中加入NaOH溶液是为了调节溶液pH值获得Ce(OH)3,测定该溶液pH值的操作是_________________________________________________________. (5)写出氧化步骤的化学方程式:__________________,其中还原产物是________. 7.2011年8月12日,网上传云南曲靖市越州镇有总量5000余吨的重毒化工废料铬渣由于非法丢放,毒水被直接排放南盘江中。 Ⅰ:某工厂对制革工业污泥中Cr(III)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+): 部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表: 阳离子 Fe3+ Fe2+ Mg2+ Al3+ Cu2+ Cr3+ 开始沉淀时的pH 1.9 7.0 —— —— 4.7 —— 沉淀完全时的pH 3.2 9.0 11.1 8 6.7 9 (>9溶解) (1)实验室用18.4 mol·L-1的浓硫酸配制250 mL 4.8 mol·L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需 。 (2)酸浸时,为了提高浸取率可采取的措施是 (至少答一点)。 (3)加入H2O2的作用是_______ ____。 调节溶液的pH=8是为了除去 离子。 (4)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的的杂质离子是____________。 (5)还原过程发生以下反应(请配平): _____Na2Cr2O7+_____SO2+____ ________ = ____ Cr(OH)(H2O)5SO4+ Na2SO4; Ⅱ:工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。其中一种处理方法为电解法:该法用Fe做电极,电解含Cr2O72-的酸性废水,随着电解进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。阳极的电极反应式为 。在阴极附近溶液pH升高的原因是(用电极反应方程式解释) 。 7.(1)以前实验室制备纯碱(Na2CO3)的主要步骤为:将饱和NaCl溶液倒入烧杯加热,控制30—35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕,保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质、抽干,转入蒸发皿中灼烧得Na2CO3固体。 四种盐在不同温度下的溶解度表 (g/100g水) 温度 溶解度 0℃ 10℃ 20℃ 30℃ 40℃ 50℃ 60℃ 100℃ NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3 39.8 NH4HCO3 11.9 15.8 21.0 27.0 — — — — NaHCO3 6.9 8.1 9.6 11.1 12.7 14.5 16.4 — NH4Cl 29.4 33.3 37.2 41.4 45.8 50.4 55.3 77.3 ①反应控制在30—35℃,是因为高于35℃NH4HCO3会分解,低于30℃则反应速率降低 ,为控制此温度范围,通常采取的加热方法为___ ;②加料完毕,保温30分钟,目的__ ;③静置后只析出NaHCO3晶体的原因_____ ;④过滤所得母液中含有NaHCO3、NaCl 、NH4Cl、NH4HCO3,加入适当试剂并作进一步处理,使 _(填化学式)循环使用,回收得到NH4Cl晶体。 (2)我国科学家侯德榜改革国外的纯碱生产工艺,使其更加先进,被称为侯德榜制碱法,生产流程为: ⑤沉淀池中反应的化学方程式: ;⑥检验产品碳酸钠中是否含有氯化钠的操作方法为: ⑦循环(I)中应该加入或通入物质的化学式为 。 10.高温裂解法处理工业废硫酸工艺流程图如下: 废硫酸高温裂解的基本原理可用下列方程按两个阶段进行 H2SO4(l) SO3(g)+ H2O(g) △H= +176kJ·mol-1 2SO3(g)2SO2(g)+ O2(g) △H= +196k·mol-1 为研究废硫酸的雾化和裂解情况,有关实验数据如下: 雾化后废硫酸液滴直径 废硫酸完全裂解所需时间 普通雾化器 800-1200μm 10 s以上 旋转式雾化器 600-850μm 8-10 s 压缩风雾化器 400-650μm 6-7 s 超声波雾化器 100-300μm 3.5-5 s (1) 由上表数据可得出的结论是 ;(2)废硫酸裂解成SO2总反应的热化学方程式为 ;(3)在催化氧化室中发生反应:2SO2(g)+ O2(g)2SO3(g)△H= -196 kJ·mol-1 ①某温度时,该反应的平衡常数K=3.5,平衡后再充入一定量气体测得 100 L的恒容密闭容器中含有3.0 mol SO2,16.0 mol O2和3.0mol SO3(g),此时平衡 移动;(填“向正反应方向”、“向逆反应方向”或“不”) 上反应达到平衡后改变下列条件,能使SO2平衡浓度比原来减小A.保持温度和容器体积不变充入1.mol O2B.保持温度和容器内压强不变充入3.0mol N2C.降低温度D.其他条件不变缩小容器的容积 (4)尾气SO2用饱和Na2SO3溶液吸收可得到一种化工原料,反应的化学方程式为 ; (5)科学家研究出以右图所示装置用电化学原理生产硫酸的新工艺,其阳极的电极反应式为 ,总反应的化学方程式为 。 10. 1942年,我国化工专家侯德榜以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱,他的“侯氏制碱法”为世界制碱工业做出了突出贡献。有关反应的化学方程式如下: NH3+CO2+H2O NH4HCO3 ; NH4HCO3+NaCl NaHCO3↓+NH4Cl ; 2NaHCO3 Na2CO3+CO2↑+H2O (1)“侯氏制碱法”把合成氨和纯碱两种产品联合生产,请写出工业合成氨的化学反应方程式 ;已知合成氨为放热反应,若从勒夏特列原理来分析,合成氨应选择的温度和压强是 (选填字母)。 a.高温 b.低温 c.常温 d.高压 e.低压 f.常压 (2)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 。 a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解 c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出 (3)某探究活动小组根据上述制碱原理,欲制备碳酸氢钠,同学们按各自设计的方案进行实验。 第一位同学:将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。 请回答: ①写出甲中发生反应的离子方程式 。 ②乙装置中的试剂是 。 ③实验结束后,分离出NaHCO3 晶体的操作是 (填分离操作的名称)。 第二位同学:用图中戊装置进行实验(其它装置未画出)。 ①为提高二氧化碳在此反应溶液中被吸收的程度,实验时,须先从a管通入 气体,再从b管中通入 气体。 ②装置c中的试剂为 (选填字母)。 e.碱石灰 f.浓硫酸 g.无水氯化钙 (4)请你再写出一种实验室制取少量碳酸氢钠的方法(用简要的文字和相关的化学反应方程式来描述): 。 11.过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面。下图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程。 请回答下列问题: (1)操作①应包括下列操作中的 A.溶解 B.过滤C.蒸馏 D.分液 E.蒸发结晶 (2)用氨水调节pH至8~9的目的是 。(3)若测得滤液C中c(CO32-)=10-3 mol/L,则Ca2+ (填“是”或“否”)沉淀完全。[已知c(Ca2+)≤10-5mol/L可视为沉淀完全;Ksp(CaCO3)=4.96×10-9](4)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中,c(NH4+) c(NO3-)(5)操作②是:在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,写出该反应的化学方程式 。一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9~11,才出现大量沉淀。用简要的文字解释需用氢氧化钠调节pH至9~11的原因 。(6)已知大理石含CaCO3的质量分数为a,mg大理石可以制得ngCaO2,请计算:CaCO3转化为CaO2过程中,Ca原子的利用率为 。 12.氯化亚铜(CuCl)在石油工业生产中常用作脱硫剂和脱色剂。工业生产氯化亚铜的一种工艺流程如下图所示: 已知:①CuCl难溶于水和乙醇,干燥的CuCl在空气中比较稳定,但湿的CuCl在空气中易发生水解和氧化;②CuCl溶于氯化钠的浓溶液可生成CuCl2-,CuCl2-的溶液用水稀释可生成CuCl沉淀,反应式为CuCl2-CuCl↓+Cl―。 (1)往CuSO4和NaCl混合液中通入SO2可生成CuCl2-和硫酸,请写出反应的离子方程式:____________________________。 (2)在反应⑴中,温度升至70~80℃,并使用NaCl浓溶液,主要目的是______。 (3)在反应⑴中,还原剂除了可用SO2外,还可选用______(填标号)。 A.Na2SO3 B.Cu C.Ag (4)过滤所得沉淀须迅速用____(填“水”或“95%乙醇”)洗涤、干燥得CuCl成品。 (5)合成氨工业生产中的CO会使催化剂中毒,可通过下列反应除去。 [Cu(NH3)2]Ac(aq)+CO(g)+NH3(g)=[Cu(NH3)3]Ac·CO(aq) △H<0,生产中为了提高CO的吸收率,可采用的措施是__________。 ⑹CuOH不稳定易分解为Cu2O。CuOH的Ksp=1.0×10-14,CuCl的Ksp=1.2×10-6。把CuCl固体和NaOH溶液混合,加热,得到红色沉淀,该沉淀的化学式为____。 13.(13分) 某化学兴趣小组同学在馓“证明海带中存在碘元素”的实验时,对课本上的描述:“海带灼烧后的灰烬中碘元素以I-形式存在”产生了疑问。久置KI固体被氧化变质,呈浅黄色(有I2),KI固体直接加热时,为什么不被氧化呢?因此,小组同学针对I-被氧化条件除了氧气之外还需要什么条件进行了实验探究。 【提出假设】根据久置KI固体会被氧化而变质,结合空气的成分,首先排除 和稀有气体的影响。然后对KI变质条件提出合理假设: 假设一:需要H2O的参与; 假设二:需要CO2的参与; 假设三: 。 【实验验证】 (1)为了验证假设二,小组同学设计了以下实验方案;取10mLKI溶液(浓度较大)于5支试管中,向试管中通入CO2气体或者滴加盐酸。一段时间后对比试管中的颜色深浅,之后向试管中滴入淀粉溶液,再次对比试管中的颜色深浅,具体实验现象见下表: 试管序号 1 2 3 4 5 通入CO2时间/min 0 1 5 滴加盐酸/滴 0 3 6 溶液中颜色对比 无色 浅黄色→黄色(依次加深) 滴加淀粉溶液后的颜色对比 无色 浅蓝色→蓝色(依次加深) 小组同学通过实验现象深入思考了CO2在反应过程中的作用,得出结论:CO2气体同盐酸一样在KI被氧化的过程中提供 环境。 写出此实验中CO2与KI反应的化学方程式 。 (2)为了验证I-被氧化是否必须要有H2O的参与,小组同学设计了以下实验验证: 实验步骤 预期现象和结论 ①取一份纯净的KI固体,分成两等份; ②一份加入到装有 的集气瓶A中; 一份加入到装有 的集气瓶A中; ③几天后观察。 【交流提高】 由于空气中CO2和水蒸气的含量很低,导致在加热KI的过程中这两种气体很容易被“驱 散”,不能很好地与KI接触,KI自然就不能被氧化。长时间保存碘化钾需要避光、 。 28.(14分)聚合硫酸铁又称聚铁,化学式为[Fe2(OH)n(SO4)3-0.5n]m, 广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),过程如下: (1)验证固体W焙烧后产生的气体含有SO2的方法是:________________________。 (2)实验室制备、收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向连接各仪器接口,顺序为a→____→____→____→____→f。 装置A中发生反应的化学方程式为_________________________________________。 (3)制备绿矾时,向溶液X中加入过量__________,充分反应后,经过滤操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾。过滤所需的玻璃仪器有_____________________。 (4)欲测定溶液Y中Fe2+的浓度,需要用容量瓶配制KMnO4标准溶液,用KMnO4标准溶液滴定时应选用________滴定管(填“酸式”或“碱式”)。 (5)溶液Z的pH影响聚铁中铁的质量分数。若溶液Z的pH偏小,将导致聚铁中铁的质量分数______(填“偏大”、“偏小”或“无影响”)。 36. 世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热。实验室以电解法制备ClO2的流程如下: (1) ClO2中所有原子_____________(填“是”或“不是”)都满足8电子结构。上图所示电解法制得的产物中杂质气体B能使石蕊试液显蓝色,除去杂质气体可选用_________ A.饱和食盐水 B.碱石灰 C.浓硫酸 D.蒸馏水 (2)稳定性二氧化氯是为推广二氧化氯而开发的新型产品,下列说法正确的是 ( ) A.二氧化氯可广泛用于工业和饮用水处理 B.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围 C.在工作区和成品储藏室内,要有通风装置和监测及警报装置 (3) 欧洲国家主要采用氯酸钠氧化浓盐酸制备。化学反应方程式为_____________________________。缺点主要是产率低、产品难以分离,还可能污染环境。 (4) 我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式是 ___________________,此法相比欧洲方法的优点是____________________________。 (5) 科学家又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸 钠,化学反应方程式为______________________________________________________。 此法提高了生产及储存、运输的安全性,原因是 _________________________________。 16、从废钒催化剂(主要成分V2O5、Fe2O3和SiO2等)中回收V2O5的一种生产工艺流程示意图如下: 回答下列问题: (1)①中废渣的主要成分是 。 (2)②、③中的变化过程可简化为(下式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂的主要成分): Rn+ (水层) + nHA (有机层) RAn (有机层) + nH+ (水层) ②中萃取时必须加入适量碱,其原因 。 ③中反萃取时加入的X试剂是 。 (3)完成④中反应的离子方程式: ClO+ VO2++ H+= VO3++ Cl- + (4)25 ℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间的关系如下: pH 1.3 1.4 1.5 1.6 1.7 1.8 1.9 2.0 2.1 钒沉淀率/% 88 92 93 95 95 95 93 90 87 根据上表数据判断,⑤中加入氨水,调节溶液pH最佳值为 ;若钒沉淀率为90%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< 。 (已知:25 ℃时,Ksp[Fe(OH)3]=2.6×10-39) (5)在整个工艺流程中,可以循环利用的物质是水、 和 。 (6)写出废液Y中除H+之外的两种阳离子 、 。 17.(14分)(1)甲醇是一种优质燃料,可制作燃料电池。 已知:①2CH3OH(1) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1 = –1275.6 kJ·mol– 1 ②2CO(g) + O2(g) = 2CO2(g) ΔH2 = –566.0 kJ·mol– 1 ③H2O(g) = H2O(1) ΔH3 = –44.0 kJ·mol– 1 写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。 (2)电浮选凝聚法是工业上采用的一种污水处理方法。实验室模拟该方法设计的装置如下图所示。 ①图中燃料电池是以熔融碳酸盐为电解质,以甲烷为燃料,空气为氧化剂,稀土金属材料为电极。下列物质可用做电池中熔融碳酸盐的是____(填字母)。 A. MgCO3 B. Na2CO3 C. NaHCO3 D.(NH4)2CO3 常温下,若将选择的碳酸盐溶于水,则溶液中离子浓度由大到小的顺序是 。 ②根据图示信息,已知正极的电极反应式是O2+2CO2+4e- = 2CO32-,则电池负极反应式是 。 ③电解池阳极反应式是 和则阳极产物相互反应生成某金属氢氧化物胶体的离子方程式是 。 电解前污水的pH~5.0~6.0,通过控制电流强度也可形成此金属氢氧化物胶体而使污水净化,其净水原理为 。 ④实验过程中,测得电解池阴极产生44.8L气体(标准状况下),该气体把悬浮物带到水面形成浮渣层,同时在电池的负极通入16.8LCH4。(标准状况下),则该电浮选聚装置的能量利用率为 。 18.(16分)辉铜矿是铜矿的伴生矿, 主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。把辉铜矿经过精选粉碎后,用来加工制备硝酸铜的工艺流程如下: (1) 写出矿石与足量的FeCl3溶液生成S单质时发生的离子方程式 写出操作2需要用到的玻璃仪器的名称 。 (2)为保证产物的纯净,需要对沉淀1进行洗涤,写出洗涤的操作过程 。 (3)进行操作3时需要向滤液3中加入适量的 ,请结合离子方程式解释其原因 。 (4)焙烧辉铜矿会产生大气污染物SO2,实验室探究SO2的性质,按下图装置进行实验。 实验中,对于装置B中溶液红色褪为无色的现象,甲同学猜测是由于SO2显酸性引起的,乙同学猜测是由于SO2有漂白性引起的。你认为 的猜测正确,请设计简单实验证明。 。 ②装置C可证明SO2具有还原性,则C中的溶液可选用 (填化学式),验证SO2具有还原性的实验现象为 。 ③该实验剩余的SO2需要吸收处理,在D处框内画出尾气处理装置图并指明所用试剂。 3、碳酸锂广泛应用于陶瓷和医药等领域。已β-锂辉石(主要成分为Li2OAl2O34SiO2)为原材料制备Li2CO3的工艺流程如下: 已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的PH分别为3.2、5.2、9.7和12.4;Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g. (1)步骤Ⅰ前,B-锂辉石要粉碎成细颗粒的目的是_____________. (2)步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li+、SO42-,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,需在搅拌下加入_____________(填“石灰石”、“氯化钙”或“稀硫酸”)以调节溶液的PH到6.0~6.5,沉淀部分杂质离子,然后分离得到浸出液。 (3)步骤Ⅱ中,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可除去的杂质金属离子有______________. (4)步骤Ⅲ中,生成沉淀的离子方程式为________________. (5)从母液中可回收的主要物质是_____________. 4、 (NH4)2SO4是农业生产中常见化肥之一,某工厂用石膏、NH3、H2O、CO2制备(NH4)2SO4,首先石膏磨成粉制成CaSO4悬浊液,然后按如下工艺流程进行产生: (1)操作1与操作2的顺序能否调换? (填能与否),理由是 。 (2)常温下,CaCO3和CaSO4的溶解度分别为1.5X10-3g和2.1X10-1g,请解析CaSO4向CaCO3转化的原因。 (3)判断操作2通入“适量CO2”的简单实验方法是 (4)从绿色化学角度考虑,该工艺流程应增加一个操作,这个操作是 。 (5)豆腐是日常食品之一,它的制作过程中使用了石膏或盐卤,其中包含的化学原理是 。 5、以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸钠和氧化铁红颜料,原料的综合利用率较高。其主要流程如下: (1)反应I前需在FeSO4溶液中加入 (填字母),以除去溶液中的Fe3+。 A.锌粉 B.铁屑 C.KI溶液 D.H2 (2)反应Ⅰ需控制反应温度低于35℃,其目的是 。 (3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是 。 (4)反应Ⅳ常被用于电解生产(NH4)2S2O8 (过二硫酸铵)。电解时均用惰性电极,阳极发生地电极反应可表示为 。 6、某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、 CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下: 沉淀物 Fe(OH)3 Al(OH)3 Mg(OH)2 PH 3.2 5.2 12.4 部分阳离子以氢氧化物形式完全深沉时溶液的pH由见上表,请回答下列问题: (1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有 (要求写出两条)。 (2)滤渣I的主要成分有 。 (3)从滤渣Ⅱ中可回收利用的主要物质有 。 (4)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备: MgCl2+2NaClO3===Mg(ClO3)2+2NaCl 已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示: ①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2。简述可制备Mg(ClO3)2的原因: 。 ②按①中条件进行制备实验。在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是: 。除去产品中该杂质的方法是: 。 1. ⑴ 漏斗、蒸发皿 ⑵ 2Al+2OH—+2H2O=2AlO2—+3H2↑、Al2O3+2OH—=2AlO2—+3H2O ⑶ H2SO4 Ni2+ 、Fe2+ ⑷ 3.2—9.2 ⑸ 防止在浓缩结晶过程中Ni2+水解 ⑹ H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的 2. (1)Cl2+2OH—=Cl—+ClO—+H2O(2分) (2)<(2分) (3)①26 (1分) 1.2(1分) ②3ClO—+Fe3++3H2O=Fe(OH)3↓+3HClO (2分) 2FeO42—+Fe3++8OH—=3FeO43—+4H2O(2分) (4)B(2分) 3. (任写出其中两个即给分,每空 3分,共 6分) (2) 分液 分液漏斗 (各2分,共4分) (3)FeSO4·7H2O (2分,只写FeSO4得1分) (4) Cu2+ + 2e- = Cu (2分) (5) H2SO4 (2分) 4.(16分,每空2分) (1)硫酸溶液 (2)2H++H2O2+2Fe2+ =2Fe3++2H2O (3)B;Fe(OH)3 Al(OH)3 (4)Zn ;Cd和Zn (5)加热浓缩、蒸发结晶、过滤(洗涤);保持溶液一定的酸度 5.(11分) (1)增大硫酸浓度或加热升高温度或边加硫酸边搅拌或增加浸出时间(2分)(要求写出一条即可)。防止硫酸锌中从溶液中析出。(1分) (2)5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O (2分,不配平扣1分) 因为Fe3++3H2O Fe(OH)3+3H+,ZnO+2H+=Zn2++H2O,加入ZnO能促进Fe3+水解生成Fe(OH)3而除去。(2分) (3)Zn、Cd、Cu(2分,漏写扣1分) (4)蒸发浓缩 (2分) 6.(1)增大固体与空气的接触面积,增大反应速率;提高原料的利用率 (2)K+ + BF4- = KBF4↓ (3)2Ce4+ +2Cl- = 2Ce3+ + Cl2↑ 用H2SO4酸浸 (4)漏斗 烧杯 玻璃棒;撕下一小片pH试纸放在干燥洁净的表面皿上,用玻璃棒蘸取该溶液点在pH试纸的中央,然后与标准比色卡对比。 (5)2Ce(OH)3 + NaClO + H2O = 2Ce(OH)4 + NaCl NaCl 7.(16分) Ⅰ:(1)250mL容量瓶(1分)、胶头滴管(1分) (2)①升高反应温度,②搅拌,③过滤后再向滤渣中加入硫酸(多次浸取),④适当延长浸取时间(只要答出任意一点即可,可从反应温度、溶液的pH、搅拌速度、溶剂的配比等角度)(2分) (3)氧化+3价Cr使之转变成+6价Cr(或Cr2O72-),以便于与杂质离子分离(2分); Fe3+和Al3+ (2分,各1分) (4)Ca2+、Mg2+ (2分,各1分) (5)1, 3, 11H2O, 2, 1(2分), Ⅱ:Fe-2e-= Fe2+(2分), 2H++2e-=H2↑(2分) 8. (16分) (1)增大固体反应物的表面积,增大化学反应的速率。(2分) (2) 2Al+2OH-+2H2O=2AlO2-+3H2↑; Si+2NaOH+H2O=Na2SiO3+2H2↑; Al2O3+2OH-=2AlO2-+H2O; SiO2+2NaOH=Na2SiO3+H2O 。 (每写出其中1个给2分,共4分,没气体符号扣1分,未配平0分) 2Fe2+ +H2O2 +2H+ =2Fe3+ +2H2O (2分) (3)C、D (2分) Fe(OH)3 (1分) (4)加热蒸发浓缩时会导致Cu2+发生水解生成Cu(OH)2,用硫酸调节pH=2~3是为了抑制Cu2+的水解,也不会引入杂质。 (2分) 蒸发浓缩,冷却结晶,过滤。 (3分) 7.①:水浴加热、②:使反应充分进行 (或使NaHCO3晶体充分析出)③:NaHCO3的溶解度最小④:NaCl⑤: NH3+CO2+H2O + NaCl=NH4Cl+NaHCO3↓或 NH3+CO2+H2O=NH4HCO3 ;NH4HCO3+NaCl=NaHCO3↓+NH4Cl⑥可取少量试样溶于水,滴加过量稀硝酸,再滴加过量硝酸银,观察最终是否有沉淀 ⑦NH3 10.(1)废硫酸液滴直径越小裂解速率越快(其它合理答案也给分) (2)2H2SO4(l)==== 2SO2(g)+ O2(g)+ 2H2O(g) △H= +548 kJ·mol-1 (3)①向逆反应方向 ②A、C (4)SO2+ H2O + Na2SO3=2NaHSO3 (5)SO2+ 2H2O=SO42-+ 4 H+ + 2e- 2SO2+ O2+ 2H2O== 2H2SO4 11.(1)A、B、E(2)除去Fe3+(3)是(4)<(5)CaCl2+H2O2CaO2+2HCl(或CaCl2+H2O2+2NaOH=CaO2↓+2NaCl+2H2O) 加入NaOH溶液使上述平衡向正反应方向,有利于CaO2沉淀的生成。(6)25n/18am 12.(1)2Cu2++SO2+4Cl―+2H2O=2CuCl2-+SO42―+4H+ (2)提高CuCl2-的生成速率(3)AB(4)95%乙醇(5)加压降温⑹.Cu2O 13、(13分)[提出假设] N2(1分) ; CO2、H2O的共同参与(2分); [实验验证] (1)酸性(1分);4KI + O2 + 2CO2 == 2K2CO3 + 2I2(3分) (2) 实验步骤: 预期现象和结论 ①取一份纯净的KI固体,分成两等份; ②干燥的CO2和O2混合气体(1分) 潮湿的CO2和O2混合气体(1分) 若集气瓶A中的KI固体颜色变黄,则氧化KI可以不需要H2O参加(1分)。 若集气瓶A中的KI固体颜色不变,而集气瓶B的KI固体颜色变黄,则氧化KI必须要有H2O参加(1分)。 [交流提高] 密封且放置在干燥处(2分) 16.(1)SiO2 (1分) (2)加入碱中和产生的酸,平衡右移,提高钒的萃取率 (2分) 硫酸 (2分) (3)1ClO + 6VO2+ + 6H+ === 6VO3++1Cl-+3H2O (2分) (4)1.6 (2分) 2.6 ×10-3 mol·L-1(2分) (5)有机萃取剂 氨气(或氨水) (各1分,共2分) (6)Fe3+、VO3+、NH、K+(任写2种) (2分) 17.答案:(1)(1)CH3OH(1) + O2(g) = CO(g) + 2H2O(1) ΔH = –442.8 kJ·mol– 1 (2分) (2)① B C(Na+)>C(CO32-)>C(OH-)>C(HCO3-)>C(H+)(2分) ②(2分) ③ Fe-2e- == Fe2+(2分) Fe2++10H2O+O2=4Fe(OH)3(胶体)+8H+(2分) 生成的Fe(OH)3胶体具有强吸附性,可吸附水中悬浮污物沉降而使水净化。(2分) ④2/3(66.7%)(2分) 18.答案:(1)Cu2S+4Fe3+=2Cu2++S+4Fe2+;分液漏斗、烧杯 向漏斗中加入蒸馏水至浸没固体,待水自然流出后,再重复2~3次。 (3)稀硝酸;Cu2+在溶液中存在水解平衡,Cu2++2H2O Cu(OH)2+2H+,加入稀硝酸后使平衡逆向移动,抑制Cu2+水解。 ①甲;若向退色后的溶液中加入NaOH,溶液又变成红色,则甲正确。 乙;若将退色后的溶液加热,溶液恢复红色,则乙正确。 ②KMnO4溶液;溶液的紫色退去。 ③碱性试剂,画出合理的装置图均给分。 3、⑴增加接触面积使反应充分同时加快反应速度。⑵石灰石。石灰石与酸作用,才可调节溶液的PH值。调节溶液的PH到6.0~6.5,沉淀部分杂质离子,此时Al3+、Fe3+已除去。⑶Fe2+ ,Mg2+、Ca2+ 。加入适量的H2O2溶液、石灰乳为了把Fe2+ ,Mg2+除去,加入适量Na2CO3溶液为了除去Ca2+ ,过滤后,滤液为LiOH和Li2SO4。蒸发浓缩滤液和加入饱和碳酸钠溶液有利于得到Li2CO3沉淀。 ⑷2Li++CO32-=Li2CO3↓ ⑸NaOH、Na2SO4 4、答案:(1)否,中性条件下CO2的溶解度很小,不能把CaSO4完全转化为CaCO3。(2分) (2)从CaSO4向CaCO3转化中并存着两个沉淀溶解平衡, CaSO4(s) Ca2++SO42-+CO32- CaCO3(s),随着CO2通入CO32-浓度增大,平衡向CaSO4溶解和CaCO3沉淀生成的方向移动,即溶解度小的沉淀转化成溶解度更小的沉淀。(3分) (3)取少量滤液至试管中,加入少量NaOH溶液,无浑浊出现则操作2通入“适量CO2”是正确的。(2分) (4)将滤液提纯(NH4)2SO4后的所有液体用于制CaSO4悬浊液。(2分) (5)胶体中加入电解质,胶体发生聚沉。(1分) 5、答案(1)B (2)防止NH4HCO3分解(或减少Fe2+的水解) (3)降低K2SO4 的溶解度,有利于K2SO4 析出。 (4)2SO42- -2e-2S2O82- 6、答案 (1)升高温度、搅拌、过滤后再向滤渣中加入硫酸(多次浸取) (2)Fe(OH)3 Al(OH)3 (3)Na2SO4 (4)①在某一时NaCl最先达到饱和析出;Mg(ClO3)2的溶解度随温度变化最大;NaCl 的溶解度与其他物质的溶解度有一定的差别。 ②降温前溶液中NaCl以达饱和;降低过程中NaCl溶解度会降低 ,会少量析出。重结晶。查看更多