- 2021-05-13 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020版高考化学大一轮复习化学实验基础与实验化学专项突破练(十)
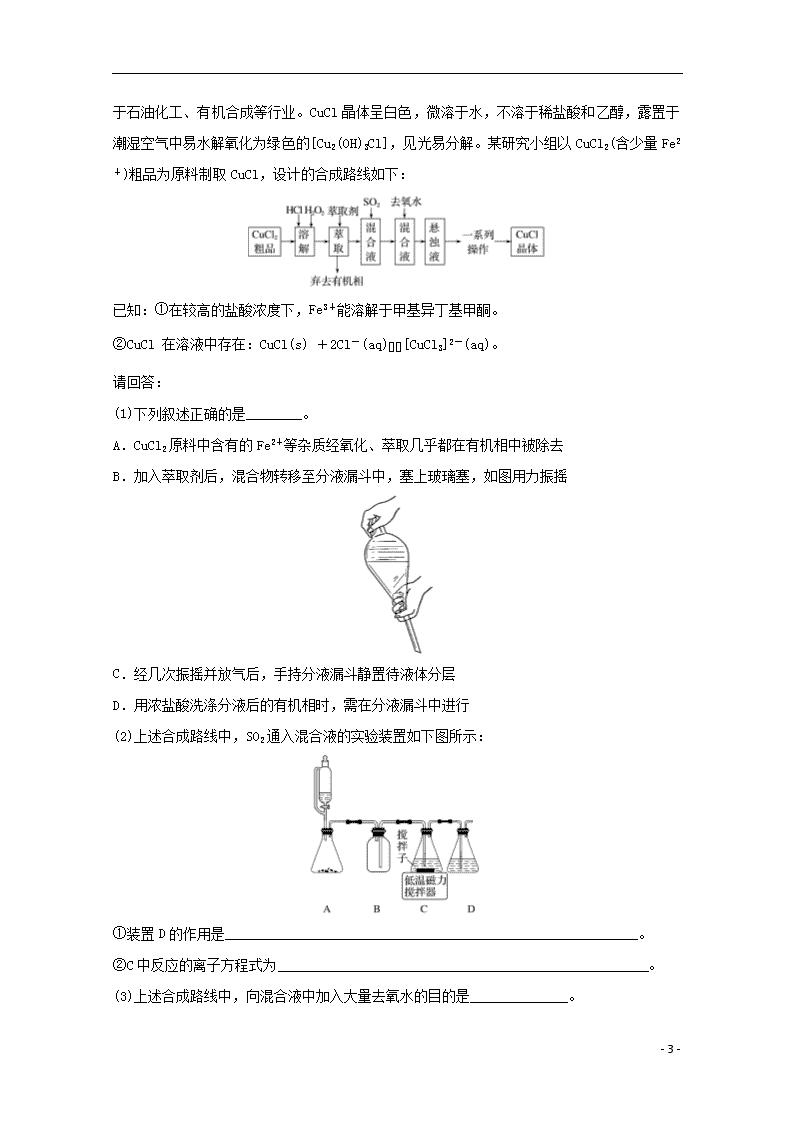
专项突破练(十) 加试第31题 1.(2017·丽水衢州湖州三地市9月教学质量检测)过氧硫酸氢钾复合盐(K2SO4·KHSO4·2KHSO5)易分解,可用作漂白剂、NOx和SO2等的脱除剂。某研究小组制备过氧硫酸氢钾复合盐的流程如下图: 已知:浓硫酸与H2O2反应,部分转化为过氧硫酸(化学式为H2SO5,是一种一元强酸) (1)若反应物的用量一定,在“转化”中为防止过氧化氢的分解,可采取的有效措施或操作有(写出两种)____________________、____________________。 (2)结晶操作中,加入K2CO3反应可获得过氧硫酸氢钾复合盐晶体,该过程的离子方程式为________________________________________________________________________ ________________________________________________________________________。 过氧硫酸氢钾复合盐产率(以产品含氧量表示)随溶液pH和温度的变化关系如下图所示。则该过程适宜的条件是____________________。 - 6 - (3)下列说法不正确的是________。 A.将晶体转移至布氏漏斗时,若器壁上粘有少量晶体,应用滤液淋洗 B.抽滤时,为防止滤纸穿孔,可适当关小水龙头或多加一层滤纸 C.用95%乙醇洗涤晶体目的是洗除晶体表面的杂质,易于得到干燥晶体 D.为加快产品的干燥,可高温烘干 (4)产品中KHSO5含量的测定: 取1.000 g产品于锥形瓶中,用适量蒸馏水溶解,加入5 mL 10%的硫酸和10 mL 25%的碘化钾溶液,再加入2 mL淀粉溶液作指示剂,用0.200 0 mol·L-1的硫代硫酸钠标准液滴定至终点,消耗标准液的体积为25.00 mL。 已知:2KHSO5+4KI+H2SO4===2I2+3K2SO4+2H2O; I2+2Na2S2O3===Na2S4O6+2NaI。 则产品中KHSO5的质量分数为________。 答案 (1)用冰水浴冷却 缓慢滴加浓硫酸,不断搅拌 (2)10K++5CO+12H++4SO+4HSO===2(K2SO4·KHSO4·2KHSO5)↓+5CO2↑+5H2O 控制pH在2.0~2.5之间、温度0 ℃左右 (3)D (4)38.00% 解析 (1)浓硫酸与H2O2溶液混合时,放出大量的热,温度高,H2O2易分解,故在“转化”中,用冰水浴冷却;同时缓慢滴加浓硫酸并不断搅拌也可防止过氧化氢的分解。(2)H2SO5与K2CO3反应可获得过硫酸氢钾复盐晶体,因为H2SO5为一元强酸,故还有二氧化碳生成,则离子方程式为10K++5CO+12H++4SO+4HSO===2(K2SO4·KHSO4·2KHSO5)↓+5CO2↑+5H2O。根据图像可判断0 ℃、pH在2~2.5之间时,过氧硫酸氢钾复合盐产率(以产品含氧量表示)最大,故此条件为最适宜条件。(3)将晶体转移至布氏漏斗时,若器壁上粘有少量晶体,应用滤液淋洗,A正确;抽滤时,为防止滤纸穿孔,可适当关小水龙头或多加一层滤纸,B正确;用95%乙醇洗涤晶体目的是洗除晶体表面的杂质,易于得到干燥晶体,C正确;过氧硫酸氢钾复合盐易分解,不能高温烘干,D错误。(4)已知:2KHSO5+4KI+H2SO4===2I2+3K2SO4+2H2O、I2+2Na2S2O3===Na2S4O6+2NaI,则有关系式KHSO5~2Na2S2O3,消耗硫代硫酸钠的物质的量是0.200 0 mol·L-1×0.025 00 L=0.005 000 mol,所以KHSO5的物质的量是0.002 500 mol,则产品中KHSO5的质量分数为×100%=38.00%。 - 6 - 2.(2017·温州市高三9月选考适应性测试)氯化亚铜是重要的铜盐系列化工产品,广泛应用于石油化工、有机合成等行业。CuCl晶体呈白色,微溶于水,不溶于稀盐酸和乙醇,露置于潮湿空气中易水解氧化为绿色的[Cu2(OH)3Cl],见光易分解。某研究小组以CuCl2(含少量Fe2+)粗品为原料制取CuCl,设计的合成路线如下: 已知:①在较高的盐酸浓度下,Fe3+能溶解于甲基异丁基甲酮。 ②CuCl 在溶液中存在:CuCl(s) +2Cl-(aq)[CuCl3]2-(aq)。 请回答: (1)下列叙述正确的是________。 A.CuCl2原料中含有的Fe2+等杂质经氧化、萃取几乎都在有机相中被除去 B.加入萃取剂后,混合物转移至分液漏斗中,塞上玻璃塞,如图用力振摇 C.经几次振摇并放气后,手持分液漏斗静置待液体分层 D.用浓盐酸洗涤分液后的有机相时,需在分液漏斗中进行 (2)上述合成路线中,SO2通入混合液的实验装置如下图所示: ①装置D的作用是___________________________________________________________。 ②C中反应的离子方程式为_____________________________________________________。 (3)上述合成路线中,向混合液中加入大量去氧水的目的是______________。 - 6 - (4)上述合成路线中,一系列操作包括:抽滤、洗涤、干燥。干燥时应注意密封、__________。 (5)现称取1.200 g产品,用硫酸酸化的硫酸铁溶解,并稀释成250 mL。每次用移液管移取25.00 mL溶液于锥形瓶中,用0.010 00 mol·L-1 KMnO4溶液滴定平均消耗24.00 mL。 ①用移液管吸取25.00 mL溶液后,把溶液转移到锥形瓶中的具体操作为________________________________________________________________________ ________________________________________________________________________ ________________________________________________________________________。 ②产品中CuCl的纯度为________(本实验条件下,Cl-难于被MnO氧化)。 答案 (1)AD (2)①吸收尾气,防止污染环境 ②2Cu2++SO2+2H2O+6Cl-===2[CuCl3]2-+SO+4H+ (3)使平衡CuCl(s) + 2Cl-[CuCl3]2-逆向移动,生成CuCl沉淀 (4)避光 (5)①将移液管垂直放入稍倾斜的锥形瓶中,使管尖与锥形瓶内壁接触,松开食指使溶液全部流出,数秒后,取出移液管 ②99.50% 解析 (1)①在较高的盐酸浓度下,Fe3+能溶解于甲基异丁基甲酮可知,Fe2+等杂质经氧化、萃取几乎都在有机相中被除去,故A正确;加入萃取剂后,混合物转移至分液漏斗中,塞上玻璃塞,用力反复倒转振摇,故B错误;经几次振摇并放气后,将分液漏斗置于铁架台上静置待液体分层,故C错误;用浓盐酸洗涤分液后的有机相时,需要分液,则要在分液漏斗中进行,故D正确。 (2) ①二氧化硫有毒,需要用氢氧化钠吸收尾气,防止污染环境。 ②C中Cu2+与SO2发生氧化还原反应生成[CuCl3]2-和SO。 (3)向混合液中加入大量去氧水减小溶液的浓度,使平衡CuCl(s) + 2Cl-[CuCl3]2-逆向移动,生成CuCl沉淀。 (5)①用移液管吸取25.00 mL溶液的操作是将移液管垂直放入稍倾斜的锥形瓶中,使管尖与锥形瓶内壁接触,松开食指使溶液全部流出,数秒后,取出移液管。 ②根据关系式 5CuCl ~ KMnO4 497.5 g 1 mol x g 0.01 mol·L-1×0.024 L x=0.119 4 - 6 - CuCl的纯度为××100%=99.5%。 3.(2017·金华市高三9月十校联考)甲酸铝广泛用于化工、石油等生产,120~150 ℃左右分解。在0 ℃时,溶解度为16 g,100 ℃时,溶解度为18.4 g。 首先用废铝渣制取Al(OH)3固体,流程如下: (1)调节pH用________试剂为好。某同学在减压过滤时,布氏漏斗内没有得到产品,可能原因是________________________________________________________________________ ________________________________________________________________________。 - 6 - 然后将氢氧化铝和甲醛依次加入到质量分数为50%的过氧化氢溶液中(投料物质的量之比依次为1∶3∶2),装置如图1,最终可得到含甲酸铝90%以上的优质产品。反应式为2Al(OH)3+6HCHO+3H2O2===2Al(HCOO)3+6H2O+3H2↑。 (2)反应过程可看作两步进行,第一步__________________________________(写出化学方程式),第二步为甲酸与Al(OH)3反应生成甲酸铝。 (3)反应温度最好控制在30~70 ℃之间,温度不宜过高,主要原因是_________________ ____________________________________________________________________________。 (4)实验时需强力搅拌45 min,最后将溶液________,抽滤,洗涤,干燥得产品。可用酸性KMnO4标准溶液滴定法来测定产品纯度,滴定起始和终点的滴定管液面位置见上图2, 则消耗的酸性KMnO4标准溶液体积为______ mL。 答案 (1)氨水 生成的Al(OH)3 是胶状沉淀 (2)2HCHO+H2O2===2HCOOH+H2↑ (3)防止H2O2分解及HCHO挥发 (4)蒸发结晶 16.00 解析 (1)氢氧化铝易溶于强碱,难溶于弱碱,为减少氢氧化铝的损失,选用弱碱;氢氧化铝胶体能透过滤纸。(2)根据题意,第一步反应为甲醛被氧化为甲酸。(3)温度过高H2O2分解速率加快、HCHO挥发速度加快。(4)甲酸铝的溶解度受温度影响不大,获得晶体的方法是蒸发结晶;滴定开始时液面读数是2.50,滴定结束时液面读数是18.50。消耗的酸性KMnO4标准溶液的体积为16.00 mL。 - 6 -查看更多