- 2021-05-13 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高考化学第一轮复习 专题 化学反应的热效应学案 鲁科版
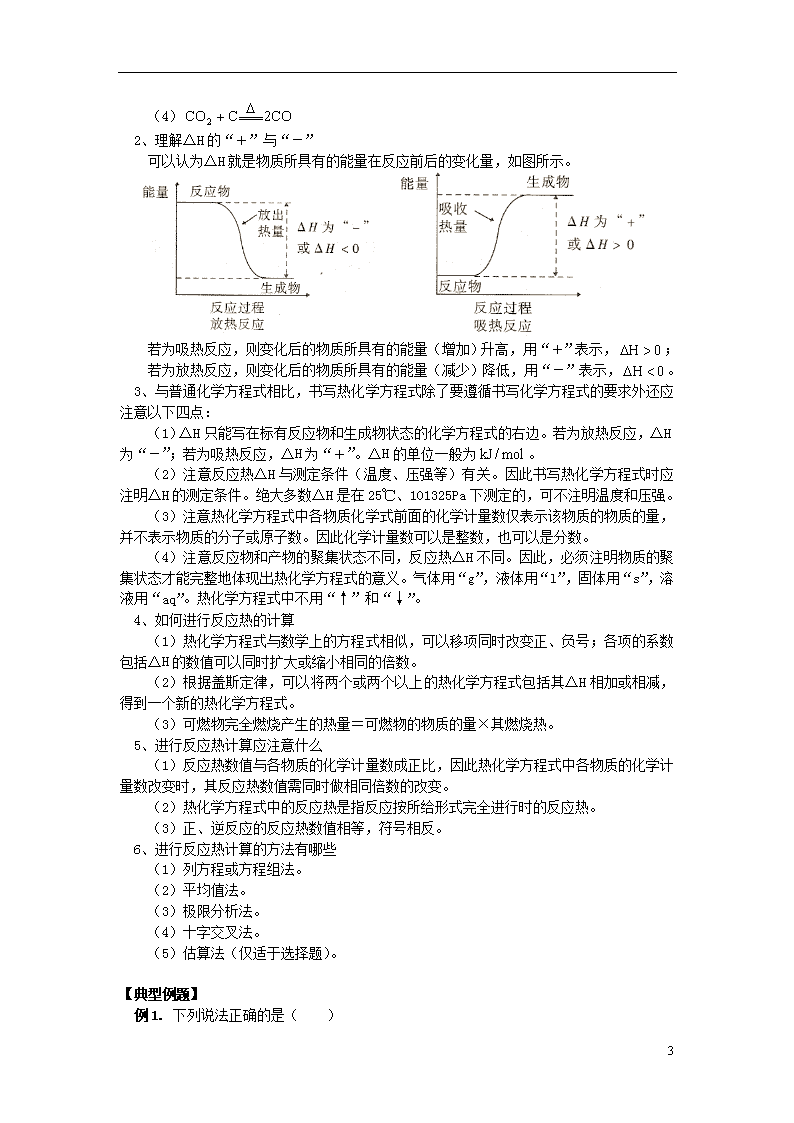
专题 化学反应的热效应 【本讲教育信息】 一. 教学内容: 高考第一轮复习 《化学选修4》 第1章 化学反应与能量变化 第1节 化学反应的热效应 1、化学反应的反应热 2、化学反应的焓变 3、反应焓变的计算 二. 教学目的: 1、掌握化学反应中能量变化的主要原因。 2、掌握反应热和焓的概念。 3、掌握热化学方程式的书写。 4、掌握盖斯定律并用之进行相关计算。 三. 重点和难点: 1、反应热概念的含义。 2、热化学方程式的书写。 3、反应焓变的计算。 四. 考点分析: 本节内容在高考中的主要考查点是: 1、热化学方程式的书写与正误判断。 2、有关反应焓变的计算、比较焓变的大小。 3、燃烧热、中和热的概念及计算。 五. 知识要点 1、反应热 焓变 (1)根据化学反应过程中的热量变化,可以把化学反应分为___________反应和___________反应。 (2)化学反应过程中_____________叫做反应热,又称为_____________,符号用___________表示,单位常采用_____________。许多化学反应的反应热可以通过___________测量。 (3)任何化学反应都有反应热,这是由于在化学反应过程中,当反应物分子内的化学键断裂时,需要克服_____________间的_____________,这需要_____________能量;当原子重新结合成生成物分子,即新_____________形成时,又要_____________能量。生成物释放的总能量比反应物吸收的总能量大时为_____________反应;反之为_____________反应。 (4)对于放热反应,由于反应后放出热量而使反应体系的能量___________,因此△H为_____________或△H_____________0;对于吸热反应,由于反应通过加热、光照等吸收能量而使体系的能量升高,因此吸热反应的△H为_____________或△H_____________0。 2、热化学方程式 (1)定义 能表示参加反应_____________和____________关系的化学方程式,叫做热化学方程式。 6 (2)特点(与化学方程式比较) ①指明了反应时的_____________和_____________,如在_____________下进行的反应,可不注明。 ②在化学方程式右边注明△H的_____________、_____________和_____________。 ③所有反应物和产物都用括号注明了它们在反应时的_____________。 ④化学计量数只表示_____________,而不表示分子数或原子数,因此可以为__________整数。 ⑤化学计量数和反应热的数值可以同时扩大或缩小____________倍数。 3、盖斯定律 不管化学反应是一步或____________完成,其反应热是____________的。或者说,化学反应的反应热只与反应体系的____________和____________有关,而与反应的____________无关。 4、燃烧热 (1)根据___________的情况不同,反应热可分多种,例如燃烧热、___________热、___________热等,其中以跟燃料品质相关的___________热实际应用较广。 (2)燃烧热是指___________时,___________纯物质___________燃烧生成___________的化合物时所放出的热量。 (3)燃烧热的单位是___________,燃烧热通常可利用___________由___________测得。 (4)选择燃料应从物质的燃烧热、燃料的___________、___________、___________、___________、___________、对___________的影响等方面综合考虑。 [注意] 1、放热反应与吸热反应 化学反应中的能量变化,通常表现为热量的变化。对化学反应,以反应过程中放热或吸热为标准划分,分为放热反应和吸热反应两种类型。有热量放出的反应叫放热反应,需要吸收热量的化学反应叫吸热反应。 常见的放热反应有: (1)活泼金属与或酸的反应。如 (2)酸碱中和反应。如 (3)燃烧反应。如 (4)多数化合反应。如 常见的吸热反应有: (1)多数的分解反应,如 (2) (3) 6 (4) 2、理解△H的“+”与“-” 可以认为△H就是物质所具有的能量在反应前后的变化量,如图所示。 若为吸热反应,则变化后的物质所具有的能量(增加)升高,用“+”表示,; 若为放热反应,则变化后的物质所具有的能量(减少)降低,用“-”表示,。 3、与普通化学方程式相比,书写热化学方程式除了要遵循书写化学方程式的要求外还应注意以下四点: (1)△H只能写在标有反应物和生成物状态的化学方程式的右边。若为放热反应,△H为“-”;若为吸热反应,△H为“+”。△H的单位一般为。 (2)注意反应热△H与测定条件(温度、压强等)有关。因此书写热化学方程式时应注明△H的测定条件。绝大多数△H是在25℃、101325Pa下测定的,可不注明温度和压强。 (3)注意热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,并不表示物质的分子或原子数。因此化学计量数可以是整数,也可以是分数。 (4)注意反应物和产物的聚集状态不同,反应热△H不同。因此,必须注明物质的聚集状态才能完整地体现出热化学方程式的意义。气体用“g”,液体用“l”,固体用“s”,溶液用“aq”。热化学方程式中不用“↑”和“↓”。 4、如何进行反应热的计算 (1)热化学方程式与数学上的方程式相似,可以移项同时改变正、负号;各项的系数包括△H的数值可以同时扩大或缩小相同的倍数。 (2)根据盖斯定律,可以将两个或两个以上的热化学方程式包括其△H相加或相减,得到一个新的热化学方程式。 (3)可燃物完全燃烧产生的热量=可燃物的物质的量×其燃烧热。 5、进行反应热计算应注意什么 (1)反应热数值与各物质的化学计量数成正比,因此热化学方程式中各物质的化学计量数改变时,其反应热数值需同时做相同倍数的改变。 (2)热化学方程式中的反应热是指反应按所给形式完全进行时的反应热。 (3)正、逆反应的反应热数值相等,符号相反。 6、进行反应热计算的方法有哪些 (1)列方程或方程组法。 (2)平均值法。 (3)极限分析法。 (4)十字交叉法。 (5)估算法(仅适于选择题)。 【典型例题】 例1. 下列说法正确的是( ) 6 A. 需要加热方能发生的反应一定是吸热反应 B. 放热的反应在常温下一定很易发生 C. 反应是放热的还是吸热的必须看反应物和生成物所具有的总能量的相对大小 D. 吸热反应在一定的条件下也能发生 分析:化学反应的能量变化主要表现为放热或吸热。反应是放热还是吸热主要取决于反应物和生成物所具有的总能量的相对大小。放热反应和吸热反应在一定的条件下都能发生。反应开始时需要加热的反应可能是吸热反应,也可能是放热反应。吸热反应开始加热,反应后需不断加热才能使反应继续进行下去;放热反应开始加热,反应后会放出一定的热量,如果此热量足够大可使反应维持下去,则反应过程不需要再加热,如煤的燃烧,一旦加热使煤燃烧起来后就可继续燃烧下去,不需外界再加热。 答案:CD 例2. 在相同温度和压强下,将32g硫分别在纯氧气中和空气中完全燃烧,令前者放出热量为,后者放出热量为,则关于的相对大小正确的判断是( ) A. B. C. D. 无法判断 分析:根据硫的性质可知:硫在纯氧气中燃烧比在空气中旺、反应剧烈,结果是放出热量集中,产生温度较高,于是,得到结论B,这是把温度与热量混淆的结果。再仔细一些发现,硫是相同质量、相同状态,氧气也是相同质量及相同状态,只是反应时剧烈程度不同,放热时间不同,产生温度不同,放热数值应是相同的,于是得到结论A。事实是相同的反应物具有相同的能量,相同的生成物具有相同的能量,两种环境下反应时,反应物与生成物之间能量差别也是相同的。但能量是守恒的,这些能量并不一定完全以热量形式放出,第一种情况下反应剧烈,产生的“明亮的蓝紫色火焰”较第二种情况下产生的“微弱的淡蓝色火焰”相比较以光能形式释放的能量要多。所以以热量形式放出的能量就应较在空气中放出的热量少些。 答案:C 例3. 已知在条件下,2mol氢气燃烧生成水蒸气放出484kJ的热量,下列热化学方程式正确的是( ) 分析:热化学方程式的书写要求与普通方程式的区别有三:①一定要标明各物质的状态,B选项中水为液态,排除。②计量系数可用分数表示其实际物质的量,且与热量成正比。③用△H表示时,吸热,其值为正;放热,其值为负。反应生成水蒸气是放热反应,△H应为负值,而其逆反应△H则为正值。故排除C、D,而选A。 答案:A 例4. 已知:。推测含1mol HCl的稀溶液与含的稀溶液反应放出的热量( ) A. 大于57.3kJ B. 等于57.3kJ C. 小于57.3kJ D. 无法确定 6 分析:本题考查的是中和热的概念。是弱碱,反应中电离要吸热,使得此时放出的热量小于中和热。 答案:C 例5. 已知下列两个热化学方程式: 实验测得氢气和丙烷的混合气体共5mol,完全燃烧时放热3847kJ,则混合气体中氢气 和丙烷的体积比是( );两者放出的热量之比约为( ) A. 1:3 B. 3:1 C. 1:4 D. 5:13 分析:该题为计算型选择题,可采用以下两种方法巧解。 方法一:十字交叉法: 的平均燃烧热 两者放出的热量之比 方法二:估算排除法: 因的燃烧热为,而两者燃烧共放热3874kJ,故的体积比一定大于1:1,而四个选项中惟有B选项3:1>1:1符合题意。 两者放出的热量之比也只需列出解法一中的计算式,再估算并对照选项便可选定D选项为答案。 答案:BD 例6. 已知火箭发射时可用肼()作燃料,二氧化氮作氧化剂,这两者反应生成氮气和水蒸气。 且 请计算1mol气态肼和完全反应时放出的热量为___________kJ,并写出肼与反应的热化学方程式。 分析:根据题意,要求下列反应的反应热△H的值:根据盖斯定律,一个反应仅与其始态和终态有关,而与其过程无关,有②-①÷2=③,即。 6 答案:567.85; 例7. 25℃,101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是,则下列热化学方程式正确的是( ) 分析:根据燃烧热的定义,燃烧产物应是二氧化碳;氢气燃烧是放热反应();甲烷的燃烧产物是气态二氧化碳和液态水。 答案:D 6查看更多