- 2021-05-13 发布 |
- 37.5 KB |
- 16页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
中考化学复习专题二物质的变化和性质鲁教版
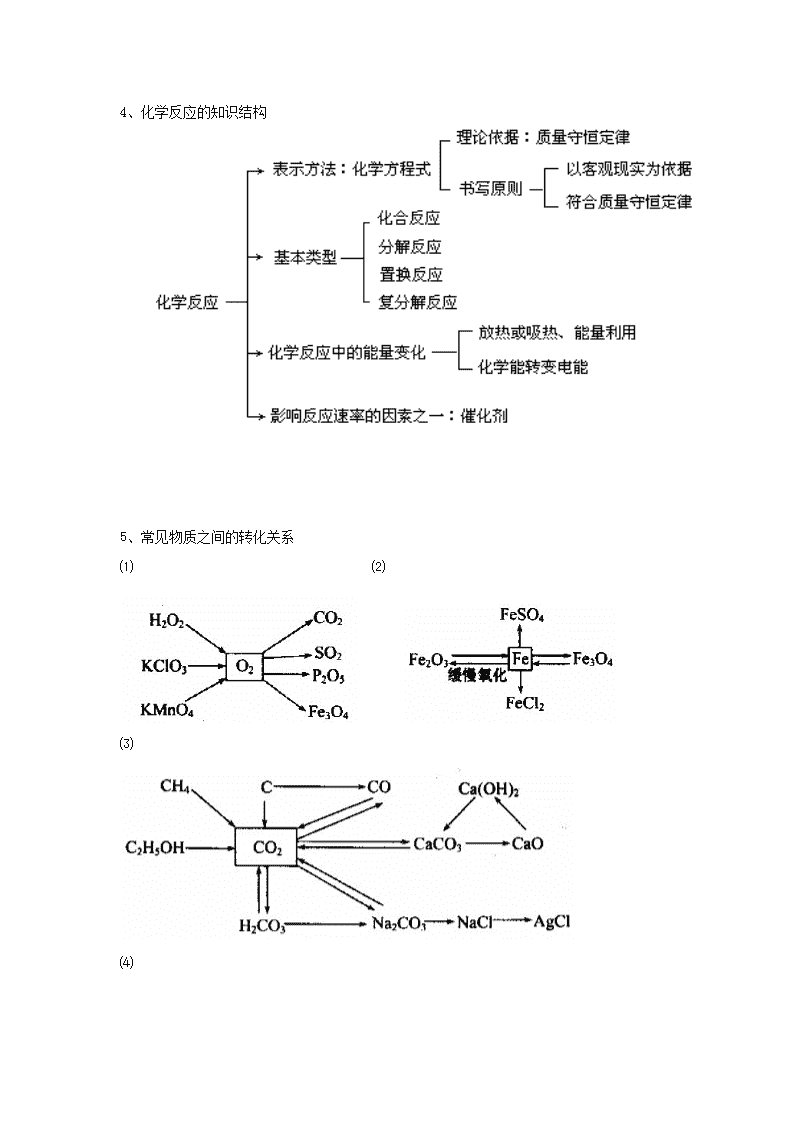
中考复习专题二 :物质的性质与变化 基本概念 【探究目标】 1、认识化学变化的特征,从分子原子角度,理解化学变化的实质。 2、知道物质发生化学变化时,伴随有能量的变化,认识通过化学反应获得能量的重要性。 3、初步认识常见的化学反应基本类型,并解释与日常生活相关的一些现象。 【探索导航】: 〖活动一〗知识梳理,形成知识结构 要求:(1)浏览教材并填写下面知识网络 (2)想一想,对于基础知识你还有那些不明白的地方? 1、物质的变化——物理变化和化学变化 变化类型 物 理 变 化 化 学 变 化 (化 学 反 应) 区 别 概念 生成其他物质的变化。 新物质生成的变化。 含义 宏观:没有新物质生成。 微观:分子、原子、离子之间的距离 ,物质的形状、大小 ,分子本身 变,原子或离子的结合方式 变。 宏观:有 生成。 微观:由分子构成的物质分子本身变成其它物质 ,由原子或离子构成的物质,原子、离子结合方式 。 现象 多表现 、 、 的变化。 伴随 、 、变色、放出气体、生成沉淀等现象。 实例 联 系 判断依据 是否有新物质生成 2、物质的性质——物理性质和化学性质 性质类型 物 理 性 质 化 学 性 质 概 念 物质 表现出来的性质。 物质在 表现出来的性质 性质确定 由 感知或由 测知 通过 可知。 性质内容 颜色、 、 、 熔点、 、 、 、溶解性、挥发性、导电性等。 可燃性、 、 氧化性、 、稳定性等。 3、 化学反应的简单分类和放热、吸热现象 (1) 基本反应类型: 初中化学里,化学反应按反应物、生成物组成形式变化划分,主要有 、 、 、 。 (2)氧化反应、还原反应:(仅以得氧、失氧的观点了解) 氧化反应 : 物质跟 发生的反应叫氧化反应。物质得氧它就被氧化了。 △ 还原反应 : 含氧化合物里的氧被走的反应叫还原反应。物质失氧(部分失去或全部失去)它就被还原了。例如; CuO + H2 = Cu + H2O ( 被还原)( 被氧化) 4、化学反应的知识结构 5、常见物质之间的转化关系 ⑴ ⑵ ⑶ ⑷ 〖活动二〗、解题方法指导 1.古诗词是古人为我们留下的宝贵精神财富。下列诗句只涉及物理变化( ) A.野火烧不尽,春风吹又生 B.春蚕到死丝方尽,蜡炬成灰泪始干C.只要功夫深,铁杵磨成针 D.爆竹一声辞旧岁,春风送暖入屠苏 2.下图表示的是水的两种变化,请从宏观和微观(原子和分子的观点)两个角度描述它们的变化过程。 (2) (1) 水的沸腾 通电分解水 (1)宏观 微观 (2)宏观 微观 3、“化学反应的绿色化”要求原料物质所有的原子完全被利用,全部转入期望的产品中,下列反应类型中一定符合“绿色化”要求的是( ) A、分解反应 B、化合反应 C、置换反应 D、复分解反应 4、关于化学反应A+B=C+D的下列说法中,正确的是( ) A、如A、B各取5g混合,使其反应,则C和D质量之和一定为10g。 B、A和B的质量比一定等于C和D的质量比。 C、如A、C为单质,B、D为化合物,该反应不一定是置换反应。 D、如C和D分别为盐和水,该反应不一定是中和反应。 5、在一个密闭的容器内,有X、Y、Z、Q四种物质,在一定条件下充分反应,测得反应前各物质的质量如下: 物质 X Y Z Q 反应前质量/g 2 2 84 5 反应后质量/g 待测 24 0 14 试推断该密闭容器中发生的化学反应类型为( ) A、分解反应 B、化合反应 C、置换反应 D、复分解反应 〖活动四〗、综合能力提升 1、下列各图所示变化中属于化学变化的是( ) A.对玻璃片呼气 B.蜡烛燃烧 C.湿衣晾干 D.灯泡通电发光 2、(2008泰安)下列四个短语,其原意一定包含化学变化的是( ) A.花香四溢 B.海市蜃楼 C.百炼成钢 D.木已成舟 3、A~D都是初中化学中的常见物质,且有如图所示转化关系(反应条件、其它反应物及多余产物均已略去)。 请按要求填写下列空白: 若A在常温下是一种不溶于水的白色固体,且C是形成温室效应的主要气体之一。 则:A的化学式为__________,写出化学反应方程式:B→D__________________。 【课堂达标检测】 1、右图是同学们经常使用的某品牌修正液包装标签。 小明仔细阅读修正液 (Correction) 使用方法: 使用前摇匀修正液, 涂于修正处少许, 待完全干后书写。 注意事项: 用完请及时盖上帽。 严禁食用。 后,结合自己的生活经验和所学 知识得出了该修正液的某些性质。下面小明的 推测中不合理的是( ) A.修正液是一种溶液,均一、透明 B.修正液中含有的化学物质有毒 C.修正液的成分对纸张不具有腐蚀性 D.修正液的溶剂易挥发、易燃烧 2、(2009泰安)物质的性质决定它的用途,还决定其 保存方法。固体KOH具有以下性质:①白色固体 ②有腐蚀性 ③易吸收水分 ④能与空气中的二氧化碳反应。实验室中必须将它密封保存的主要原因是( ) A.①② B.③④ C.①③ D. ②④ 3、(2009泰安)锂元素(元素符号为Li)及其所形成的化合物。在通讯和航空航天领域中具有极其重要的用途。它的化合物氢氧化锂(LiOH)是一种易溶于水的白色固体,有辣味,具有强碱性和腐蚀性。 (1)写出氢氧化锂的一条物理性质 ; (2)下表是部分物质的溶解性表.运用此溶解性表并结合你对复分解反应发生条件的理解, 阴离子 阳离子 OH- CO32- SO42- NO3- Ba2+ 溶 不 不 溶 Cu2+ 不 不 溶 溶 Li+ 溶 微溶 溶 溶 从表中选出一种盐,该盐能和LiOH发生复分解反应,请你写出该盐的化学式 。 写出反应的化学方程式 。 【课后反思】 本节课的知识哪些掌握了,还有哪些没有掌握?学习到了那些方法?错题错在什么地方?认真将错题改到改错本上了吗? 溶液 【探究目标】 1、掌握溶液、饱和溶液和不饱和溶液的概念及相互转化; 2、了解结晶和蒸发结晶、及降温结晶的方法分离混合物。 3、记住溶解度的概念,理解其含义; 4、知道影响固体物质溶解度的因素,能正确使用溶解度曲线。 5、掌握溶液的配置、溶质质量分数的有关公式。 〖活动一〗基础知识回顾 要求:(1)浏览教材并填写下面知识网络 (2)想一想,对于基础知识你还有那些不明白的地方? (一)溶液 1、概念: 叫做溶液。 2、溶液的基本特征: 、 、 注意:(1)溶液不一定无色 (2)某溶液中溶质的种类可以只一种,也可以是两种或两种以上 (3)溶液的质量=溶质的质量+溶剂的质量 溶液的体积≠溶质的体积+溶剂的体积 (4)溶质可以是固体、液体或气体;水是最常用的溶剂 4、溶解时放热、吸热现象 溶解吸热:如 溶解(扩散过程中吸收热量>水合过程中放出热量) 溶解放热:如 、 溶解(溶解扩散过程中吸收热量<水合过程中放出热量) 溶解没有明显热现象:如NaCl(扩散过程中吸收热量≈水合过程中放出热量) (二)饱和溶液、不饱和溶液 1、概念: (1)饱和溶液:(定义) 。 (2)不饱和溶液:(定义) 。2、判断方法:看有无不溶物或继续加入该溶质,看能否溶解 3、饱和溶液和不饱和溶液之间的转化 注:Ca(OH)2和气体等除外 4、结晶 (1)概念: 。 (2)结晶方法:① ;② (三)溶解性:一种物质(溶质)溶解在另一种物质(溶剂)里的能力称为溶解性。 ①不同的物质在同一溶剂中溶解性不同。如常温下高锰酸钾易溶于水,而碘不易溶于水。 ②同一种物质在不同溶剂中的溶解性不同。如常温下碘不易溶于水,却易溶于汽油。 (四)溶解度 1、固体的溶解度 (1)定义: 。 四要素:①条件: ②标准: ③状态: ④单位: (2)溶解度的含义: 20℃时NaCl的溶液度为36g的含义: (3)影响固体溶解度的因素:①溶质、溶剂的性质(或种类)②温度 (4)溶解度曲线 ①表示某物质在不同温度下的溶解度或溶解度随温度变化的趋势。 ②溶解度曲线上的每一个点表示溶质在某温度下的溶解度,溶液必然是饱和溶液。 ③两条曲线交叉点表示 。 ④在溶解度曲线下方的点,则表示 。 2、溶解性和固体溶解度的关系 溶解性 易溶 可溶 微溶 难溶 20℃的溶解度/g (五)溶质的质量分数 1、公式: 2、配制一定溶质质量分数的溶液 (1)用固体配制: ①步骤: 、 、 、 、 ②仪器: 、 、 、 、 、 、 (2)用浓溶液稀释(稀释前后,溶质的质量不变) ①步骤: 、 、 、 ②仪器: 、 、 、 、 3、浓、稀溶液与饱和、不饱和溶液之间的关系 ①饱和溶液不一定是浓溶液,如饱和的石灰水溶液就是稀溶液 ②不饱和溶液不一定是稀溶液 ③在一定温度时,同一种溶质的饱和溶液一定要比它的不饱和溶液浓 (六)乳浊液、乳化作用 形成的混合物叫做乳浊液(不稳定,分层)。乳化剂所起的作用称为乳化作用。如:洗涤剂对植物油有乳化作用,它能使植物油分散成无数细小的液滴,而不能聚集成大的油珠。 〖活动二〗、典例剖析 1、下图是同学们经常使用的某品牌修正液包装标签。小明仔细阅读后,结合自己的生活经验和所学知识得出了该修正液的某些性质。下面小明的推测中不合理的是( )。 A.修正液是一种溶液,均一、透明 B.修正液中含有的化学物质有毒 C.修正液的成分对纸张不具有腐蚀性 D.修正液的溶剂易挥发、易燃烧 解析: 从修正液使用前摇匀,可知修正液不是均一的,所以不是溶液。 2、20℃时,NaCl溶解于水的实验数据如下表。则下列叙述正确的是( ) A.②中所得溶液是饱和溶液 B.20℃时10g水最多能溶解4g NaCl C.③④溶液的溶质质量分数相等 D.①所得溶液的溶质质量分数为20% 解析: 从表格中的数据可知:20℃时,10克水中能溶解NaCl 3.6克,③④都是饱和溶液,溶质的质量分数相等 3、A图表示的是硝酸钾和氢氧化钙的溶解度随温度变化的情况。B图中甲、乙试管分别盛有硝酸钾和氢氧化钙的饱和溶液,试管底部均有未溶解的固体。向烧杯中加入一种物质后,甲试管中的固体减少,乙试管中的固体增加,则加入的物质不可能是( ) A.浓硫酸 B.氢氧化钠 C.氧化钙 D.氯化钠 解析: 向烧杯中加入一种物质后,甲试管中的固体减少,乙试管中的固体增加,根据溶解度随温度变化的情况知:加入的物质溶于水应放热或与水反应放热,浓硫酸、氢氧化钠溶于水都放热,氧化钙与水反应放热。 4、下图是X、Y两种固体物质的溶解度曲线。下列说法中正确的是( ) A.t1℃时X的溶解度大于Y的溶解度 B.t2℃时X的溶解度等于Y的溶解度 C.t3℃时X的饱和溶液降温至t2℃时,变为不饱和溶液 D.t1℃时Y的不饱和溶液升温至t2℃时,变为饱和溶液 解析:t1℃时X的溶解度小于Y的溶解度;t3℃时X的饱和溶液降温至t2℃时,会析出晶体,仍为饱和溶液;t1℃时Y的不饱和溶液升温至t2℃时,溶解度增大,仍为不饱和溶液。 5、下图中M、N分别表示二种固体物质(不含结晶水)的溶解度曲线,试根据图中曲线判断下列说法正确的是( ) A.图中A点表示M、N二种物质在t1℃时均达到饱和 B.M、N二种饱和溶液,当温度从t1降至t2时,一定析出相同质量的晶体 C.同处A点的相同质量的M、N二种溶液,当温度从t1降至t2 后,剩余溶液的质量分数相等 D.0℃时,M、N具有相同的溶解度 解析:图中A点表示M这种物质在t1℃时均达到饱和,但N这种物质在t1℃时为不饱和溶液;M、N二种饱和溶液,当温度从t1降至t2时,都会析出晶体,尽管N的溶解度降低比M多,但两种溶液的总量不知道谁大,所以M、N二种溶液谁析出晶体的质量大是无法比较的;0℃时, N的溶解度显然比M的溶解度小。 6、向20℃的饱和澄清石灰水(甲溶液)中投入适量的氧化钙粉末,充分反应,下列说法错误的是( ) A.溶液温度末冷却到20℃时,溶液一定是饱和溶液 B.溶液温度末冷却到20℃时,溶质质量分数比甲溶液大 C.溶液温度恢复到20℃时,溶液质量比甲溶液小 D.溶液温度恢复到20℃时,溶液的溶质质量分数和甲溶液的相等 解析: 氧化钙和水反应生成氢氧化钙,而且放热。由于氢氧化钙的溶解度随温度的升高而减小,溶液温度末冷却到20℃时,溶液中还要析出氢氧化钙,溶质质量分数比甲溶液小。 〖活动三〗、综合能力提升 1、右图为A物质的溶解度曲线。M、N两点分别表示A物质的两种溶液。下列做法不能实现M、N间的相互转化的是(A从溶液中析出时不带结晶水) A.从N→M:先向N中加入适量固体A再降温 B.从N→M:先将N降温再加入适量固体A C.从M→N:先将M降温再将其升温 D.从M→N:先将M升温再将其蒸发掉部分水 2、甲、乙两物质的溶解度曲线如图所示,下列叙述中正确的是( ) A.t1℃时,甲、乙各30g分别加入70g水中均能恰好完全 溶解 B.t2℃时,甲和乙的饱和溶液中溶质的质量分数相等 C.t2℃时,在lO0g水中放入60g甲,所得溶液溶质的 质量分数为37.5% D.t2℃时,分别在100g水中各溶解20g甲、乙, 同时降低温度,甲先达到饱和 3、要配制100g 溶质质量分数为10%的氯化钠溶液,下列操作中正确的是( ) A.将10g氯化钠固体直接放在天平的托盘上称量 B.量取90ml水时,俯视读数 C.为加快固体溶解,用温度计搅拌溶液 D.将配好的溶液倒入细口瓶中,盖紧瓶塞,并贴上标签 【课堂达标检测】 基础题: 1.下列物质中既存在离子又存在分子的是 ( ) A.氯化钠晶体 B.金刚石 C.氯化钠溶液 D.液氧 2.下列关于溶液的说法错误的是 ( ) A.饱和溶液析出晶体后,其溶质的质量分数可能不变 B.在溶液里进行的化学反应,通常比较快 C.同种溶质的饱和溶液,一定比它的不饱和溶液的溶质质量分数大 D.不饱和溶液转化为饱和溶液,溶质质量分数可能不变 3.用氯化钠配制l00g溶质质量分数为20%的氯化钠溶液,现有下列操作:①溶解;②称取氯化钠;③过滤;④量取水;⑤计算;⑥蒸发结晶。正确的操作顺序是( ) (A)①②③④ (B)⑤②④① (C)①③⑤②④① (D)①③⑥⑤②④① 4.现有60℃的饱和NaCl溶液,与该溶液有关的量有:①水的质量;②溶液中溶质NaCl的质量;③NaCl的质量分数;④60℃时NaCl的溶解度:⑤溶液的质量。用序号填空: (1)将该饱和溶液稀释,不变的量有: ; (2)将该饱和溶液降温至20℃,一定变化的量有 。 提升题: 5.右图为氯化钠、碳酸钠(俗称纯碱)在水中的溶解度曲 线。 (1)当温度为10℃时,碳酸钠的溶解度为 ; (2)当温度 时,氯化钠的溶解度大于碳酸钠的溶解度; (3)生活在盐湖附近的人们习惯“夏天晒盐,冬天捞碱”。 请你解释原因:“夏天晒盐” ; “冬天捞碱” 。 6.右图是A、B两种物质的溶解度曲线,根据图示回答下列问题: (1)t1℃时,向两只盛有100g水的烧杯中,分别加入A、B两种物质至不能溶解为止,所得溶液的溶质质量分数较大的是___________溶液(填“A”或“B””)。 (2)t2℃时,欲配制等质量的A、B两种物质的饱和溶液,所需水的质量关系是A________B。 (填写“>”、“<”或“=”,下同) (3)将t2℃的A、B两种物质的饱和溶液各200g,降温至t1℃,析出晶体的质量关系是A______B。 (4)将t2℃的A、B两种物质的饱和溶液各200g,升温至t1℃,欲使它们仍为饱和溶液,若不改变溶剂质量,所需加入固体溶质的质量关系是A_______B。 【课后反思】 本节课的知识哪些掌握了,还有哪些没有掌握?学习到了那些方法?错题错在什么地方?认真将错题改到改错本上了吗?查看更多