- 2021-11-06 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020年北京市中考化学试卷【含答案;word版本;可再编辑】
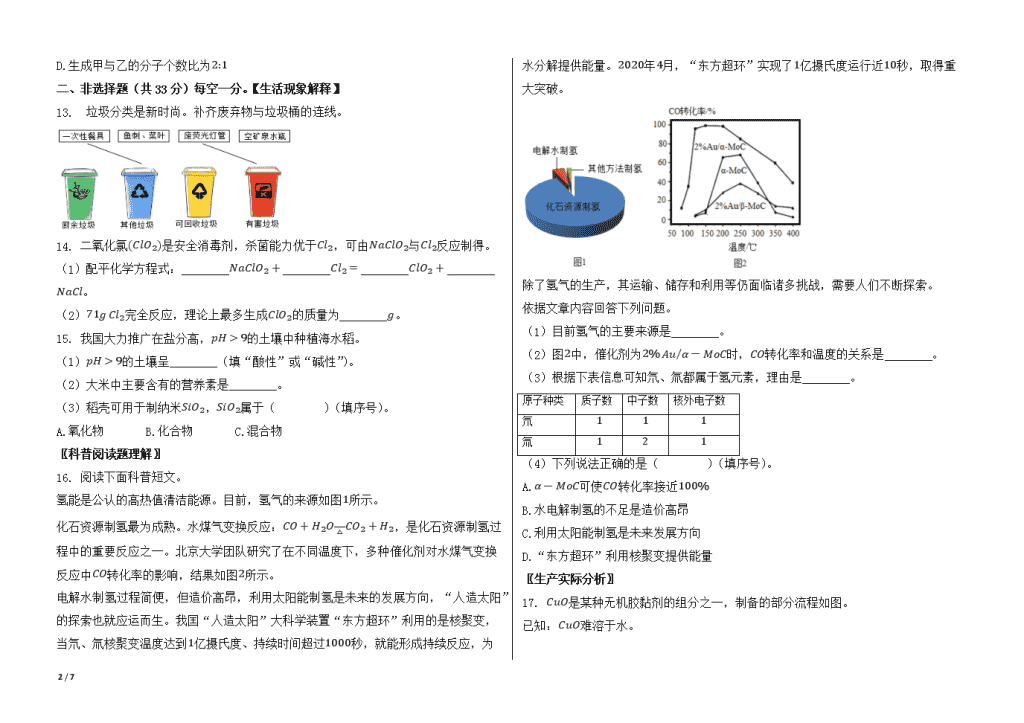
2020年北京市中考化学试卷 一、选择题每小题1分。在每小题给出的四个选项中,选出最符合题目要求的一项。 1. 为了防止骨质疏松,人体必须摄入的元素是( ) A.钙 B.铁 C.锌 D.碘 2. 下列气体能供给动植物呼吸的是( ) A.CO2 B.H2 C.O2 D.N2 3. 下列含金属元素的物质是( ) A.H2S B.P2O5 C.AgNO3 D.H2O 4. 下列不属于铁丝在氧气中燃烧现象的是( ) A.放出热量 B.产生大量白烟 C.火星四射 D.生成黑色固体 5. 下列操作不正确的是( ) A.稀释浓硫酸 B.点燃酒精灯 C.加热液体 D.取用固体粉末 6. 下列不能与稀盐酸反应的金属是( ) A.Cu B.Zn C.Al D.Mg 7. 下列物质含有氧分子的是( ) A.O2 B.H2O2 C.H2CO3 D.SO2 8. 下列物质的用途中,利用其化学性质的是( ) A.银用于制作导线 B.干冰用作制冷剂 C.铜用于制作铜火锅 D.赤铁矿用于炼铁 9. 氯化钯(PdCl2)可用于检测CO.PdCl2中Pd的化合价为( ) A.+1 B.+2 C.+3 D.+4 10. 不同温度下KNO3的溶解度如下表所示。下列说法正确的是( ) 温度/∘C 20 30 40 溶解度/g 31.6 45.8 63.9 A.20∘C时,100g KNO3饱和溶液中溶质质量为31.6g B.30∘C时,100g KNO3饱和溶液的溶质质量分数为45.8% C.30∘C时,将50g KNO3放入100g水中得到150g溶液 D.40∘C时,100g水最多溶解63.9g KNO3 11. 利用如图装置验证了空气中氧气的含量。下列叙述不正确的是( ) A.实验前需检查装置气密性 B.白磷的作用是消耗试管中的氧气 C.白磷熄火、试管冷却后再打开止水夹 D.最终量筒中液面约降至40mL刻度线处 12. 甲酸( HCOOH)具有清洁制氢的巨大潜力,其分解前后分子种类变化的微观示意图如图: 下列说法正确的是( ) A.甲酸分子中氢、氧原子个数比为1:2 7 / 7 B.乙中碳、氧元素质量比为1:2 C.46g甲酸中氢元素质量为2g D.生成甲与乙的分子个数比为2:1 二、非选择题(共33分)每空一分。【生活现象解释】 13. 垃圾分类是新时尚。补齐废弃物与垃圾桶的连线。 14. 二氧化氯(ClO2)是安全消毒剂,杀菌能力优于Cl2,可由NaClO2与Cl2反应制得。 (1)配平化学方程式:________NaClO2+________Cl2=________ClO2+________NaCl。 (2)71g Cl2完全反应,理论上最多生成ClO2的质量为________g。 15. 我国大力推广在盐分高,pH>9的土壤中种植海水稻。 (1)pH>9的土壤呈________(填“酸性”或“碱性”)。 (2)大米中主要含有的营养素是________。 (3)稻壳可用于制纳米SiO2,SiO2属于( )(填序号)。 A.氧化物 B.化合物 C.混合物 〖科普阅读题理解〗 16. 阅读下面科普短文。 氢能是公认的高热值清洁能源。目前,氢气的来源如图1所示。 化石资源制氢最为成熟。水煤气变换反应:CO+H2O△CO2+H2,是化石资源制氢过程中的重要反应之一。北京大学团队研究了在不同温度下,多种催化剂对水煤气变换反应中CO转化率的影响,结果如图2所示。 电解水制氢过程简便,但造价高昂,利用太阳能制氢是未来的发展方向,“人造太阳”的探索也就应运而生。我囯“人造太阳”大科学装置“东方超环”利用的是核聚变,当氘、氚核聚变温度达到1亿摄氏度、持续时间超过1000秒,就能形成持续反应,为水分解提供能量。2020年4月,“东方超环”实现了1亿摄氏度运行近10秒,取得重大突破。 除了氢气的生产,其运输、储存和利用等仍面临诸多挑战,需要人们不断探索。 依据文章内容回答下列问题。 (1)目前氢气的主要来源是________。 (2)图2中,催化剂为2% Au/α-MoC时,CO转化率和温度的关系是________。 (3)根据下表信息可知氘、氚都属于氢元素,理由是________。 原子种类 质子数 中子数 核外电子数 氘 1 1 1 氚 1 2 1 (4)下列说法正确的是( )(填序号)。 A.α-MoC可使CO转化率接近100% B.水电解制氢的不足是造价高昂 C.利用太阳能制氢是未来发展方向 D.“东方超环”利用核聚变提供能量 〖生产实际分析〗 17. CuO是某种无机胶黏剂的组分之一,制备的部分流程如图。 7 / 7 已知:CuO难溶于水。 (1)反应釜中发生的反应有: ①2NaOH+CuSO4=Na2SO4+Cu(OH)2↓ ②Cu(OH)2△CuO+H2O 其中,属于复分解反应的是________(填“①”或“②”)。 (2)过滤器分离出的滤液中一定含有的溶质是________。 18. 从氯碱工业产生的盐泥中回收BaSO4,其主要工艺流程如图。 已知:①盐泥的主要成分为BaSO4、NaCl、Mg(OH)2和CaCO3。 ②BaSO4难溶于水,不与盐酸反应。 (1)除去NaCl,利用的性质是________。 (2)酸溶槽中发生中和反应的化学方程式为________。 (3)过滤器中分离出来的固体是________。 〖基本实验及其原理分析〗请从19-A或19-B两题中任选一个作答,若均作答,按19-A计分. 19. A.氧气的制取与性质 B.二氧化碳的制取与性质 (1)①中反应的化学方程式为________。 (2)②中观察到的现象是________。 20. 下列是两个关于水的实验。 (1)实验1,反应的化学方程式为________。 (2)下列说法正确的是( )(填序号)。 A.实验1,试管a中得到的气体能燃烧 B.实验1,反应前后原子的种类、个数均改变 C.实验2,水变化前后分子的种类不变 21. 补全实验报告。 装置及操作 现象 解释或结论 (1)向1 Fe 7 / 7 中滴加________溶液 铁片上附着红色固体,溶液颜色变浅 的金属活动性比Cu的强 (2)向2中滴加盐酸 固体减少,得到黄色溶液 化学方程式:________ (3)向3中滴加足量盐酸 ________ Ca(OH)2能与盐酸反应 22. 从如图选择仪器,配制60g溶质质量分数为10%的NaCl溶液。 (1)需要称量NaCl的质量为________g。 (2)量取水用到的仪器有________(写名称)。 (3)从配好的溶液中倒出10g,其中溶质和溶剂的质量比为________。 23. 验证可燃物燃烧的条件。已知:白磷、红磷的着火点分别是40∘C、240∘C。 装置(夹持仪器已略去) 步骤及现象 Ⅰ.将一定量的白磷、红磷分別浸入80∘C热水中(如图所示)。白磷、红磷均不燃烧 Ⅲ.升高左侧漏斗至白磷露出水面。白磷燃烧 (1)Ⅰ中白磷不燃烧的原因是________。 (2)对比Ⅱ和Ⅲ,可验证可燃物燃烧的条件是________。 〖科学探究〗 24. 丙酸钙为白色固体,易溶于水,可作食品防霉剂,国家标准规定了其用于制作面食、糕点时每千克面粉中的最大使用量。小组同学实验探究其性质和防霉的效果。 【进行实验】用如图装置(夹持仪器已略去)完成实验,记录如下: 序号 ① ② 装置 现象 试管内壁有水雾 注入酸后,有气泡产生,石灰水变浑浊 【解释与结论】 (1)②中现象说明有CO2产生。CO2与石灰水反应的化学方程式为________。 (2)查阅资料得知丙酸钙与盐酸反应无气体生成。由实验②可得出的结论是________。 【进行实验】分别按下列①∼⑧的配方蒸制8个馒头,冷却后置于密封袋中,记录如下: 组别 第1组 第2组 序号 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧ 配方 面粉/g 50 50 50 50 50 50 50 50 酵母/g 0.75 0.75 0.75 0.75 0.75 0.75 0.75 0.75 蔗糖/g 0 0 0 0 5 5 x 5 丙酸钙/g 0 0.06 0.10 0.15 0 0.06 0.10 0.15 开始发霉时间 第3天 第4天 第5天 第6天 第3天 第4天 第5天 第6天 【解释与结论】 7 / 7 (3)设计第1组实验的目的是________。 (4)第2组,⑦中x为________。 (5)对比第1组、第2组实验可得到的结论是________。 【反思与评价】 (6)某同学认为“制作面食、糕点时,丙酸钙用量越大越好”你是否同意此观点,并说明理由:________。 7 / 7 参考答案与试题解析 2020年北京市中考化学试卷 一、选择题每小题1分。在每小题给出的四个选项中,选出最符合题目要求的一项。 1.A 2.C 3.C 4.B 5.B 6.A 7.A 8.D 9.B 10.D 11.D 12.C 二、非选择题(共33分)每空一分。【生活现象解释】 13.。 14.2,1,2,2 135 15.碱性 糖类 A,B 〖科普阅读题理解〗 16.化石资源制氢 在其他条件相同时,温度范围在50∘C∼400∘C之间,CO转化率随温度的增大先上升再下降 氘和氚的质子数为1,属于相同质子数的一类原子,都属于氢元素 B,C,D 〖生产实际分析〗 17.① Na2SO4 18.氯化钠易溶于水 Mg(OH)2+2HCl=MgCl2+2H2O 硫酸钡 〖基本实验及其原理分析〗请从19-A或19-B两题中任选一个作答,若均作答,按19-A计分. 19.2KMnO4△K2MnO4+MnO2+O2↑ 湿润紫色石蕊纸花变红色 20.2H2O2H2↑+O2↑ A,C 21.CuSO4或CuCl2,Fe2O3+6HCl=2FeCl3+3H2O,溶液由红色变为无色 22.6 100mL量筒、胶头滴管 1:9 23.白磷未与氧气接触 燃烧需要温度达到可燃物的着火点 7 / 7 〖科学探究〗 24.CO2+Ca(OH)2=CaCO3↓+H2O 丙酸钙受热后产生的物质能与稀盐酸反应且生成二氧化碳 探究丙酸钙的质量大小是否对于丙酸钙防霉效果有影响 5 在其它条件相同时,有无蔗糖对丙酸钙防霉效果无影响。 不同意。国家标准规定了丙酸钙用于作面食、糕点时每千克面粉中的最大使用量,说明过量使用可能有害。故不是越多越好。 7 / 7查看更多