- 2021-11-06 发布 |
- 37.5 KB |
- 5页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020年山东省菏泽市中考化学试卷【含答案;word版本;可再编辑】
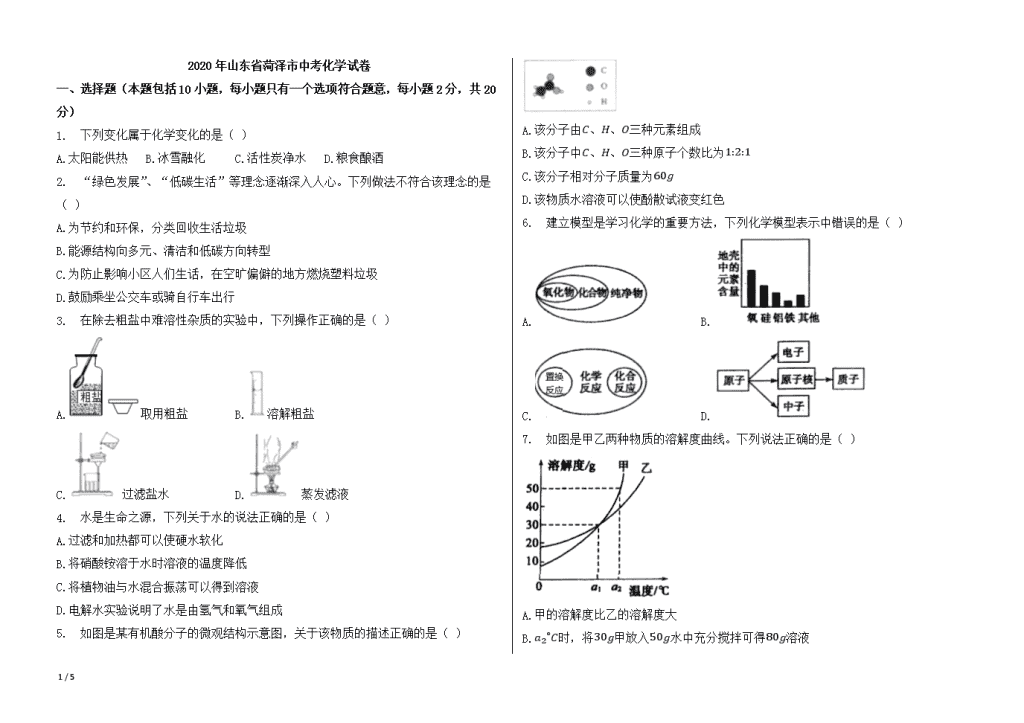
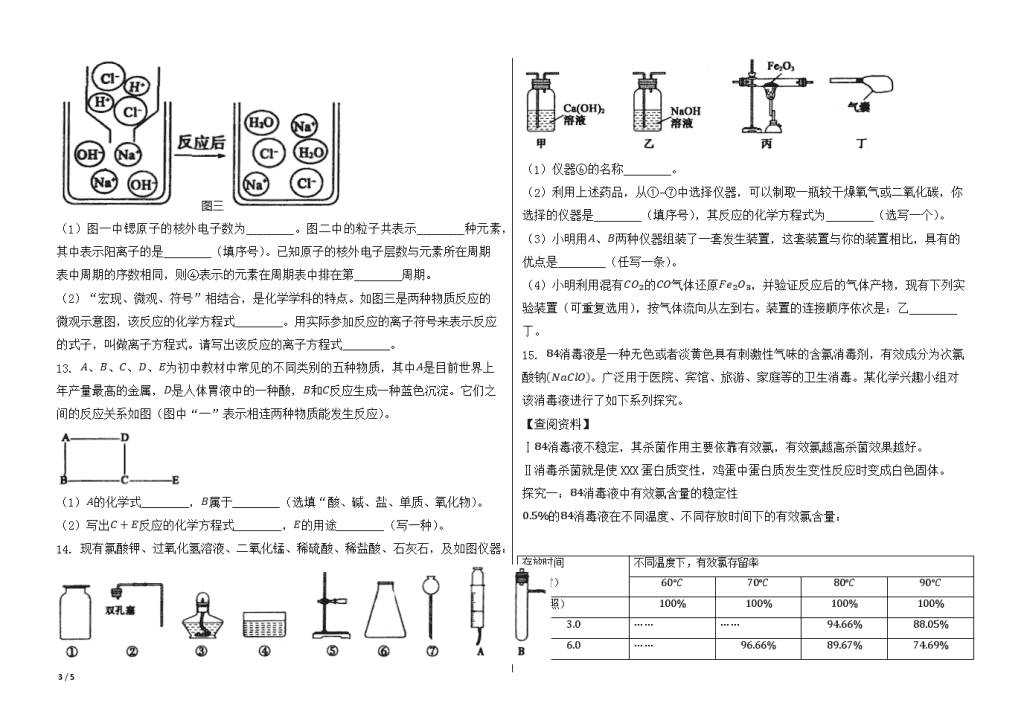
2020年山东省菏泽市中考化学试卷 一、选择题(本题包括10小题,每小题只有一个选项符合题意,每小题2分,共20分) 1. 下列变化属于化学变化的是( ) A.太阳能供热 B.冰雪融化 C.活性炭净水 D.粮食酿酒 2. “绿色发展”、“低碳生活”等理念逐渐深入人心。下列做法不符合该理念的是( ) A.为节约和环保,分类回收生活垃圾 B.能源结构向多元、清洁和低碳方向转型 C.为防止影响小区人们生话,在空旷偏僻的地方燃烧塑料垃圾 D.鼓励乘坐公交车或骑自行车出行 3. 在除去粗盐中难溶性杂质的实验中,下列操作正确的是( ) A.取用粗盐 B.溶解粗盐 C.过滤盐水 D.蒸发滤液 4. 水是生命之源,下列关于水的说法正确的是( ) A.过滤和加热都可以使硬水软化 B.将硝酸铵溶于水时溶液的温度降低 C.将植物油与水混合振荡可以得到溶液 D.电解水实验说明了水是由氢气和氧气组成 5. 如图是某有机酸分子的微观结构示意图,关于该物质的描述正确的是( ) A.该分子由C、H、O三种元素组成 B.该分子中C、H、O三种原子个数比为1:2:1 C.该分子相对分子质量为60g D.该物质水溶液可以使酚散试液变红色 6. 建立模型是学习化学的重要方法,下列化学模型表示中错误的是( ) A. B. C. D. 7. 如图是甲乙两种物质的溶解度曲线。下列说法正确的是( ) A.甲的溶解度比乙的溶解度大 B.a2∘C时,将30g甲放入50g水中充分搅拌可得80g溶液 5 / 5 C.a1∘C时甲、乙两种物质的饱和溶液溶质的质量分数相同 D.将a1∘C时甲、乙同种物质的饱和溶液升温至a2∘C,溶质的质量分数都增大 8. 下列离子能在溶液中大量共存且溶液为无色的是( ) A.Fe3+ K+ Cl- NO3- B.Ba2+ Na+ Cl- SO42- C.Na+ K+ NO3- SO42- D.H+ K+ CO32- Cl- 9. 下列实验设计不能达到实验目的的是( ) A.探究可燃物燃烧需达到着火点 B.探究钢铁生锈需要氧气 C.验证生石灰遇水放热 D.验证质量守恒定律 10. 除去下列物质中少量杂质,所用试剂或方法错误的是( ) 序号 物质(括号内为杂质) 选用试剂及操作方法 A N2(O2) 通过灼热的木炭粉,收集气体 B CaCl2(CaCO3) 加足量水,振荡后过滤,蒸发结晶 C NaCl(Na2CO3) 加入适量稀盐酸,蒸发结晶 D ZnCl2(CuCl2) 配成溶液,加入过量的锌,过滤,蒸发结晶 A.A B.B C.C D.D 二、非选择题(本题包括6小题,共30分) 11. 请根据题目要求回答下列问题: (1)用化学用语填空: ①天热气的主要成分________; ②小苏打________; ③可用于改良酸性土壤的碱________; ④有水生成的化合反应________。 (2)人类需要多种营养素维持生命。小刚要了一份外卖:麻婆豆腐、红烧肉、大米、矿泉水,从均衡营养的角度,请你帮他再点一份食物________。 12. 图一是锶元素在周期表中的信息,图二是几种粒子的结构示意图。请回答: 5 / 5 (1)图一中锶原子的核外电子数为________。图二中的粒子共表示________种元素,其中表示阳离子的是________(填序号)。已知原子的核外电子层数与元素所在周期表中周期的序数相同,则④表示的元素在周期表中排在第________周期。 (2)“宏现、微观、符号”相结合,是化学学科的特点。如图三是两种物质反应的微观示意图,该反应的化学方程式________。用实际参加反应的离子符号来表示反应的式子,叫做离子方程式。请写出该反应的离子方程式________。 13. A、B、C、D、E为初中教材中常见的不同类别的五种物质,其中A是目前世界上年产量最高的金属,D是人体胃液中的一种酸,B和C反应生成一种蓝色沉淀。它们之间的反应关系如图(图中“一”表示相连两种物质能发生反应)。 (1)A的化学式________,B属于________(选填“酸、碱、盐、单质、氧化物)。 (2)写出C+E反应的化学方程式________,E的用途________(写一种)。 14. 现有氯酸钾、过氧化氢溶液、二氧化锰、稀硫酸、稀盐酸、石灰石,及如图仪器: (1)仪器⑥的名称________。 (2)利用上述药品,从①-⑦中选择仪器,可以制取一瓶较干燥氧气或二氧化碳,你选择的仪器是________(填序号),其反应的化学方程式为________(选写一个)。 (3)小明用A、B两种仪器组装了一套发生装置,这套装置与你的装置相比,具有的优点是________(任写一条)。 (4)小明利用混有CO2的CO气体还原Fe2O3,并验证反应后的气体产物,现有下列实验装置(可重复选用),按气体流向从左到右。装置的连接顺序依次是:乙________丁。 15. 84消毒液是一种无色或者淡黄色具有刺激性气味的含氯消毒剂,有效成分为次氯酸钠(NaClO)。广泛用于医院、宾馆、旅游、家庭等的卫生消毒。某化学兴趣小组对该消毒液进行了如下系列探究。 【查阅资料】 Ⅰ84消毒液不稳定,其杀菌作用主要依靠有效氯,有效氯越高杀菌效果越好。 Ⅱ消毒杀菌就是使XXX蛋白质变性,鸡蛋中蛋白质发生变性反应时变成白色固体。 探究一:84消毒液中有效氯含量的稳定性 0.5%的84消毒液在不同温度、不同存放时间下的有效氯含量: 存放时间 (小时) 不同温度下,有效氯存留率 60∘C 70∘C 80∘C 90∘C 0(对照) 100% 100% 100% 100% 3.0 …… …… 94.66% 88.05% 6.0 …… 96.66% 89.67% 74.69% 5 / 5 12.0 …… 93.32% 82.62% …… 20.0 94.75% …… …… …… 20.0 92.99% …… …… …… 【解释与结论】 (1)次氯酸钠(NaClO)中Cl元素的化合价为________。 (2)综合分析探究一中数据,在其他条件不变时,0.5%的84消毒液有效氯存留率受温度和时间的影响,其影响的变化趋势是________,因此保存84消毒液应注意的问题是________。 探究二:不同浓度84消毒液的杀菌效果 在四只试管中各加入鸡蛋液2mL,分别加入不同浓度的消毒液,静置15分钟后,记录如下: 序号 2-1 2-2 2-3 2-4 实验操作 加入0.5mL消毒原液 加入0.5mL清毒 原液,12.5mL水 加入0.5mL消毒原液,50mL水 加入0.5mL消毒原液,100mL水 现象 液体表面产生气泡,无其他现象 液体中产生大量白色固体 液体中产生少量白色固体 液体中产生极少量白色固体 【解释与结论】 (3)探究二中杀菌效果最好的一组实验为________(填序号)。 (4)洁厕灵主要成分是盐酸,与84消毒液混合会产生有毒气体Cl2,完成反应的化学方程式:2HCl+NaClO=Cl2↑+H2O+________。 16. 白铜(Cu-Ni)是工业上常用的一种合金,金属镍(Ni)的金属活泼性与铁相似,且化合价显+2价。为测定20g某白铜样品中镍的质量,设计了如下实验: 试问: (1)将白铜研碎的目的是________。 (2)白铜样品中镍的质量________g。 (3)所用稀硫酸中溶质的质量分数。 5 / 5 参考答案与试题解析 2020年山东省菏泽市中考化学试卷 一、选择题(本题包括10小题,每小题只有一个选项符合题意,每小题2分,共20分) 1.D 2.C 3.D 4.B 5.B 6.D 7.C 8.C 9.D 10.A 二、非选择题(本题包括6小题,共30分) 11.CH4,NaHCO3,Ca(OH)2,2H2+O22H2O 菠菜汤 12.38,4,③,三 NaOH+HCl=NaCl+H2O,H++OH-=H2O 13.Fe,盐 Ca(OH)2+CO2=CaCO3↓+H2O,灭火 14.锥形瓶 ①②⑥⑦,2H2O2MnO22H2O+O2↑或CaCO3+2HCl=CaCl2+H2O+CO2↑ 可以控制反应的速率 甲→丙→甲 15.+1 温度越高有效氯的含量越低,时间越长有效氯的含量越低,1.低温密封保存,2.存放时间不易过长,在保质期内用完 2-2 NaCl 16.增大反应物的接触面积,加快反应速率 2.95 所用稀硫酸中溶质的质量分数为9.8%。 5 / 5查看更多