- 2021-08-24 发布 |
- 37.5 KB |
- 5页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高考化学二轮复习选择题标准练10含解析
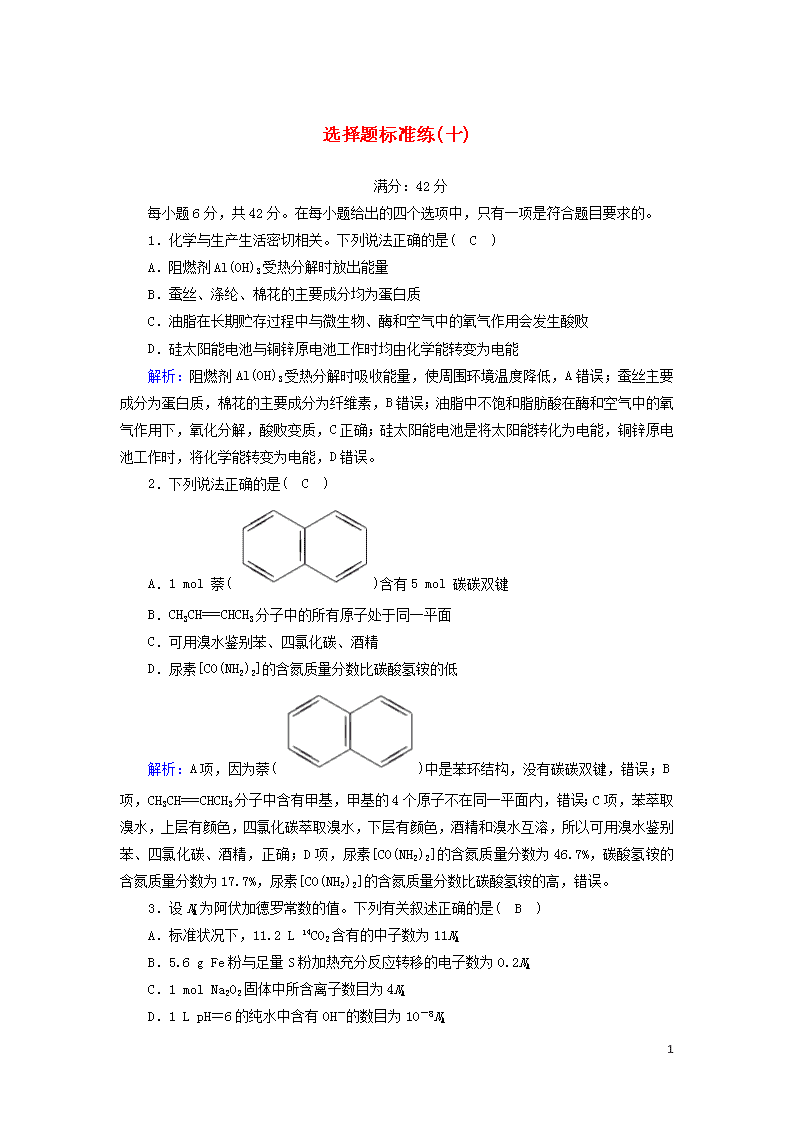
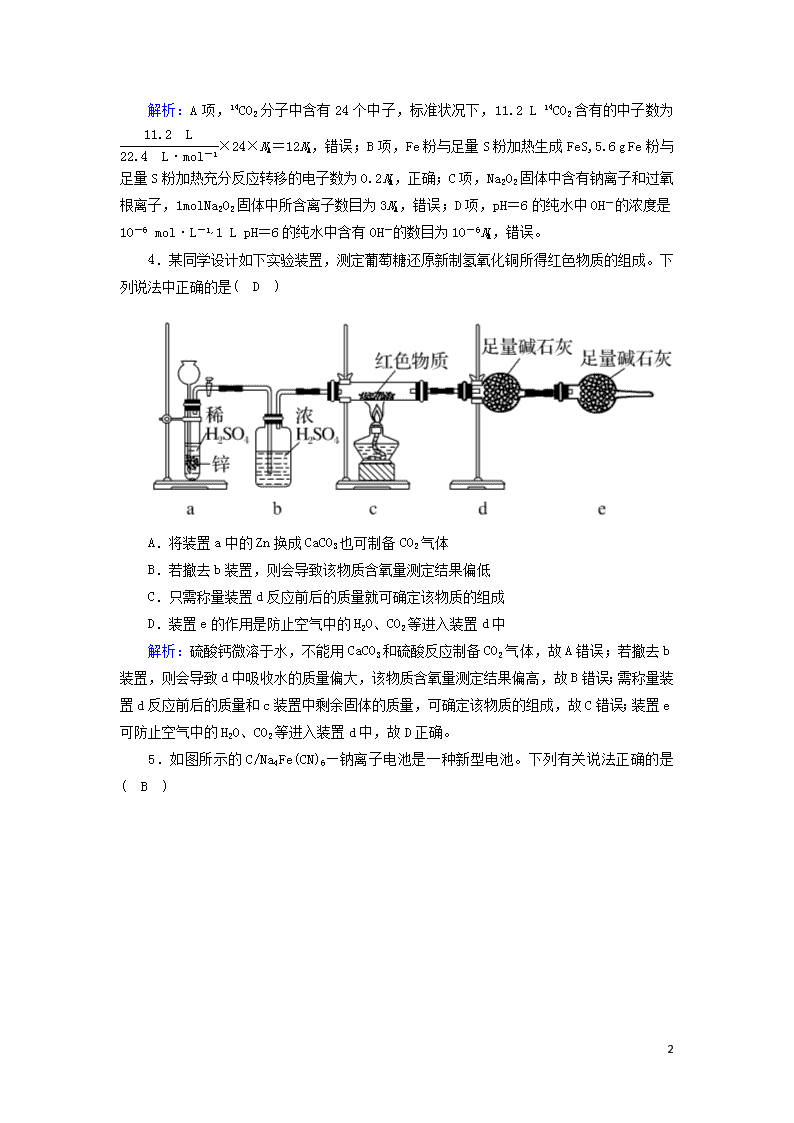
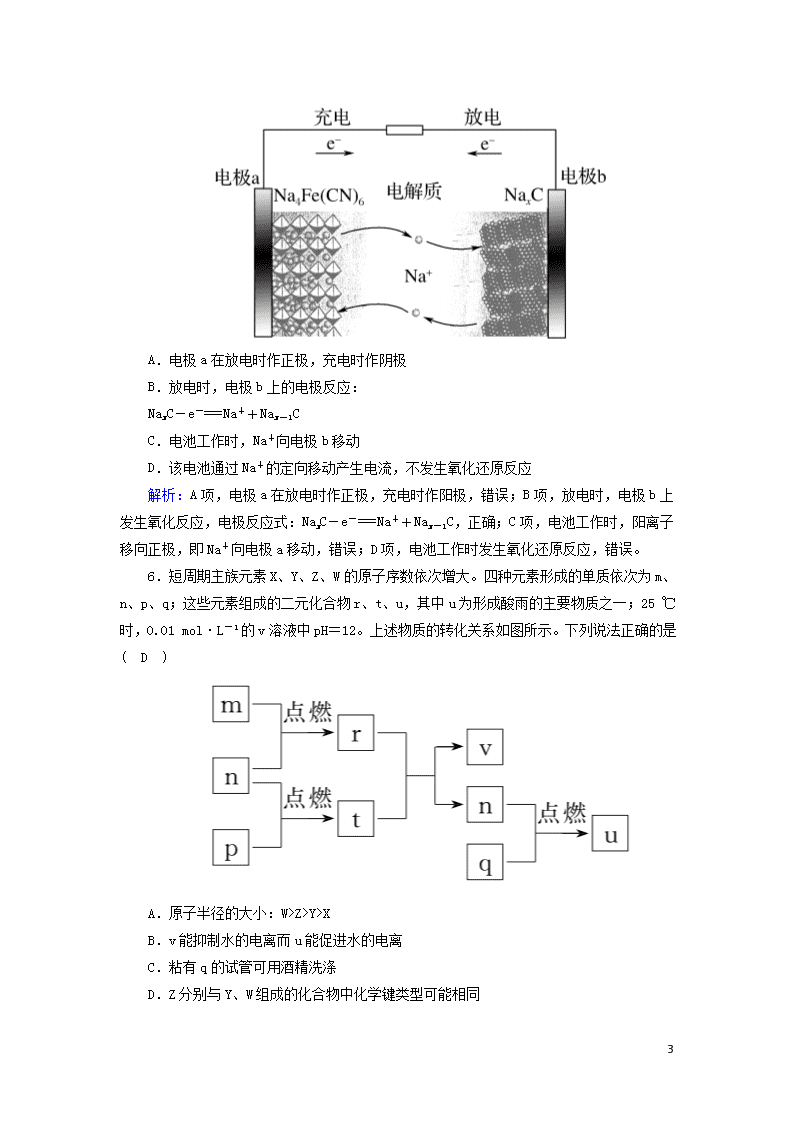
选择题标准练(十) 满分:42分 每小题6分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。 1.化学与生产生活密切相关。下列说法正确的是( C ) A.阻燃剂Al(OH)3受热分解时放出能量 B.蚕丝、涤纶、棉花的主要成分均为蛋白质 C.油脂在长期贮存过程中与微生物、酶和空气中的氧气作用会发生酸败 D.硅太阳能电池与铜锌原电池工作时均由化学能转变为电能 解析:阻燃剂Al(OH)3受热分解时吸收能量,使周围环境温度降低,A错误;蚕丝主要成分为蛋白质,棉花的主要成分为纤维素,B错误;油脂中不饱和脂肪酸在酶和空气中的氧气作用下,氧化分解,酸败变质,C正确;硅太阳能电池是将太阳能转化为电能,铜锌原电池工作时,将化学能转变为电能,D错误。 2.下列说法正确的是( C ) A.1 mol 萘()含有5 mol 碳碳双键 B.CH3CH===CHCH3分子中的所有原子处于同一平面 C.可用溴水鉴别苯、四氯化碳、酒精 D.尿素[CO(NH2)2]的含氮质量分数比碳酸氢铵的低 解析:A项,因为萘()中是苯环结构,没有碳碳双键,错误;B项,CH3CH===CHCH3分子中含有甲基,甲基的4个原子不在同一平面内,错误;C项,苯萃取溴水,上层有颜色,四氯化碳萃取溴水,下层有颜色,酒精和溴水互溶,所以可用溴水鉴别苯、四氯化碳、酒精,正确;D项,尿素[CO(NH2)2]的含氮质量分数为46.7%,碳酸氢铵的含氮质量分数为17.7%,尿素[CO(NH2)2]的含氮质量分数比碳酸氢铵的高,错误。 3.设NA为阿伏加德罗常数的值。下列有关叙述正确的是( B ) A.标准状况下,11.2 L 14CO2含有的中子数为11NA B.5.6 g Fe粉与足量S粉加热充分反应转移的电子数为0.2NA C.1 mol Na2O2固体中所含离子数目为4NA D.1 L pH=6的纯水中含有OH-的数目为10-8NA 5 解析:A项,14CO2分子中含有24个中子,标准状况下,11.2 L 14CO2含有的中子数为×24×NA=12NA,错误;B项,Fe粉与足量S粉加热生成FeS,5.6 g Fe粉与足量S粉加热充分反应转移的电子数为0.2NA,正确;C项,Na2O2固体中含有钠离子和过氧根离子,1 mol Na2O2固体中所含离子数目为3NA,错误;D项,pH=6的纯水中OH-的浓度是10-6 mol·L-1,1 L pH=6的纯水中含有OH-的数目为10-6NA,错误。 4.某同学设计如下实验装置,测定葡萄糖还原新制氢氧化铜所得红色物质的组成。下列说法中正确的是( D ) A.将装置a中的Zn换成CaCO3也可制备CO2气体 B.若撤去b装置,则会导致该物质含氧量测定结果偏低 C.只需称量装置d反应前后的质量就可确定该物质的组成 D.装置e的作用是防止空气中的H2O、CO2等进入装置d中 解析:硫酸钙微溶于水,不能用CaCO3和硫酸反应制备CO2气体,故A错误;若撤去b装置,则会导致d中吸收水的质量偏大,该物质含氧量测定结果偏高,故B错误;需称量装置d反应前后的质量和c装置中剩余固体的质量,可确定该物质的组成,故C错误;装置e可防止空气中的H2O、CO2等进入装置d中,故D正确。 5.如图所示的C/Na4Fe(CN)6—钠离子电池是一种新型电池。下列有关说法正确的是( B ) 5 A.电极a在放电时作正极,充电时作阴极 B.放电时,电极b上的电极反应: NaxC-e-===Na++Nax-1C C.电池工作时,Na+向电极b移动 D.该电池通过Na+的定向移动产生电流,不发生氧化还原反应 解析:A项,电极a在放电时作正极,充电时作阳极,错误;B项,放电时,电极b上发生氧化反应,电极反应式:NaxC-e-===Na++Nax-1C,正确;C项,电池工作时,阳离子移向正极,即Na+向电极a移动,错误;D项,电池工作时发生氧化还原反应,错误。 6.短周期主族元素X、Y、Z、W的原子序数依次增大。四种元素形成的单质依次为m、n、p、q;这些元素组成的二元化合物r、t、u,其中u为形成酸雨的主要物质之一;25 ℃时,0.01 mol·L-1的v溶液中pH=12。上述物质的转化关系如图所示。下列说法正确的是( D ) A.原子半径的大小:W>Z>Y>X B.v能抑制水的电离而u能促进水的电离 C.粘有q的试管可用酒精洗涤 D.Z分别与Y、W组成的化合物中化学键类型可能相同 5 解析:短周期主族元素X、Y、Z、W的原子序数依次增大,四种元素形成的单质依次为m、n、p、q,r、t、u是这些元素组成的二元化合物,其中u为形成酸雨的主要物质之一,u为SO2;25 ℃时,0.01 mol·L-1的v溶液中pH=12,则v为NaOH,结合图中转化可知,m为H2,n为O2,p为Na,r为H2O,t为Na2O2,则X、Y、Z、W分别为H、O、Na、S,q为S单质,以此解答该题。A项,电子层越多,原子半径越大,同周期从左向右原子半径逐渐减小,则原子半径的大小:X查看更多