- 2021-08-24 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020版高考化学二轮复习专题强化训练9金属元素及其化合物含解析
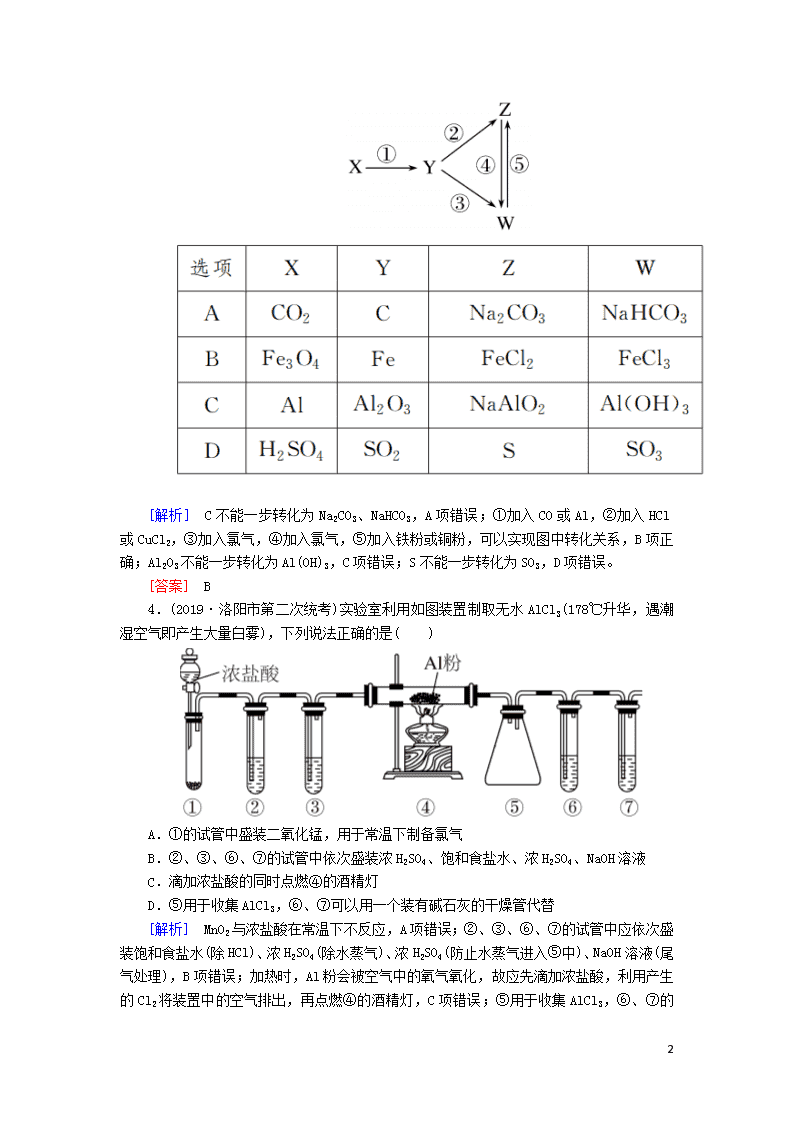
专题强化训练(九) 能力练(20分钟) 一、选择题 1.(2019·山东八校联考)下列反应中,第一步反应生成的沉淀经第二步反应后质量增加的是( ) A.将少量FeCl2溶液加入到NaOH溶液中,再滴加H2O2溶液 B.将少量AgNO3溶液滴加到NaCl溶液中,再滴加Na2S溶液 C.将少量CO2(g)通入饱和Ca(OH)2溶液中,再通入过量Cl2 D.将少量Ba(OH)2溶液滴加到Al2(SO4)3溶液中,再加入过量NaOH溶液 [解析] 少量FeCl2溶液与NaOH溶液反应生成Fe(OH)2沉淀,再滴加H2O2溶液后Fe(OH)2转化为Fe(OH)3,沉淀质量增加,A项符合题意;少量AgNO3溶液与NaCl溶液反应生成AgCl沉淀,再滴加Na2S溶液时AgCl转化为Ag2S,沉淀质量减少,B项不符合题意;少量CO2通入饱和Ca(OH)2溶液中生成CaCO3沉淀,通入过量Cl2时生成的HCl能将CaCO3逐渐溶解,沉淀质量减少,C项不符合题意;将少量Ba(OH)2溶液滴加到Al2(SO4)3溶液中生成BaSO4和Al(OH)3沉淀,加入过量NaOH溶液后,Al(OH)3溶解使沉淀质量减少,D项不符合题意。 [答案] A 2.(2019·昆明调研)将下列各组物质发生反应生成的气体分别通入FeCl2溶液,不能与FeCl2发生反应的是( ) A.CaO和浓氨水 B.二氧化锰和浓盐酸共热 C.Na2O2和CO2 D.铜片和浓硫酸共热 [解析] CaO与浓氨水反应生成NH3,NH3通入FeCl2溶液中生成Fe(OH)2,最终转化成Fe(OH)3,A项不符合题意;MnO2和浓盐酸共热生成Cl2,Cl2与FeCl2溶液反应生成FeCl3溶液,B项不符合题意;Na2O2与CO2反应生成O2,O2通入FeCl2溶液中能够发生氧化还原反应,C项不符合题意;Cu和浓硫酸共热生成SO2,SO2通入FeCl2溶液中不发生反应,D项符合题意。 [答案] D 3.(2019·广州综合测试)下列各组物质中,能一步实现下图所示①~⑤转化关系的是( ) 8 [解析] C不能一步转化为Na2CO3、NaHCO3,A项错误;①加入CO或Al,②加入HCl或CuCl2,③加入氯气,④加入氯气,⑤加入铁粉或铜粉,可以实现图中转化关系,B项正确;Al2O3不能一步转化为Al(OH)3,C项错误;S不能一步转化为SO3,D项错误。 [答案] B 4.(2019·洛阳市第二次统考)实验室利用如图装置制取无水AlCl3(178℃升华,遇潮湿空气即产生大量白雾),下列说法正确的是( ) A.①的试管中盛装二氧化锰,用于常温下制备氯气 B.②、③、⑥、⑦的试管中依次盛装浓H2SO4、饱和食盐水、浓H2SO4、NaOH溶液 C.滴加浓盐酸的同时点燃④的酒精灯 D.⑤用于收集AlCl3,⑥、⑦可以用一个装有碱石灰的干燥管代替 [解析] MnO2与浓盐酸在常温下不反应,A项错误;②、③、⑥、⑦的试管中应依次盛装饱和食盐水(除HCl)、浓H2SO4(除水蒸气)、浓H2SO4(防止水蒸气进入⑤中)、NaOH溶液(尾气处理),B项错误;加热时,Al粉会被空气中的氧气氧化,故应先滴加浓盐酸,利用产生的Cl2将装置中的空气排出,再点燃④的酒精灯,C项错误;⑤用于收集AlCl3 8 ,⑥、⑦的作用分别是防止水蒸气进入⑤中、吸收尾气Cl2,故⑥、⑦可用一个装有碱石灰的干燥管代替,D项正确。 [答案] D 二、非选择题 5.(2019·海淀区期中)某学习小组学习了亚铁盐的性质后,欲探究FeSO4溶液分别与Na2CO3溶液、NaHCO3溶液的反应。已知:Fe(OH)2和FeCO3均为白色沉淀,不存在Fe(HCO3)2。实验操作及现象记录如下: (1)甲同学认为实验a中白色颗粒状沉淀是FeCO3,写出该反应的离子方程式____________________________________;他为了证实自己的观点,进行实验:取少量白色颗粒状沉淀,加入________,发现产生大量气泡。 (2)乙同学推测实验a的白色颗粒状沉淀中还可能含有Fe(OH)2,他将实验a中两种溶液体积均改成15 mL后再进行实验,证实了他的推测。能证明Fe(OH)2存在的实验现象是_______________。 (3)实验b中白色颗粒状沉淀主要成分也为FeCO3,写出生成FeCO3的离子方程式:_______________________________。 8 (4)实验b中液面上方试管内壁粘附的白色颗粒状沉淀物变成红褐色,主要原因是潮湿的FeCO3被氧气氧化,写出该反应的化学方程式:____________________________________________。 (5)乙同学反思,实验a中含有Fe(OH)2,实验b中几乎不含有Fe(OH)2,对比分析出现差异的原因是______________________。 [解析] (1)实验a中生成白色沉淀FeCO3,发生Fe2+、CO之间的沉淀反应。证明白色沉淀为FeCO3,可以加入稀硫酸或稀盐酸,可观察到产生大量气泡。(2)Fe(OH)2白色沉淀不稳定,在空气中放置,易被空气中的氧气氧化为Fe(OH)3,实验现象为白色沉淀迅速变为灰绿色,最终变为红褐色。(3)NaHCO3溶液中HCO存在电离平衡:HCOH++CO,FeSO4溶液与NaHCO3溶液反应,Fe2+与CO结合为FeCO3沉淀,溶液中c(CO)减小,HCO的电离平衡向正反应方向移动,溶液中c(H+)增大,H+与HCO反应生成H2O、CO2,故生成FeCO3的离子方程式为Fe2++2HCO===FeCO3↓+CO2↑+H2O。(4)潮湿的FeCO3被氧气氧化生成的红褐色沉淀为Fe(OH)3,配平化学方程式为4FeCO3+O2+6H2O===4Fe(OH)3+4CO2。 [答案] (1)Fe2++CO===FeCO3↓ 稀硫酸(或稀盐酸等) (2)放置在空气中,沉淀颜色由白色变为灰绿色,最终变为红褐色 (3)Fe2++2HCO===FeCO3↓+CO2↑+H2O (4)4FeCO3+O2+6H2O===4Fe(OH)3+4CO2 (5)混合以后,虽然实验b中c(NaHCO3)比实验a中c(Na2CO3)大,但Na2CO3溶液的碱性(或水解程度)比NaHCO3溶液的强 拔高练(25分钟) 一、选择题 1.(2019·黑龙江六校联考)如图所示的5种物质中均含同种金属元素,且在一定条件下(不含电解)能按图示箭头方向实现一步转化,则该金属元素可能是( ) ①Na ②K ③Ca ④Fe ⑤Cu A.①② B.③④ C.④⑤ D.①⑤ [解析] NaNO3无法一步转化成NaOH,NaOH也无法一步生成Na2O,NaCl也无法一步生成金属钠(除电解方法),故①错误;KNO3无法一步转化成KOH,KOH也无法一步生成K2O,KCl也无法一步生成金属钾(除电解方法),故②错误;Ca(NO3)2无法一步转化成Ca(OH)2,CaCl2也无法一步生成金属钙(除电解法),故③错误;Fe能够与硝酸反应生成Fe(NO3)3,Fe(NO3)3与NaOH反应生成Fe(OH)3沉淀,Fe(OH)3加热生成Fe2O3,Fe2O3与盐酸反应生成FeCl3,FeCl3与锌反应生成铁,铁及其化合物均能够按照图示箭头通过一步反应完成,故④正确;Cu与硝酸反应生成Cu(NO3)2,Cu(NO3)2与NaOH溶液反应生成Cu(OH)2沉淀,Cu(OH)2加热分解生成CuO,CuO与盐酸反应生成CuCl2,CuCl2与铁反应生成铜,所以Cu满足题中转化关系,故⑤正确。 [答案] C 8 2.(2019·长沙质检)某固体混合物可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的两种或多种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积已换算成标准状况下的体积): 关于该固体混合物,下列说法正确的是 ( ) A.一定含有Al,其质量为4.5 g B.一定不含FeCl2,可能含有MgCl2和AlCl3 C.一定含有MgCl2和FeCl2 D.一定含有(NH4)2SO4和MgCl2,且物质的量相等 [解析] 向固体混合物中加入过量浓NaOH溶液加热得到气体,将气体通过碱石灰,体积不变,通过浓硫酸,体积减小,可知固体混合物中存在Al和(NH4)2SO4,产生的5.60 L气体为NH3(2.24 L)和H2(3.36 L),结合标准状况下3.36 L H2为0.15 mol及关系式2Al~3H2可知,与NaOH溶液反应的Al为0.1 mol,其质量为2.7 g,由加入过量浓NaOH溶液得到白色沉淀,且久置无明显变化,可知混合物中一定含有MgCl2,一定不含FeCl2,B项错误、C项错误;标准状况下5.60 L气体为0.25 mol,其中含有氨气0.1 mol,则固体混合物中含有(NH4)2SO4 0.05 mol,n(MgCl2)==0.05 mol,由Al、(NH4)2SO4,MgCl2三者的质量之和为14.05 g,可知该固体混合物由Al、(NH4)2SO4、MgCl2组成,A项错误、D项正确。 [答案] D 3.(2019·宜昌调研)为了探究金属单质M与盐溶液的反应,某同学进行了下列实验,实验过程及现象如图所示,结合实验现象判断,该同学得出的下列结论正确的是( ) A.向滤液中滴加盐酸的实验现象是产生白色沉淀 B.滤渣可能是两种单质的混合物 C.滤渣在足量的稀硝酸中能完全溶解 8 D.加入的金属M可能是镁或钠 [解析] A项,滤液中不含有银离子,加入稀盐酸时,不可能产生白色沉淀,错误。B项,滤渣中一定含有单质银、铜和M,错误。C项,单质银、铜和M在足量的稀硝酸中能完全溶解,正确。D项,加入的金属M不可能是单质钠,因为钠和硝酸银、硝酸铜溶液的反应实际是钠先和水反应生成氢氧化钠和氢气,然后氢氧化钠和铜离子、银离子反应生成沉淀,向滤渣中加入盐酸无气体生成,错误。 [答案] C 4.(2019·河北省九校第二次联考)某同学为测定Na2CO3固体(含少量NaCl)的纯度,设计如下装置(含试剂)进行实验。下列说法不正确的是( ) A.必须在②③间添加吸收HCl的装置 B.④的作用是防止空气中的气体影响实验的精确度 C.实验后通入空气的作用是保证②中产生的气体完全转移到③中 D.称取样品和③中产生沉淀的质量即可求算Na2CO3固体的纯度 [解析] ③中氢氧化钡溶液足量,故无需在②③间添加吸收HCl的装置,A项错误;④中盛装碱石灰,可防止空气中的二氧化碳气体进入③中与Ba(OH)2反应,影响实验的精确度,B项正确;实验后通入空气,可将生成的二氧化碳完全转移到③中,使其被充分吸收,减小实验误差,C项正确;③中产生的沉淀为碳酸钡,根据碳酸钡的质量可计算样品中所含碳酸钠的质量,进而可计算样品中Na2CO3固体的纯度,D项正确。 [答案] A 二、非选择题 5.Ⅰ.(2019·成都摸底测试)铝、铁、铜在工业和生产生活中有广泛应用。 (1)铝制品具有很好的耐腐蚀性能,原因是_________________;按性质分类,Al2O3属于________氧化物,依据是________________(用离子方程式表示)。 (2)某同学用下列实验探究铁与水蒸气的反应。 8 步骤①反应的化学方程式为_____________________________; 步骤③检验Fe2+的方法是____________________; 步骤④无明显现象,该同学认为步骤①铁与水蒸气反应只生成二价铁,该同学的判断是否正确及理由是____________________。 (3)含铬(Ⅵ)废水能致癌,Cu2O作光催化剂可将酸性废水中的Cr2O转化成Cr3+,并伴有无色气体生成,则反应的离子方程式为 _______________________________________________。 Ⅱ.(2019·洛阳第三次联考)向100 mL的NaOH溶液中通入CO2充分反应后,在减压和较低温度下,小心地将溶液蒸干,得到白色固体M。通入的CO2的体积V(标准状况)与M的质量W的关系如图所示。请回答下列问题: (1)B点时M的组成成分为________。 (2)若要使B点生成的盐的质量变为8.4 g,则应继续向溶液中通入CO2________L。 (3)向生成的7.16 g盐的溶液中加入一定量某物质,充分反应后,减压低温蒸发得到纯净的Na2CO3固体8.48 g。则: ①若只加入0.03 mol某物质,则加入的物质可以是________。 ②若只加入0.06 mol某物质,则加入的物质可以是________。 (4)常温下,同浓度的Na2CO3溶液和NaHCO3溶液的 pH都大于7,两者中________pH更大,其原因是__________。 [解析] Ⅰ.(1)铝与氧气反应生成致密的氧化膜,对铝起到保护作用,因此铝制品具有很好的耐腐蚀性能;Al2O3既能与酸反应生成盐和水,又能与碱反应生成盐和水,因此Al2O3属于两性氧化物。(2)步骤①铁粉和水蒸气加热时反应生成Fe3O4和H2。步骤③检验Fe2+的实验操作为:取溶液少许于试管中,滴入几滴K3[Fe(CN)6]溶液,若有蓝色沉淀生成,则溶液中含有Fe2+。步骤④加入KSCN溶液,无明显现象,这并不能说明铁与水蒸气反应只生成二价铁,也可能是因为生成的Fe3O4溶于酸生成Fe3+,Fe3+与过量的铁粉反应生成Fe2+。(3)Cr2O转化成Cr3+,Cr元素化合价降低,则O元素化合价升高,生成的无色气体为O2,根据得失电子守恒、原子守恒和电荷守恒配平离子方程式为:2Cr2O+16H+4Cr3++3O2↑+8H2O。 8 Ⅱ.(1)由题图知NaOH的质量为4 g,其物质的量为0.1 mol,根据Na+守恒可知NaOH完全转化为Na2CO3时,Na2CO3的质量为0.1 mol××106 g·mol-1=5.3 g,完全转化为NaHCO3时,NaHCO3的质量为0.1 mol×84 g·mol-1=8.4 g,故B点时M的组成成分为Na2CO3和NaHCO3。(2)设B点时Na2CO3的物质的量为x mol,NaHCO3的物质的量为y mol,则2x+y=0.1,106x+84y=7.16,解得x=0.02,y=0.06,若要使B点生成的盐的质量变为8.4 g,则应继续向溶液中通入二氧化碳,将碳酸钠转化为碳酸氢钠,故继续通入CO2的体积=0.02 mol×22.4 L·mol-1=0.448 L。(3)7.16 g盐为0.02 mol Na2CO3和0.06 mol NaHCO3,8.48 g Na2CO3固体的物质的量为0.08 mol,即要将0.06 mol NaHCO3变为0.06 mol Na2CO3。①根据Na元素守恒,0.03 mol物质中需有0.06 mol Na,故符合条件的有Na2O或Na2O2。②根据Na元素守恒,0.06 mol物质中需有0.06 mol Na,故符合条件的有Na、NaOH等。(4)在相同条件下CO的水解能力比HCO的水解能力强,所以等浓度的两溶液,碳酸钠溶液的碱性强。 [答案] Ⅰ.(1)铝与氧气反应生成致密的氧化膜,对铝起到保护作用 两性 Al2O3+6H+===2Al3++3H2O、Al2O3+2OH-===2AlO+H2O (2)3Fe+4H2O(g)Fe3O4+4H2 取溶液少许于试管中,滴入几滴K3[Fe(CN)6]溶液,若有蓝色沉淀生成,则溶液中含有Fe2+ 不正确,铁与水蒸气反应生成的Fe3O4溶于酸生成Fe3+,Fe3+与过量的铁粉反应生成Fe2+,所以加KSCN溶液不变色 (3)2Cr2O+16H+4Cr3++3O2↑+8H2O Ⅱ.(1)Na2CO3和NaHCO3 (2)0.448 (3)①Na2O或Na2O2 ②Na或NaOH (4)Na2CO3溶液 Na2CO3的水解程度比NaHCO3的大 8查看更多