- 2021-08-24 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届新课标Ⅰ卷冲刺高考考前预热卷(二)化学试题卷 Word版含答案
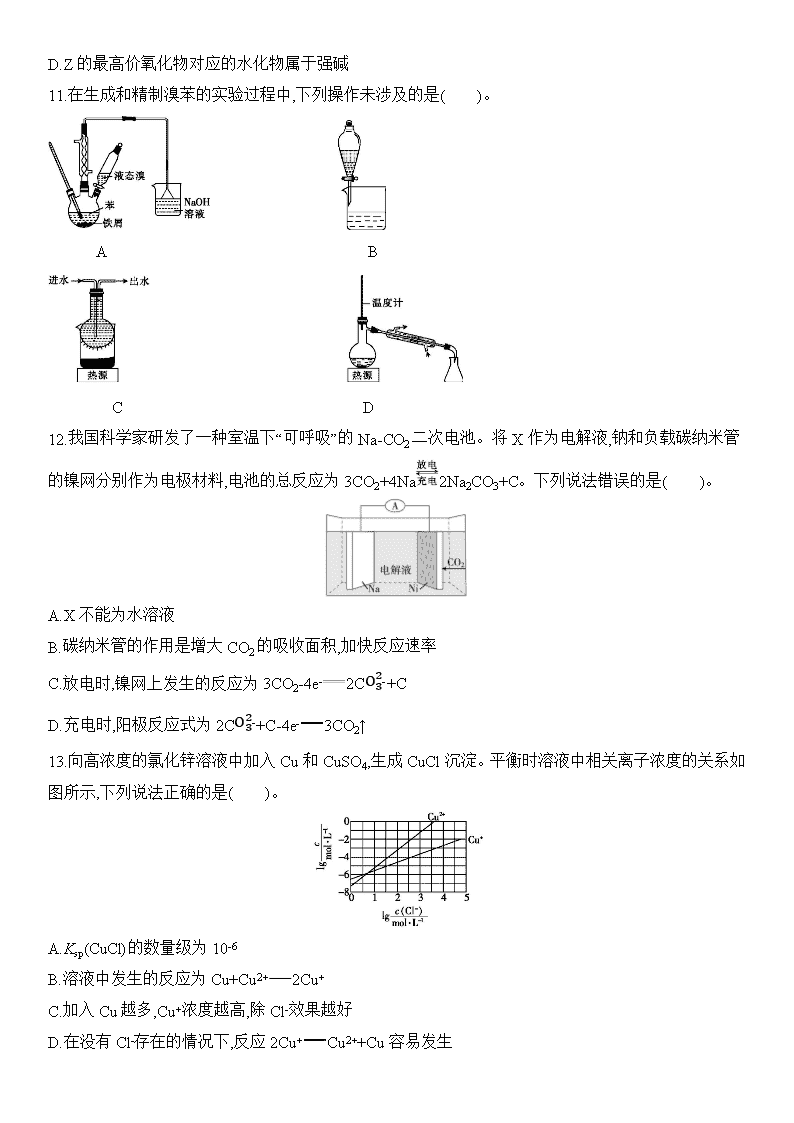
2020届新课标Ⅰ卷冲刺高考考前预热卷(二) 化学试题卷 考生注意: 1.本卷共100分,考试时间50分钟。 2. 答卷前,考生务必将自己的姓名、考生号、考场号和座位号填写在答题卡上。 3. 不得在本卷上答题,请将答案填写在答题卡指定区域。 可能用到的相对原子质量:H 1 C 12 N 14 O 16 P 31 S 32 Cl 35.5 Cu 64 Zn 65 一、选择题:本大题共7小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。 7.下列有关物质的性质与用途的关系不对应的是( )。 A.NH4HCO3受热易分解,可用作化肥 B.稀硫酸具有酸性,可用于除去铁锈 C.SO2具有漂白性,可用于纸浆漂白 D.Al(OH)3具有两性,可治疗胃酸过多 8.科研团队利用多功能催化剂首次实现了CO2直接加氢制取汽油的过程,其转化过程如图所示。 下列说法正确的是( )。 A.反应①的产物中含有水 B.反应②中只有碳碳键形成 C.所制得的汽油主要成分是烃和烃的含氧衍生物 D.这种人造汽油用作汽车燃料时,汽车尾气中不含氮氧化物 9.设NA为阿伏加德罗常数的值。下列说法中不正确的是( )。 A.标准状况下,22.4 L Cl2通入足量NaOH溶液中,完全反应后转移的电子数为2NA B.20 g D2O含有的电子数为10NA C.1 L 0.1 mol·L-1 NH4NO3溶液中的氮原子数为0.2NA D.25 ℃时,1 L pH=12的NaClO溶液中由水电离出的OH-的数目为0.01NA 10.主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。W、X处于同周期,W、Y处于同主族,W、X、Z原子的最外层电子数之和为13;Y的一种单质容易自燃。下列说法错误的是( )。 A.Y的最高价氧化物可用作干燥剂 B.原子半径:Z>Y>W>X C.X、Z形成的化合物中只含离子键 D.Z的最高价氧化物对应的水化物属于强碱 11.在生成和精制溴苯的实验过程中,下列操作未涉及的是( )。 A B C D 12.我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池。将X作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为3CO2+4Na2Na2CO3+C。下列说法错误的是( )。 A.X不能为水溶液 B.碳纳米管的作用是增大CO2的吸收面积,加快反应速率 C.放电时,镍网上发生的反应为3CO2-4e-2CO32-+C D.充电时,阳极反应式为2CO32-+C-4e-3CO2↑ 13.向高浓度的氯化锌溶液中加入Cu和CuSO4,生成CuCl沉淀。平衡时溶液中相关离子浓度的关系如图所示,下列说法正确的是( )。 A.Ksp(CuCl)的数量级为10-6 B.溶液中发生的反应为Cu+Cu2+2Cu+ C.加入Cu越多,Cu+浓度越高,除Cl-效果越好 D.在没有Cl-存在的情况下,反应2Cu+Cu2++Cu容易发生 二、非选择题:包括必考题和选考题两部分。第26~28题为必考题,每道题考生都必须作答。第35、36题为选考题,考生根据要求作答。 (一)必考题:共43分。 26.MnCO3可用作电器元件材料,也可作为瓷釉、颜料的制作原料。工业上用酸性含锰废水(主要含Mn2+、Cl-、H+、Fe2+、Cu2+)制备MnCO3的流程如图所示: 几种金属离子沉淀的pH如表: 金属离子 Fe2+ Fe3+ Cu2+ Mn2+ 开始沉淀的pH 7.5 3.2 5.2 8.8 完全沉淀的pH 9.7 3.7 6.4 10.4 回答下列问题: (1)①中加入过量MnO2的作用是 ,滤渣W的成分是 。 (2)过程③中,调pH的目的是 。 (3)过程④中有CO2生成,则生成MnCO3的离子方程式是 。 (4)过程④中得到纯净MnCO3的操作方法是 ,该过程中的副产品化学式是 。 (5)MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示。则300 ℃时,剩余固体中n(Mn)∶n(O)为 ;图中点D对应固体的成分为 (填化学式)。 27.碘化钾是一种无色晶体,易溶于水。实验室制备KI晶体的步骤如下: Ⅰ.在如图所示的三颈烧瓶中加入127 g研细的单质I2和195 g 30% KOH溶液,搅拌(已知:I2与KOH反应的产物之一是KIO3); Ⅱ.碘完全反应后,打开分液漏斗中的活塞、弹簧夹,向装置C中通入足量的H2S; Ⅲ.反应结束后,向装置C中加入稀H2SO4酸化,水浴加热; Ⅳ.冷却,过滤得KI粗溶液。 (1)检查装置A气密性的方法是 ,步骤Ⅰ控制KOH溶液过量的目的是 。 (2)装置B的作用是 ,装置D中盛放的溶液是 。 (3)写出装置C中H2S和KIO3反应的离子方程式: 。 (4)步骤Ⅲ中水浴加热的目的是除去 (填化学式)。 (5)由步骤Ⅳ所得的KI粗溶液(含SO42-)制备KI晶体的实验方案:边搅拌边向溶液中加入足量的 (填化学式,下同),充分搅拌、过滤、洗涤并检验后,将滤液和洗涤液合并,加入HI溶液调至弱酸性,在不断搅拌下蒸发至较多晶体析出,停止加热,用余热蒸干,得到KI晶体。在测定产品中KI含量时,测得其含量为101.5%,其原因可能是产品中含有 。 28.随着现代工业的发展,工业副产物HCl的产量越来越大,有人提出利用常见氧化剂O2将其转化为重要化工原料Cl2,达到“变废为宝”的目的。回答下列问题: (1)已知:①2H2(g)+O2(g)2H2O(g) ΔH=-483.2 kJ·mol-1 ② 则反应4HCl(g)+O2(g)2Cl2(g)+2H2O(g) ΔH= kJ·mol-1。 (2)Deacon发明的直接氧化法为4HCl(g)+O2(g)2Cl2(g)+2H2O(g)。下图为刚性容器中,进料浓度比c(HCl)∶c(O2)分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系: 可知图中表示1∶1的曲线是 ,设HCl初始浓度为c0,根据进料浓度比c(HCl)∶c(O2)=4∶1的数据计算K(400 ℃)= (列出计算式);为了提高HCl的转化率,可采取的措施有 (填字母)。 A.适当增大n(HCl)n(O2) B.适当增加n(O2) C.选用高效催化剂 D.适当增大压强 (3)随着石墨烯在电池领域的大量使用,有人提出利用石墨烯的吸附性设计HCl-O2酸性燃料电池,则通HCl的电极为电源的 极,电极反应式为 。 (二)选考题:共15分。请考生从给出的2道化学题中任选一题作答。如果多做,则按第一题计分。 35.[化学——选修3:物质结构与性质](15分) 氟及其化合物用途非常广泛。回答下列问题: (1)聚四氟乙烯是一种准晶体,该晶体是一种无平移周期序,但有严格准周期位置序的独特晶体。可通过 方法区分晶体、准晶体和非晶体。 (2)基态铜原子价电子排布的轨道式为 。 (3)[H2F]+[SbF6]-(氟酸锑)是一种超强酸,存在[H2F]+,该离子的空间构型为 ,依次写出一种与[H2F]+具有相同空间构型和键合形式的分子和阴离子: 、 。 (4)NH4F(氟化铵)可用作玻璃蚀刻剂、防腐剂、消毒剂等。NH4+的中心原子的杂化类型是 ;氟化铵中存在 (填字母)。 A.离子键 B.σ键 C.π键 D.氢键 (5)SbF6被广泛用作高压电气设备绝缘介质。SbF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图(见图a)计算相关键能。则F—F键的键能为 kJ·mol-1,S—F键的键能为 kJ·mol-1。 (6)CuCl的熔点为426 ℃,熔融状态下几乎不导电;CuF的熔点为908 ℃,密度为7.1 g·cm-3。 ①CuF比CuCl熔点高的原因是 。 ②已知NA为阿伏加德罗常数的值。CuF的晶胞结构如图b所示。则CuF的晶胞参数a= nm(列出计算式)。 图a 图b 36.[化学——选修5:有机化学基础](15分) 有机物A是一种重要的化工原料,以A为主要起始原料,通过下列途径可以合成高分子材料PA及PC。 试回答下列问题: (1)B的化学名称为 ,BC的反应条件是 。 (2)EF的反应类型为 ,高分子材料PA的结构简式为 。 (3)由A生成H的化学方程式为 。 (4)实验室检验有机物A,可选择下列试剂中的 。 a.盐酸 b.FeCl3溶液 c. NaHCO3溶液 d.浓溴水 (5)E的同分异构体中,既能与碳酸氢钠溶液反应,又能发生银镜反应的有机物共有 种。其中核磁共振氢谱图有5组峰,且峰面积之比为6∶1∶1∶1∶1的物质的结构简式为 。 (6)由B通过三步反应制备1,3-环己二烯的合成路线为 (无机试剂任选)。 参考答案 7 8 9 10 11 12 13 A A A C C C D 26. (1)将Fe2+氧化为Fe3+ Fe(OH)3、MnO2 (2)使Cu2+完全转化为Cu(OH)2 (3)Mn2++2HCO3-MnCO3↓+CO2↑+H2O (4)过滤、洗涤、干燥 NH4Cl (5)1∶2 Mn3O4和MnO 27. (1)向分液漏斗中注入水后,关闭弹簧夹,打开分液漏斗活塞使液体流下,一段时间后液体不能顺利流下,说明气密性良好 确保碘充分反应 (2)除去H2S气体中的HCl NaOH溶液 (3)IO3-+3H2S3S↓+I-+3H2O (4)H2S (5)BaCO3 I2(或KI3) 28. (1)-117.2 (2)c 0.382×0.382(1-0.76)4×(0.25-0.19)c0 BD (3)负 2HCl-2e-2H++Cl2↑ 35.答案 (1)X-射线衍射 (2) (3)V形 H2O(或H2S) NH2- (4)sp3 AB (5)155 327 (6)①CuCl是分子晶体,CuF是离子晶体 ②34×64+4×197.1NA×107(或34×837.1NA×107) 36. (1)环己醇 浓硫酸、加热 (2)氧化反应 HO查看更多