- 2021-08-24 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届新课标Ⅰ卷冲刺高考考前预热卷(六)化学试题卷 Word版含答案
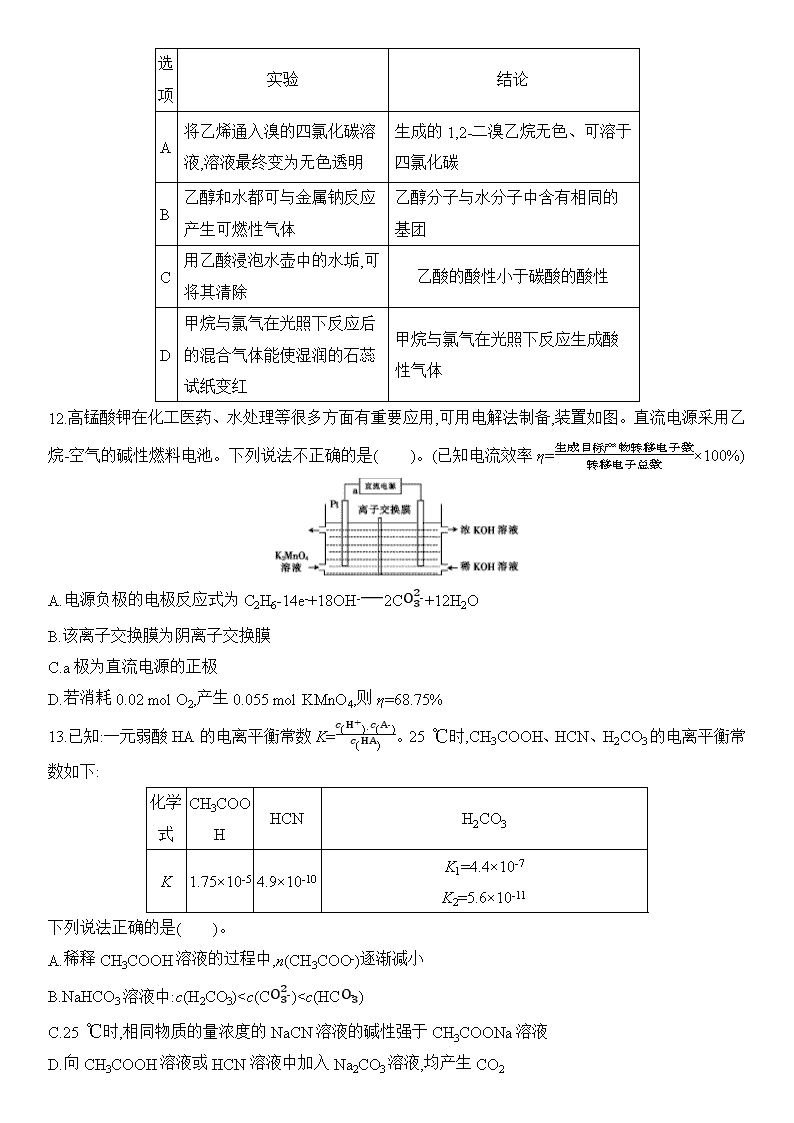
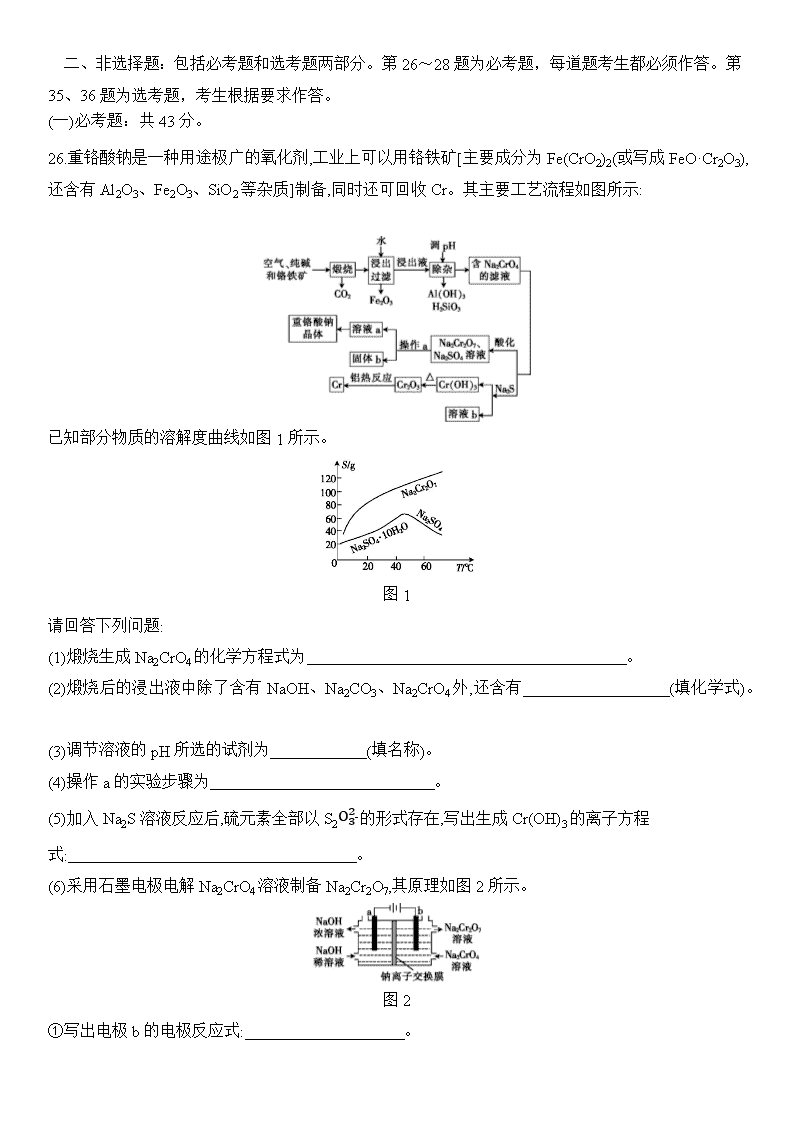
2020届新课标Ⅰ卷冲刺高考考前预热卷(六) 化学试题卷 考生注意: 1.本卷共100分,考试时间50分钟。 2. 答卷前,考生务必将自己的姓名、考生号、考场号和座位号填写在答题卡上。 3. 不得在本卷上答题,请将答案填写在答题卡指定区域。 可能用到的相对原子质量:H 1 C 12 N 14 O 16 P 31 S 32 Cl 35.5 Cu 64 Zn 65 一、选择题:本大题共7小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。 7.化学与生活、生产、社会可持续发展密切相关。下列有关化学知识的说法错误的是( )。 A.高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” B.我国发射“嫦娥”三号卫星所使用的碳纤维,是一种非金属材料 C.用聚氯乙烯代替木材,生产快餐盒,以减少木材的使用 D.碳纳米管表面积大,可用作新型储氢材料 8.下列关于有机化合物的说法错误的是( )。 A.纤维素属于天然高分子化合物 B.可用溴水来鉴别乙苯和苯乙烯 C.苯只能发生氧化反应和取代反应 D.葡萄糖和果糖互为同分异构体 9.设NA为阿伏加德罗常数的值。下列体系中指定微粒或化学键的数目一定为NA的是( )。 A.46.0 g乙醇与过量冰醋酸在浓硫酸加热条件下反应所得的乙酸乙酯分子 B.36.0 g CaO2与足量水完全反应过程中转移的电子 C.53.5 g氯化铵固体溶于氨水所得中性溶液中的NH4+ D.5.0 g乙烷中所含的共价键 10. W、X、Y、Z为原子序数依次增大的四种短周期主族元素,W的简单氢化物与其最高价氧化物对应的水化物反应可生成一种离子化合物,Y的原子半径是所有短周期主族元素原子中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气味的气体产生。下列说法不正确的是( )。 A.X的单质可以与W的氢化物发生置换反应生成W的单质 B.X与W、Y、Z都能形成两种或两种以上的化合物 C.Y与Z形成化合物的水溶液可使红色石蕊试纸变蓝 D.W的简单氢化物的热稳定性比X的强 11.下列由实验得出的结论不正确的是( )。 选项 实验 结论 A 将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明 生成的1,2-二溴乙烷无色、可溶于四氯化碳 B 乙醇和水都可与金属钠反应产生可燃性气体 乙醇分子与水分子中含有相同的基团 C 用乙酸浸泡水壶中的水垢,可将其清除 乙酸的酸性小于碳酸的酸性 D 甲烷与氯气在光照下反应后的混合气体能使湿润的石蕊试纸变红 甲烷与氯气在光照下反应生成酸性气体 12.高锰酸钾在化工医药、水处理等很多方面有重要应用,可用电解法制备,装置如图。直流电源采用乙烷-空气的碱性燃料电池。下列说法不正确的是( )。(已知电流效率η=生成目标产物转移电子数转移电子总数×100%) A.电源负极的电极反应式为C2H6-14e-+18OH-2CO32-+12H2O B.该离子交换膜为阴离子交换膜 C.a极为直流电源的正极 D.若消耗0.02 mol O2,产生0.055 mol KMnO4,则η=68.75% 13.已知:一元弱酸HA的电离平衡常数K=c(H+)·c(A-)c(HA)。25 ℃时,CH3COOH、HCN、H2CO3的电离平衡常数如下: 化学式 CH3COOH HCN H2CO3 K 1.75×10-5 4.9×10-10 K1=4.4×10-7 K2=5.6×10-11 下列说法正确的是( )。 A.稀释CH3COOH溶液的过程中,n(CH3COO-)逐渐减小 B.NaHCO3溶液中:c(H2CO3)查看更多