- 2021-08-24 发布 |
- 37.5 KB |
- 6页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高中化学第一章原子结构与元素周期律第一节原子结构第1课时原子核核素教案鲁科版必修2
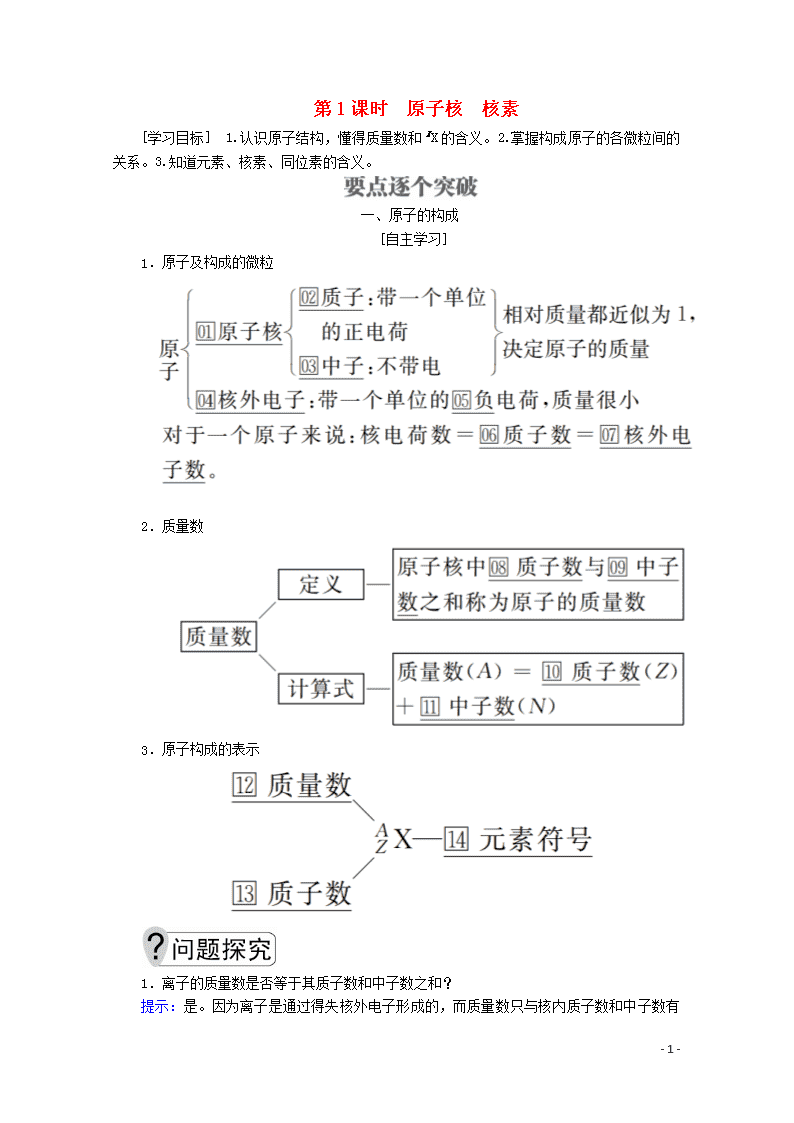
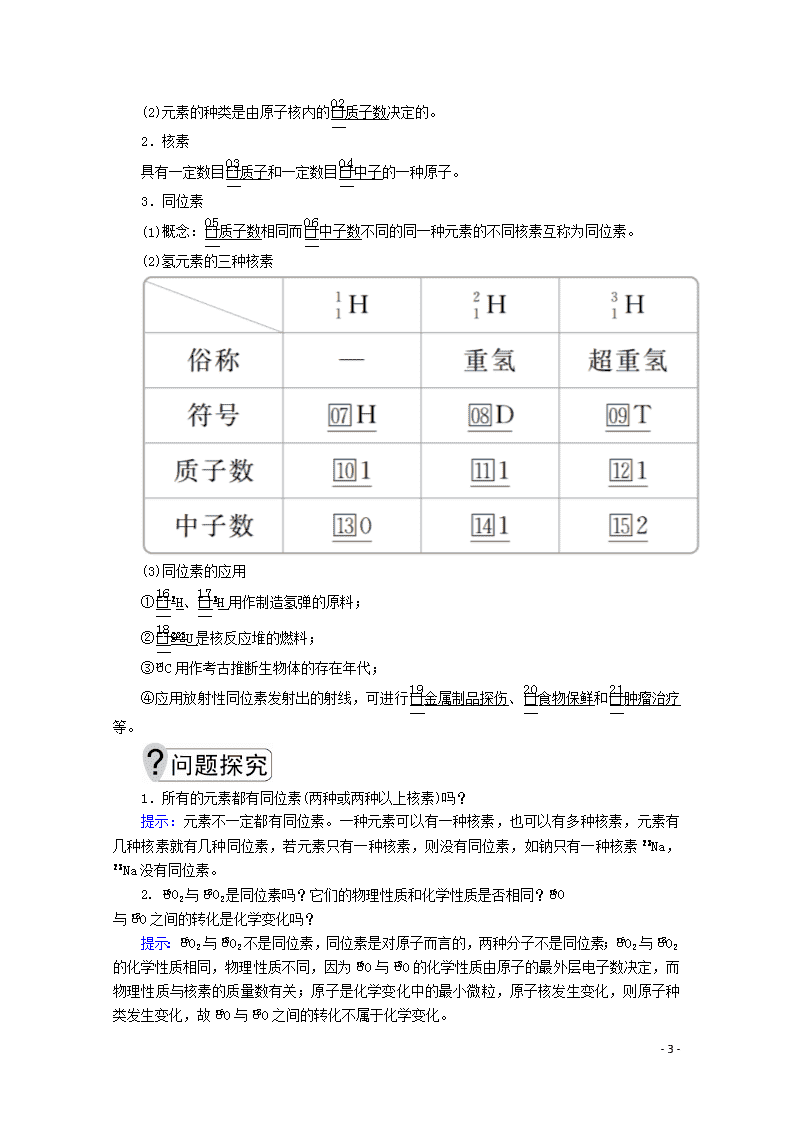
第1课时 原子核 核素 [学习目标] 1.认识原子结构,懂得质量数和X的含义。2.掌握构成原子的各微粒间的关系。3.知道元素、核素、同位素的含义。 一、原子的构成 [自主学习] 1.原子及构成的微粒 2.质量数 3.原子构成的表示 1.离子的质量数是否等于其质子数和中子数之和? 提示: - 6 - 是。因为离子是通过得失核外电子形成的,而质量数只与核内质子数和中子数有关,与核外电子数无关。 2.任何原子都是由质子、中子和电子构成的吗? 提示:不一定。氢原子(H)中含有一个质子和一个电子,不含有中子。 [点拨提升] 1.原子的相对质量(M)=≈质量数=质子数+中子数。 2.原子、离子组成中的数量关系 (1)核电荷数=质子数=原子核外电子数。 (2)质量数(A)=质子数(Z)+中子数(N)。 (3)阳离子中:质子数=核电荷数=核外电子数+离子电荷数。 (4)阴离子中:质子数=核电荷数=核外电子数-离子电荷数。 [练习与活动] 1.下列关于微粒 Rn-的叙述不正确的是( ) A.所含质子数=A-n B.所含中子数=A-Z C.所含电子数=Z+n D.所带电荷数=n 答案 A 解析 Rn-的质子数=Z,中子数=A-Z,电子数=Z+n,电荷数=n,A不正确。 2.已知R2+核内共有N个中子,R原子的质量数为A,则m g R2+中所含有的电子的物质的量为( ) A. mol B. mol C. mol D. mol 答案 B 解析 R原子与R2+的质量数都等于A,其相对原子质量近似等于A,R2+的质子数为A-N,R2+的核外电子数为A-N-2,1 mol R2+含电子的物质的量为(A-N-2) mol, m g R2+的物质的量为 mol,所以m g R2+中含有的电子的物质的量为 mol。 规律方法 (1)原子中不一定含有中子,且中子数不一定等于质子数,如H。 (2)任何微粒中,质量数=质子数+中子数,但质子数与核外电子数不一定相等。 (3)质子数相同的微粒不一定属于同一元素,如Ne和H2O。 二、核素 [自主学习] 1.元素 (1)概念:具有相同质子数(核电荷数)的同一类原子的总称。 - 6 - (2)元素的种类是由原子核内的质子数决定的。 2.核素 具有一定数目质子和一定数目中子的一种原子。 3.同位素 (1)概念:质子数相同而中子数不同的同一种元素的不同核素互称为同位素。 (2)氢元素的三种核素 (3)同位素的应用 ①H、H用作制造氢弹的原料; ②U是核反应堆的燃料; ③C用作考古推断生物体的存在年代; ④应用放射性同位素发射出的射线,可进行金属制品探伤、食物保鲜和肿瘤治疗等。 1.所有的元素都有同位素(两种或两种以上核素)吗? 提示:元素不一定都有同位素。一种元素可以有一种核素,也可以有多种核素,元素有几种核素就有几种同位素,若元素只有一种核素,则没有同位素,如钠只有一种核素Na,Na没有同位素。 2. O2与O2是同位素吗?它们的物理性质和化学性质是否相同?O 与O之间的转化是化学变化吗? 提示:O2与O2不是同位素,同位素是对原子而言的,两种分子不是同位素;O2与O2的化学性质相同,物理性质不同,因为O与O的化学性质由原子的最外层电子数决定,而物理性质与核素的质量数有关;原子是化学变化中的最小微粒,原子核发生变化,则原子种类发生变化,故O与O之间的转化不属于化学变化。 - 6 - [点拨提升] 1.元素、核素、同位素和同素异形体的区别与联系 (1)区别 (2)联系 ①一种单质可由不同的核素构成,一种核素可以构成不同的单质。 ②一种元素可以有若干种不同的核素,也可以只有一种核素,有多少种核素,就有多少种原子。 2.同位素之间的性质 (1)同一种元素的各种核素化学性质几乎相同,物理性质有一定的差异。 - 6 - (2)天然存在的某元素的核素,不论是游离态还是化合态,各种核素所占的原子个数百分比一般是不变的。 [练习与活动] A.2种 B.3种 C.4种 D.5种 答案 B 解析 质子数决定元素的种类,题给5种单核粒子质子数有18、19、20三种,故为3种元素。 4.“玉兔”号月球车用Pu作为热源材料,下列关于Pu的说法正确的是( ) A.Pu与U互为同位素 B.Pu与Pu互为同素异形体 C.Pu与U具有完全相同的化学性质 D.Pu与Pu具有相同的最外层电子数 答案 D 解析 Pu与U是两种不同的元素,不属于同位素,A项不正确;Pu与Pu的质子数相同,中子数不同,互为同位素,D项正确;同素异形体的研究对象是单质,Pu与Pu为同种元素的两种核素,是同位素,而 不是同素异形体,B项不正确;Pu与U属于两种元素的核素,化学性质不同,C项不正确。 规律方法 (1)元素、核素、同位素之间的关系可以用下图表示: (2)判断元素、核素、同位素的方法(原子用X表示) ①只要Z相同就是同种元素; ②Z和A均相同为同种核素; ③Z相同A不相同则互为同位素。 - 6 - 本课归纳总结 - 6 -查看更多