2020高考化学冲刺600分考前仿真冲刺卷一含解析
考前仿真冲刺卷(一)
1.本卷包括选择题和非选择题两部分,共100分,建议用时50分钟。
2.可能用到的相对原子质量:
H-1 C-12 N-14 O-16 Na-23 Al-27 S-32 Cl-35.5 K-39 Fe-56 Cu-64 I-127
一、选择题:本题共7小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
7.中国古代记载文字的器物中,主要成分为蛋白质的是( )
A.丝帛 B.竹简
C.甲骨 D.青铜器
答案:A
解析:丝帛是用蚕丝织成的,主要成分是蛋白质,A项正确;竹简的主要成分是纤维素,B项错误;甲骨的主要成分是钙盐,C项错误;青铜器是金属制品,主要成分为铜合金,D项错误。
8.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,22.4 L Cl2完全溶于水时转移的电子数为NA
B.1 mol羟基(—OH)含有的电子数为9 NA
C.100 g 30%CH3COOH溶液中氢原子数为2NA
D.100 mL水中OH-的个数是10-8NA
答案:B
解析:Cl2与水的反应为可逆反应,标准状况下,22.4 L Cl2完全溶于水,不可能完全反应,转移电子数小于NA,A项错误;1个羟基(—OH)所含电子数为8+1=9,则1 mol羟基(—OH)含有的电子数为9NA,B项正确;100 g 30% CH3COOH溶液中CH3COOH、H2O均含氢原子,氢原子数为×NA,C项错误;未指明温度,100 mL水中OH-的个数不一定是10-8NA,D项错误。
9.下列关于有机物的叙述不正确的是( )
A.用植物油萃取分离溴水中的溴时,振荡、静置后,下层为无色
B.硬脂酸(C17H35COOH)与软脂酸(C15H31COOH)一定互为同系物
C.2丙酰吡咯是一种食用香料,其分子式为C7H9NO
D.分子式为C5H8O2
13
的同分异构体中,含有一个甲基且能与溴水发生加成反应的链状酯有9种(不考虑立体异构)
答案:A
解析:植物油可与溴发生加成反应,不能用于萃取分离溴水中的溴,A错误;硬脂酸和软脂酸均为饱和脂肪酸,B正确;由结构简式可知,2丙酰吡咯的分子式为C7H9NO,C正确;由分子式可知,链状酯的不饱和度为2,含有一个碳碳双键,则符合条件的双键可能的位置有
共9种,D正确。
10.短周期主族元素X、Y、Z、W的原子序数依次增大,X、W同主族;Y、Z同周期;X、Y、Z三种元素形成一种化合物M,常温下,0.1 mol·L-1 M的水溶液中=1.0×10-12。下列说法正确的是( )
A.简单离子半径:Y
Z>W
D.Z分别与X、W均可形成具有漂白性的化合物
答案:D
解析:由0.1 mol·L-1M溶液中=1.0×10-12可知M为一元强酸⇒HNO3,故X、Y、Z分别为H、N、O。又X、W同主族,故W为Na。A项离子半径N3->O2->Na+,错误;B项H与O可形成H2O、H2O2为共价化合物,所含化学键为共价键,H与Na形成NaH为离子化合物,所含化学键为离子键,错误;C项非金属性O>N>H,错误;D项H2O2、Na2O2具有强氧化性,可氧化漂白一些物质,正确。
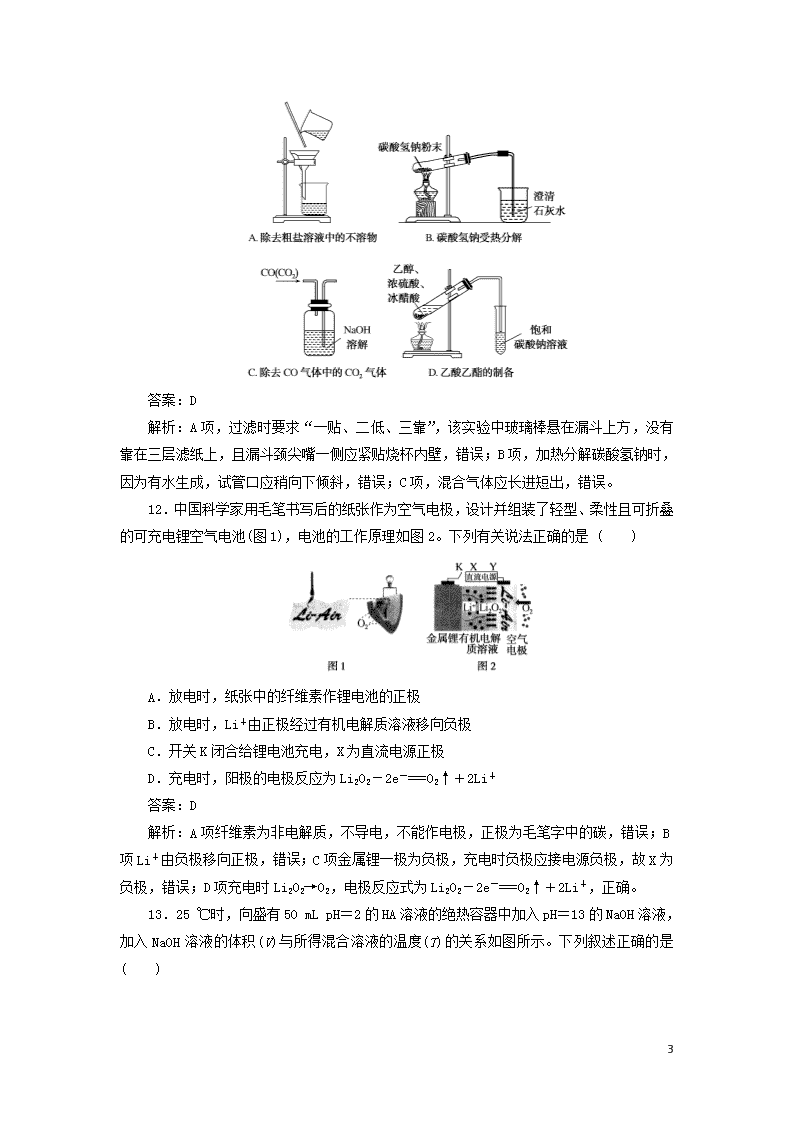
11.下列图示实验正确的是( )
13
答案:D
解析:A项,过滤时要求“一贴、二低、三靠”,该实验中玻璃棒悬在漏斗上方,没有靠在三层滤纸上,且漏斗颈尖嘴一侧应紧贴烧杯内壁,错误;B项,加热分解碳酸氢钠时,因为有水生成,试管口应稍向下倾斜,错误;C项,混合气体应长进短出,错误。
12.中国科学家用毛笔书写后的纸张作为空气电极,设计并组装了轻型、柔性且可折叠的可充电锂空气电池(图1),电池的工作原理如图2。下列有关说法正确的是 ( )
A.放电时,纸张中的纤维素作锂电池的正极
B.放电时,Li+由正极经过有机电解质溶液移向负极
C.开关K闭合给锂电池充电,X为直流电源正极
D.充电时,阳极的电极反应为Li2O2-2e-===O2↑+2Li+
答案:D
解析:A项纤维素为非电解质,不导电,不能作电极,正极为毛笔字中的碳,错误;B项Li+由负极移向正极,错误;C项金属锂一极为负极,充电时负极应接电源负极,故X为负极,错误;D项充电时Li2O2→O2,电极反应式为Li2O2-2e-===O2↑+2Li+,正确。
13.25 ℃时,向盛有50 mL pH=2的HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示。下列叙述正确的是( )
13
A.HA溶液的物质的量浓度为0.01 mol·L-1
B.b→c的过程中,温度降低的原因是溶液中发生了吸热反应
C.a→b的过程中,混合溶液中可能存在:c(A-)=c(Na+)
D.25 ℃时,HA的电离平衡常数K约为1.43×10-2
答案:C
解析:pH=13的NaOH溶液,c(OH-)=0.1 mol·L-1,温度最高点为酸、碱恰好完全反应,c(HA)约为=0.08 mol·L-1,A项错误;b→c过程中温度降低,是因为加入过量的NaOH或体系散热,B项错误;b点,酸、碱恰好完全反应,溶液呈碱性,b点前有溶液呈中性,此时c(A-)=c(Na+),C项正确;
HA H++A-
c(始)/(mol·L-1) 0.08 0 0
c(变)/(mol·L-1) 0.01 0.01 0.01
c(平)/(mol·L-1) 0.07 0.01 0.01
K==1.43×10-3,D项错误。
二、非选择题:包括必考题和选考题两部分。第26~28题为必考题,每个试题考生都必须作答。第35~36题为选考题,考生根据要求作答。
(一)必考题(3题,共43分)
26.(14分)作为工业生产的催化剂和制备纳米MgO的材料,草酸镁(MgC2O4·2H2O)有着广阔的应用和发展前景。回答下列问题:
(1)MgC2O4·2H2O的制备
已知氯化镁、草酸铵、草酸镁在水中的溶解度如下表:
13
氯化镁
草酸铵
草酸镁
20 ℃
54.6 g
4.45 g
微溶
70 ℃
61.0 g
22.4 g
100 ℃
73.3 g
34.7 g
实验方法:(ⅰ)加热煮沸蒸馏水,取300 mL冷却至70 ℃,加140 g MgCl2·6H2O,配制MgCl2溶液;(ⅱ)按照图示装置装好药品,连接好装置;(ⅲ)在磁力加热搅拌的情况下,缓缓滴入饱和(NH4)2C2O4溶液,并水浴加热,直至不再产生白色沉淀为止;(ⅳ)分离沉淀、洗涤,得MgC2O4·2H2O晶体。
①装置中仪器甲的名称是________,其冷水进水口为________(填“a”或“b”)。
②仪器乙中c部位的作用是
________________________________________________________________________
________________________________________________________________________。
③检验产品洗涤干净的方法是
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(2)MgC2O4·2H2O分解产物的探究
利用下图所示装置探究MgC2O4·2H2O分解产物CO、CO2等的性质。
①装置A中发生反应的化学方程式为
________________________________________________________________________
________________________________________________________________________。
②装置B中盛装的药品是
________________________________________________________________________,
装置C的作用是
________________________________________________________________________,
装置D中的试剂是
________________________________________________________________________,
装置G中的现象是
________________________________________________________________________。
13
答案:(1)①球形冷凝管(1分) a(1分) ②连通上下两部分气体,保证液体顺利流下(2分) ③取最后一次洗涤液,加入HNO3酸化,再加入AgNO3溶液,如不产生白色沉淀,说明已洗净,否则未洗净(其它合理答案也可)(3分) (2)①MgC2O4·2H2OMgO+CO↑+CO2↑+2H2O(3分) ②CuSO4(1分) 检验CO2(1分) NaOH溶液(1分) 固体由黑色变为红色(1分)
解析:
(1)②连通上下两部分气体,保证液体顺利滴下。
③晶体表面吸附的杂质离子有Mg2+、Cl-、NH、C2O选择Cl-进行检验,取最后一次洗涤液,加入HNO3酸化,加入AgNO3溶液,如不产生白色沉淀,说明已洗净,否则未洗净。
(2)①中MgC2O4·2H2O分解的产物有CO、CO2,由元素守恒知还有MgO、H2O,故分解的方程式为MgC2O4·2H2OMgO+CO↑+CO2↑+2H2O
③由于要检验探究生成的产物,故应先检验H2O(g),故B中放CuSO4。然后检验CO2,故C中应放澄清石灰水,为了防止CO2对CO的检验造成干扰,故应除去并检验是否完全除尽,故D中应放NaOH溶液。G中发生的反应为CuO+COCu+CO2,故G中的现象为固体由黑色变为红色。
27.(14分)一种磁性材料的磨削废料的主要成分是铁镍合金(含镍质量分数约21%),还含有铜、钙、镁、硅的氧化物。由该废料制备氢氧化镍,工艺流程如下:
回答下列问题:
(1)“酸溶”时,溶液中有Fe3+、Fe2+、Ni2+等生成,废渣的主要成分是________________________________________________________________________;金属镍溶解的离子方程式为
________________________________________________________________________。
(2)“除铁”时H2O2的作用是________________,加入碳酸钠的目的是________________________________________________________________________。
(3)“除铜”时,反应的离子方程式为________________,若用Na2S代替H2
13
S除铜,优点是________________________________________________________________________。
(4)已知除钙镁过程在陶瓷容器中进行,NaF的实际用量不能过多的理由为________________________________________________________________________
________________________________________________________________________。
(5)已知常温下Ksp[Ni(OH)2]=2.0×10-15,该流程在“沉镍”过程中需调节溶液pH约为____________,Ni2+才刚好沉淀完全(离子沉淀完全的浓度≤1.0×10-5 mol·L-1;lg 2=0.30)。
答案:
(1)SiO2(1分) 5Ni+12H++2NO===5Ni2++N2↑+6H2O(2分)
(2)将Fe2+氧化为Fe3+(1分) 调节溶液的pH,使Fe3+完全沉淀为黄钠铁矾渣(2分)
(3)H2S+Cu2+===CuS↓+2H+(2分) 无易挥发的有毒气体H2S逸出,可保护环境(2分)
(4)过量的F-生成氢氟酸会腐蚀陶瓷容器(2分)
(5)9.15(2分)
解析:
(1)“酸溶”时,硅的氧化物与硫酸和硝酸均不反应,故废渣的主要成分为SiO2。“酸溶”时加入的是混酸,金属镍溶解时,Ni与硝酸发生氧化还原反应,离子方程式为:5Ni+12H++2NO===5Ni2++N2↑+6H2O。(2)“酸溶”后所得溶液中含有Fe3+、Fe2+,“除铁”时H2O2的作用是将Fe2+氧化为Fe3+,加入碳酸钠的目的是调节溶液的pH,使Fe3+完全沉淀为黄钠铁矾渣。
(3)“除铜”时通入H2S将Cu2+沉淀,反应的离子方程式为:H2S+Cu2+===CuS↓+2H+。H2S为易挥发有毒气体,若用Na2S代替H2S除铜,可保护环境。(4)“除铜”时生成了CuS和H+,溶液酸性增强,加入NaF除钙镁,若NaF的实际用量过多,则有HF生成,HF会腐蚀陶瓷容器。(5)Ksp[Ni(OH)2]=c(Ni2+)·c2(OH-),Ni2+刚好沉淀完全时,c2(OH-)==(mol·L-1)2=2.0×10-10(mol·L-1)2,c(OH-)=×10-5mol·L-1,pH=-lg=-lg=-(-9-lg)=9+lg=9+lg 2=9.15。
28.(15分)乙烯是合成食品外包装材料聚乙烯的单体,可以由丁烷裂解制备。裂解的副反应为C4H10(g,正丁烷)CH4(g)+C3H6(g),请回答下列问题:
(1)化学上,将稳定单质的能量定为0,由元素的单质化合成单一化合物时的反应热叫该化合物的生成热,生成热可表示该物质相对能量。25 ℃、101 kPa几种有机物的生成热如下表所示:
物质
甲烷
乙烷
乙烯
丙烯
正丁烷
异丁烷
13
生成热/kJ·mol-1
-75
-85
52
20
-125
-132
由正丁烷裂解生成乙烯的热化学方程式为
________________________________________________________________________。
(2)一定温度下,在恒容密闭容器中投入一定量正丁烷发生反应生成乙烯。
①下列情况能说明该反应达到平衡状态的是
________________________________________________________________________
(填标号)。
A.气体密度保持不变
B.c(C2H4)·c(C2H6)/c(C4H10)保持不变
C.反应热保持不变
D.正丁烷分解速率和乙烷消耗速率相等
②为了提高反应速率和反应物的转化率,可采取的措施是
________________________________________________________________________。
(3)向密闭容器中充入正丁烷,在一定条件(浓度、催化剂及压强等)下发生反应,测得乙烯产率与温度关系如图所示。温度高于600 ℃时,随着温度升高,乙烯产率降低,可能的原因是________________________________________________________________________。
(4)在一定温度下向10 L恒容密闭容器中充入2 mol正丁烷,反应生成乙烯和乙烷,经过10 min达到平衡状态,测得平衡时气体压强是原来的1.75倍。
①0~10 min内乙烷的生成速率v(C2H6)=________ mol·L-1·min-1。
②上述条件下,正丁烷的平衡转化率为________,该反应的平衡常数K为________________________。
(5)丁烷-空气燃料电池以熔融的K2CO3(其中不含O2-和HCO)为电解质,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池的正极反应式为26CO2+13O2+52e-===26CO,则负极反应式为
________________________________________________________________________。
答案:(1)C4H10(g,正丁烷)C2H4(g)+C2H6(g) ΔH =+92 kJ·mol-1
13
(2分) (2)①BD(2分) ②升高温度(2分) (3)催化剂活性降低,副产物增多(2分) (4)①0.015(1分) ②75%(2分) 0.45(2分) (5)C4H10+13CO-26e-===17CO2+5H2O(2分)
解析:(1)反应热=生成物的总能量-反应物的总能量=52-85+125=+92 kJ·mol-1,所以正丁烷裂解生成乙烯的热化学方程式为C4H10(g,正丁烷)C2H4(g)+C2H6(g) ΔH=+92 kJ·mol-1。(2)①反应前后气体的总质量不变,在恒容密闭容器中,气体的总体积不变,根据ρ=m/V可知,混合气体的密度恒为定值,不能说明该反应达到平衡状态,A项错误;K=c(C2H4)·c(C2H6)/c(C4H10),当Qc=K时,反应达到平衡状态,B项正确;反应热与反应进行的程度有关,与反应是否达平衡无关,不能判断反应达到平衡状态,C项错误;正丁烷分解速率与乙烷消耗速率相等时,说明正逆反应速率相等,能够判断反应达到平衡状态,D项正确。②为了提高反应速率可以采用增大浓度、升高温度、增大压强、使用催化剂等;提高反应物的转化率,使平衡右移,可以采用升高温度,减少生成物浓度等,因此同时满足上述要求的是升高温度。(3)正丁烷制备乙烯的反应为吸热反应,升高温度,平衡右移,乙烯的转化率增大,但是温度高于600 ℃时,随着温度升高,乙烯产率降低,可能是温度过高,催化剂活性降低,副产物增多。(4)①在一定温度下向10 L恒容密闭容器中充入2 mol正丁烷,反应生成乙烯和乙烷,经过10 min达到平衡状态,测得平衡时气体压强是原来的1.75倍,平衡时气体总物质的量=2×1.75=3.5 mol,设生成乙烯的量x mol,2-x+x+x=3.5,x=1.5 mol,生成的乙烯为1.5 mol,生成乙烷的量为1.5 mol;0~10 min内的生成乙烷速率v(C2H6)=1.5/10÷10=0.015 mol·L-1·min-1。②根据以上分析可知:正丁烷的变化量1.5 mol,平衡转化率为1.5/2×100%=75%;上述条件下,反应达到平衡后,c(C4H10)=0.5/10=0.05 mol·L-1,c(C2H4)=c(C2H6)=1.5/10=0.15 mol·L-1,该反应的平衡常数K=c(C2H4)×c(C2H6)/c(C4H10)=(0.15)2/0.05=0.45。(5)丁烷—空气燃料电池,在熔融K2CO3(其中不含O2-和HCO)为电解质情况下,丁烷在负极上失电子发生氧化反应,负极反应为C4H10+13CO-26e-===17CO2+5H2O。
(二)选考题:共15分。请考生从给出的2道试题中任选一题作答。如果多做,则按所做的第一题计分。
35.[化学——选修3:物质结构与性质](15分)
金属钛因为其优越的性能被称为“未来金属”,其工业冶炼涉及到的反应如下:TiO2+2C+2Cl2TiCl4+2CO
回答下列相关问题:
(1)钛的价层电子排布式为________。
(2)已知部分物质熔沸点如下:
名称
金红石
金刚石
四氯化钛
四溴化钛
四碘化钛
化学式
TiO2
C
TiCl4
TiBr4
TiI4
13
熔点
1 830 ℃
3 550 ℃
-24.1 ℃
38 ℃
150 ℃
沸点
2 927 ℃
4 827 ℃
136.4 ℃
233.1 ℃
377.2 ℃
晶型
离子晶体
分子晶体
表中金刚石的晶型为________;自左向右,表中的三种钛的卤化物熔沸点依次升高的原因是__________________________________________________。
(3)配位数为6,组成为TiCl3·6H2O的晶体有两种:化学式为[TiCl(H2O)5]Cl2·H2O的X呈绿色,定量实验表明,X与AgNO3以1:2物质的量比反应生成沉淀。Y呈紫色,且Y与AgNO3以1:3物质的量之比反应生成沉淀,则Y的化学式为________,Y配离子的空间构型为________。
(4)钙钛矿是重要的含钛矿物之一,其主要成分Z的晶胞如图所示:
推测Z的化学式为____________________________。
(5)若晶胞参数a=384.1 pm,Z晶体的密度为________g/cm3(已知NA≈6.0×1023;3.8413≈)。
答案:(1)3d24s2(2分)
(2)原子晶体(2分) 分子晶体组成和结构相似时,相对分子质量越大,分子间作用力越大,熔沸点越高(2分)
(3)[Ti(H2O)6]Cl3(2分) 空间正八面体(2分)
(4)CaTiO3(2分) (5)4.0(3分)
解析:(1)钛原子核外有22个电子,价电子排布在3d、4s轨道,价电子排布为3d24s2;(2)金刚石的熔点高,所以金刚石是原子晶体; TiCl4、TiBr4、TiI4都是分子晶体,分子晶体组成和结构相似时,相对分子质量越大,分子间作用力越大,熔沸点越高,所以TiCl4、TiBr4、TiI4的熔沸点依次升高;(3)Y与AgNO3以1:3物质的量之比反应生成沉淀,说明外界有3个氯离子,6个水都在内界,Y的化学式为[Ti(H2O)6]Cl3;Y配离子的空间构型为空间正八面体;(4)根据均摊原则,每个晶胞含有Ti原子数是8×=1,含有Ca原子数是1,含有O原子数是 6×=3,所以Z的化学式是CaTiO3;(5)根据化学式可知Z的摩尔质量是136 g/mol;晶胞的体积是(3.841)3×10-24 cm3;则ρ==4.0 g/cm3。
13
36.[化学——选修5:有机化学基础](15分)
芳香烃A可以合成扁桃酸也可以合成H。以下是合成线路(部分产物、反应条件已略去):
已知:
请回答下列问题:
(1)扁桃酸中含氧官能团的名称是________;物质B的结构简式________。
(2)上述①~⑥反应中属于取代反应的有________。
(3)关于H物质,下列说法正确的是________(填字母序号)。
A.所有碳原子可能处于同一平面
B.可以发生加成反应、聚合反应、氧化反应和还原反应
C.H与G都能与新制Cu(OH)2反应
(4)写出反应⑥的化学方程式
________________________________________________________________________。
(5)X是扁桃酸的同分异构体,1 mol X可与2 mol Na2CO3反应,其核磁共振氢谱有四组峰,峰面积之比为3:2:2:1,其结构简式为________(任写两种)。
(6)请结合所学知识和上述信息,写出由A和乙醛为原料(无机试剂任用)制备肉桂醛()的合成路线流程图
________________________________________________________________________。
答案:
(1)羧基、羟基(1分) (1分)
(2)①、②、⑤(1分) (3)AB(2分)
(4) (2分)
13
(5) (4分)
(6) (4分)
解析:A为,B为,C为,扁桃酸为,D为或,E为或,F为或,G为或,H为或。
13
(1)扁桃酸中含氧官能团为羧基或羟基,B结构简式为。
(2)属于取代反应的为①②⑤。
(3)根据H的结构简式可知,所有碳原子可能处于同一平面,A项正确;H可发生加成反应、聚合反应、氧化反应和还原反应,B项正确;H不含有—CHO不能与Cu(OH)2反应,C项错误。
(4)反应⑥化学方程式为
(5)X可能为
(6)由和CH3CHO合成的合成流程为:
13