- 2021-08-23 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高考化学冲刺600分分层专题特训卷:考前仿真冲刺卷(二)
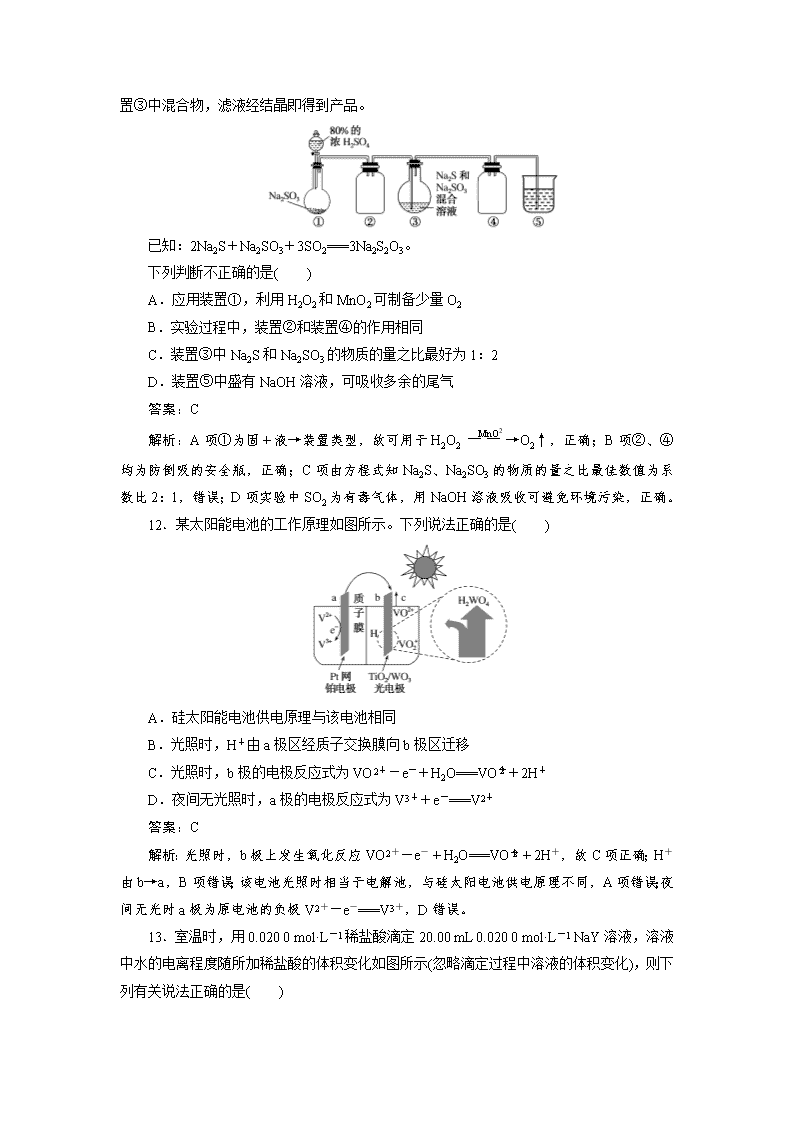
考前仿真冲刺卷(二) 1.本卷包括选择题和非选择题两部分,共100分,建议用时50分钟。 2.可能用到的相对原子质量: H-1 C-12 N-14 O-16 Na-23 Al-27 S-32 Cl-35.5 K-39 Fe-56 Cu-64 I-127 一、选择题:本题共7小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。 7.化学与社会、生产、生活和科技密切相关。下列有关说法错误的是( ) A.食醋又称为冰醋酸,易溶于水和乙醇 B.干冰、AgI都可用于人工降雨,但原理不同 C.可燃冰(CH4·nH2O)属于新型的一次能源 D.家用不粘锅的保护膜氟纶(CF2—CF2)属于有机高分子材料 答案:A 解析:冰醋酸为固态的纯醋酸,而食醋为混合物,A项错误;干冰可用于人工降雨是因为干冰升华时吸热,使水蒸气凝结,而AgI可用于人工降雨是因为AgI撒入过饱和云层后,成为凝结核,便于水蒸气的凝结,B项正确;可燃冰(CH4·nH2O)不可再生,属于新型的一次能源,C项正确;氟纶(CF2—CF2)属于有机高分子材料,D项正确。 8.下列关于有机化合物的说法正确的是( ) A.分子式为C4H8O2的有机物,存在含有六元环的同分异构体 B.裂化汽油可用于萃取溴水中的溴 C.除去乙醇中的少量水,方法是加入新制生石灰,经过滤后即得乙醇 D. 只能用金属钠鉴别a和b 答案:A 解析:A项C4H8O2的Ω=1,故可形成六元环状同分异构体,正确;B项,裂化汽油中含有烯烃,可与Br2发生加成反应,故不能用于萃取水中的溴,错误;C项除去乙醇中的水,加入新制生石灰后应采用蒸馏的方法,错误;D项,a中的官能团为,b中的官能团为—OH,故除可用金属钠鉴别二者外,还可用溴水进行鉴别,错误。 9.用NA表示阿伏加德罗常数的值,下列说法中正确的是( ) A.1 mol NaHCO3晶体中含有NA个HCO B.1 mol C2H6O分子中存在NA个碳氧键 C.1 mol铁粉在22.4 L(标准状况)氯气中充分燃烧,失去的电子数为0.3 NA D.1 mol Na2O2与足量的水充分反应,电子转移数目为2NA 答案:A 解析:A项1个NaHCO3中含1个Na+、1个HCO,故1 mol NaHCO3晶体中含有NA个HCO,正确;B项分子式为C2H6O的物质有两种:乙醇、甲醚,一个甲醚中有2个碳氧键,故1 mol C2H6O中不一定有NA个碳氧键,错误;C项铁粉与氯气反应,由题给量可知铁粉过量,Cl2完全反应,转移电子数为0.2 NA,错误;D项2Na2O2+2H2O===4NaOH+O2↑反应中转移2e-,故1 mol Na2O2参加反应时转移电子数为NA,错误。 10.短周期元素W、X、Y、Z的原子序数依次增加,由这些元素组成的常见物质的转化关系如下图,其中a、b、d、g为化合物,a为淡黄色固体,c是Z的单质,该单质与沸水缓慢反应,且该单质可制造照明弹;f为固体单质。下列有关说法正确的是( ) A.简单离子的半径:Y>Z>X B.元素的非金属性:W>X C.最高价氧化物对应水化物的碱性:Y>Z D.X、Y两种元素组成的化合物只含离子键 答案:C 解析:由a为淡黄色固体,e、f反应条件为点燃可推知a为Na2O2,e为O2,又c与沸水缓慢反应,且在b中燃烧可推知b为CO2,c为Mg,f为C。综合以上分析知W、X、Y、Z四种元素分别为C、O、Na、Mg。A项离子半径O2->Na+>Mg2+,错误;B项非金属性O>C,错误;C项碱性NaOH>Mg(OH)2,正确;D项Na、O两种元素形成的常见化合物有Na2O、Na2O2,Na2O2中含有离子键、非极性键,错误。 11.利用下图装置(略去部分夹持仪器,气密性已检验)生产硫代硫酸钠晶体(Na2S2O3·5H2O)。实验步骤是先向装置①的烧瓶中滴加80%的浓H2SO4;充分反应后过滤装置③中混合物,滤液经结晶即得到产品。 已知:2Na2S+Na2SO3+3SO2===3Na2S2O3。 下列判断不正确的是( ) A.应用装置①,利用H2O2和MnO2可制备少量O2 B.实验过程中,装置②和装置④的作用相同 C.装置③中Na2S和Na2SO3的物质的量之比最好为1:2 D.装置⑤中盛有NaOH溶液,可吸收多余的尾气 答案:C 解析:A项①为固+液→装置类型,故可用于H2O2O2↑,正确;B项②、④均为防倒吸的安全瓶,正确;C项由方程式知Na2S、Na2SO3的物质的量之比最佳数值为系数比2:1,错误;D项实验中SO2为有毒气体,用NaOH溶液吸收可避免环境污染,正确。 12.某太阳能电池的工作原理如图所示。下列说法正确的是( ) A.硅太阳能电池供电原理与该电池相同 B.光照时,H+由a极区经质子交换膜向b极区迁移 C.光照时,b极的电极反应式为VO2+-e-+H2O===VO+2H+ D.夜间无光照时,a极的电极反应式为V3++e-===V2+ 答案:C 解析:光照时,b极上发生氧化反应VO2+-e-+H2O===VO+2H+,故C项正确;H+由b→a,B项错误;该电池光照时相当于电解池,与硅太阳电池供电原理不同,A项错误;夜间无光时a极为原电池的负极V2+-e-===V3+,D错误。 13.室温时,用0.020 0 mol·L-1稀盐酸滴定20.00 mL 0.020 0 mol·L-1 NaY溶液,溶液中水的电离程度随所加稀盐酸的体积变化如图所示(忽略滴定过程中溶液的体积变化),则下列有关说法正确的是( ) 已知:Ka(HY)=5.0×10-11。 A.可选取酚酞作为滴定指示剂 B.M点溶液的pH>7 C.图中Q点水的电离程度最小,Kw<10-14 D.M点,c(Na+)=c(HY)+c(Y-)+c(Cl-) 答案:B 解析:A项滴定终点时溶液中溶质为NaCl、HY,溶液呈酸性,应选甲基橙为指示剂,错误;B项M点,c(MY)/c(HY)=1:1,由Ka(HY)=5.0×10-11查看更多