- 2021-08-24 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020版高中化学课时分层作业19原电池 人教版选修4
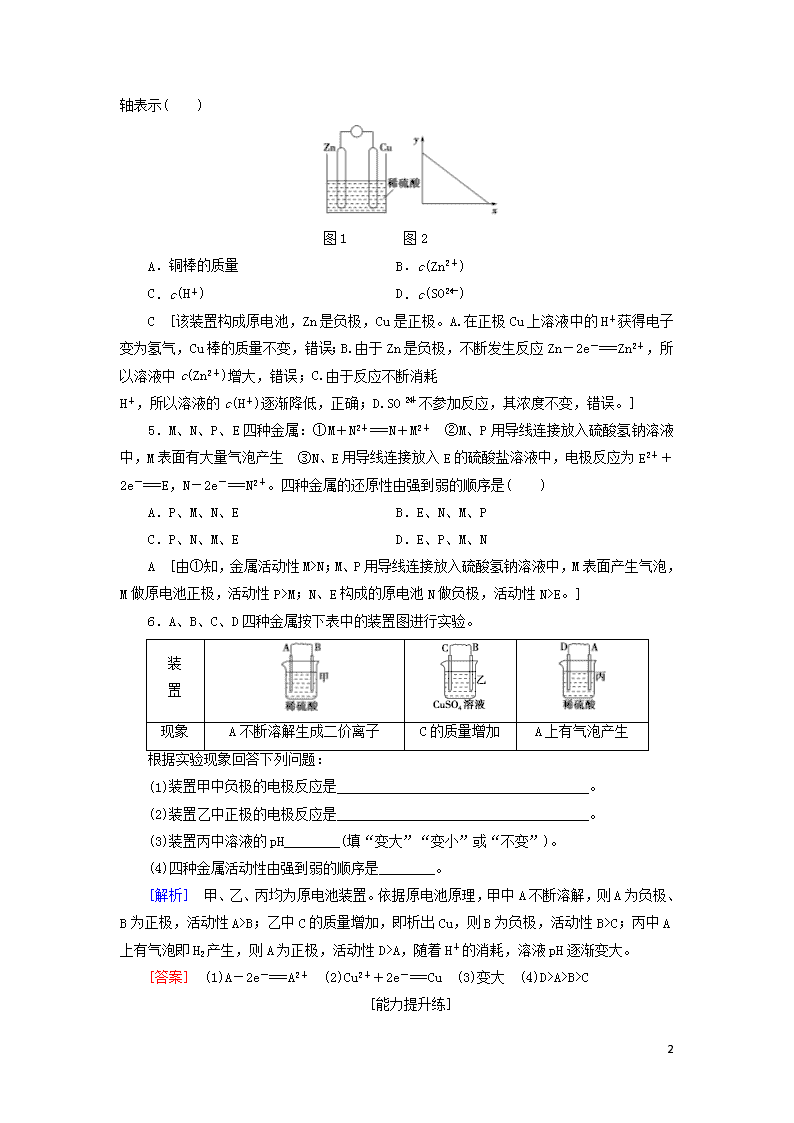
课时分层作业(十九) (建议用时:40分钟) [基础达标练] 1.下列关于原电池的叙述正确的是( ) A.构成原电池的正极和负极必须是两种不同的金属 B.原电池是将化学能转变为电能的装置 C.原电池中电子流出的一极是负极,该极被还原 D.原电池工作时,电流的方向是从负极到正极 B [A项,构成原电池的正极和负极可能是两种不同的金属,也可能是导电的非金属(如石墨棒)和金属,错误;B项,原电池是将化学能转变为电能的装置,正确;C项,在原电池中,负极上失去电子发生氧化反应,正极上得到电子发生还原反应,电子从负极沿导线流向正极,错误;D项,原电池放电时,电子从负极沿导线流向正极,电流的方向是从正极到负极,错误。] 2.可以将反应Zn+Br2===ZnBr2设计成原电池,下列4个电极反应: ①Br2+2e-===2Br- ②2Br--2e-===Br2 ③Zn-2e-===Zn2+ ④Zn2++2e-===Zn 其中分别表示放电时负极和正极反应的是( ) A.②和③ B.②和① C.③和① D.④和① C [放电时负极为Zn,失电子被氧化,正极为Br2,得电子被还原。 ] 3.如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是( ) A.外电路的电流方向为X→外电路→Y B.若两电极分别为Zn和碳棒,则X为碳棒,Y为Zn C.若两电极都是金属,则它们的活动性为X>Y D.X极上发生的是还原反应,Y极上发生的是氧化反应 C [由图可知,电子的流动方向是X→外电路→Y,则电流的方向就为Y→外电路→X;X为原电池的负极,Y为正极,X的活动性比Y的强;X极应发生氧化反应,Y极应发生还原反应。所以,A、B、D错误,C正确。] 4.图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y 4 轴表示( ) 图1 图2 A.铜棒的质量 B.c(Zn2+) C.c(H+) D.c(SO) C [该装置构成原电池,Zn是负极,Cu是正极。A.在正极Cu上溶液中的H+获得电子变为氢气,Cu棒的质量不变,错误;B.由于Zn是负极,不断发生反应Zn-2e-===Zn2+,所以溶液中c(Zn2+)增大,错误;C.由于反应不断消耗 H+,所以溶液的c(H+)逐渐降低,正确;D.SO不参加反应,其浓度不变,错误。] 5.M、N、P、E四种金属:①M+N2+===N+M2+ ②M、P用导线连接放入硫酸氢钠溶液中,M表面有大量气泡产生 ③N、E用导线连接放入E的硫酸盐溶液中,电极反应为E2++2e-===E,N-2e-===N2+。四种金属的还原性由强到弱的顺序是( ) A.P、M、N、E B.E、N、M、P C.P、N、M、E D.E、P、M、N A [由①知,金属活动性M>N;M、P用导线连接放入硫酸氢钠溶液中,M表面产生气泡,M做原电池正极,活动性P>M;N、E构成的原电池N做负极,活动性N>E。] 6.A、B、C、D四种金属按下表中的装置图进行实验。 装 置 现象 A不断溶解生成二价离子 C的质量增加 A上有气泡产生 根据实验现象回答下列问题: (1)装置甲中负极的电极反应是____________________________________。 (2)装置乙中正极的电极反应是____________________________________。 (3)装置丙中溶液的pH________(填“变大”“变小”或“不变”)。 (4)四种金属活动性由强到弱的顺序是________。 [解析] 甲、乙、丙均为原电池装置。依据原电池原理,甲中A不断溶解,则A为负极、B为正极,活动性A>B;乙中C的质量增加,即析出Cu,则B为负极,活动性B>C;丙中A上有气泡即H2产生,则A为正极,活动性D>A,随着H+的消耗,溶液pH逐渐变大。 [答案] (1)A-2e-===A2+ (2)Cu2++2e-===Cu (3)变大 (4)D>A>B>C [能力提升练] 4 7.将等质量的两份锌粒a、b分别加入过量的稀硫酸中,同时向a中加少许胆矾晶体,下列各图表示产生氢气的体积V(L)与时间t(min)的关系正确的是 ( ) A [向a中加入少许胆矾晶体,则有Zn+Cu2+===Cu+Zn2+,消耗一部分Zn,所以产生H2的量较少,但生成的Cu附于Zn上又组成铜锌原电池,加快反应速率,因此曲线a的斜率大于曲线b的斜率。] 8.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中不正确的是( ) A.由Al、Cu、稀硫酸组成原电池,其负极反应式为Al-3e-===Al3+ B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为Al-3e-+4OH-===AlO+2H2O C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为Cu-2e-===Cu2+ D.由Al、Cu、浓硝酸组成原电池,其负极反应式为Cu-2e-===Cu2+ C [Fe、Cu、FeCl3溶液组成的原电池的负极反应为Fe-2e-===Fe2+。] 9.原电池是化学对人类的一项重大贡献。 (1)某兴趣小组为研究原电池原理,设计如图所示装置。 ①a和b不连接时,烧杯中发生反应的离子方程式是___________________。 ②a和b用导线连接,Cu极为原电池________极(填“正”或“负”),Zn极发生________(填“氧化”或“还原”)反应。 ③a和b用导线连接,Zn片上发生的电极反应:_________________________ ____________,Cu片上发生的电极反应:______________________。 (2)若a和b相连接,导线上转移0.2 mol电子时,理论上Zn片质量减轻________g。 [解析] (1)①a和b不连接时,该装置不构成原电池,锌和氢离子发生置换反应,离子方程式为Zn+2H+===Zn2++H2↑;②a和b用导线连接,该装置构成原电池,铜作正极,正极上发生还原反应;锌作负极发生氧化反应;③a和b用导线连接,该装置构成原电池,铜作正极,发生还原反应,电极反应式为 2H++2e-===H2↑;锌作负极发生氧化反应,电极反应式为Zn-2e-===Zn2+。( 4 2)锌片减少的质量=×65 g·mol-1=6.5 g。 [答案] (1)①Zn+2H+===Zn2++H2↑ ②正 氧化 ③Zn-2e-===Zn2+ 2H++2e-===H2↑ (2)6.5 10.有人利用Fe、Cu作电极设计成原电池,以确定它们的活动性。试在下面的方框内画出原电池装置图,标出原电池的电极材料和电解质溶液,并写出电极反应式。 正极反应式:________________________________________________; 负极反应式:_______________________________________________。 [答案] 2H++2e-===H2↑ Fe-2e-===Fe2+ 4查看更多