广西钦州一中2021届高三8月月考理科综合化学试题 Word版含答案
7.诗词、成语是人们长期以来在书信或写作中出现的一种结构比较稳固的短语,它结构紧密,文字简练,是汉语言中的精品。下列的成语与物质的化学性质无关的是()
A.死灰复燃 B.水滴石穿 C.木已成舟 D.百炼成钢
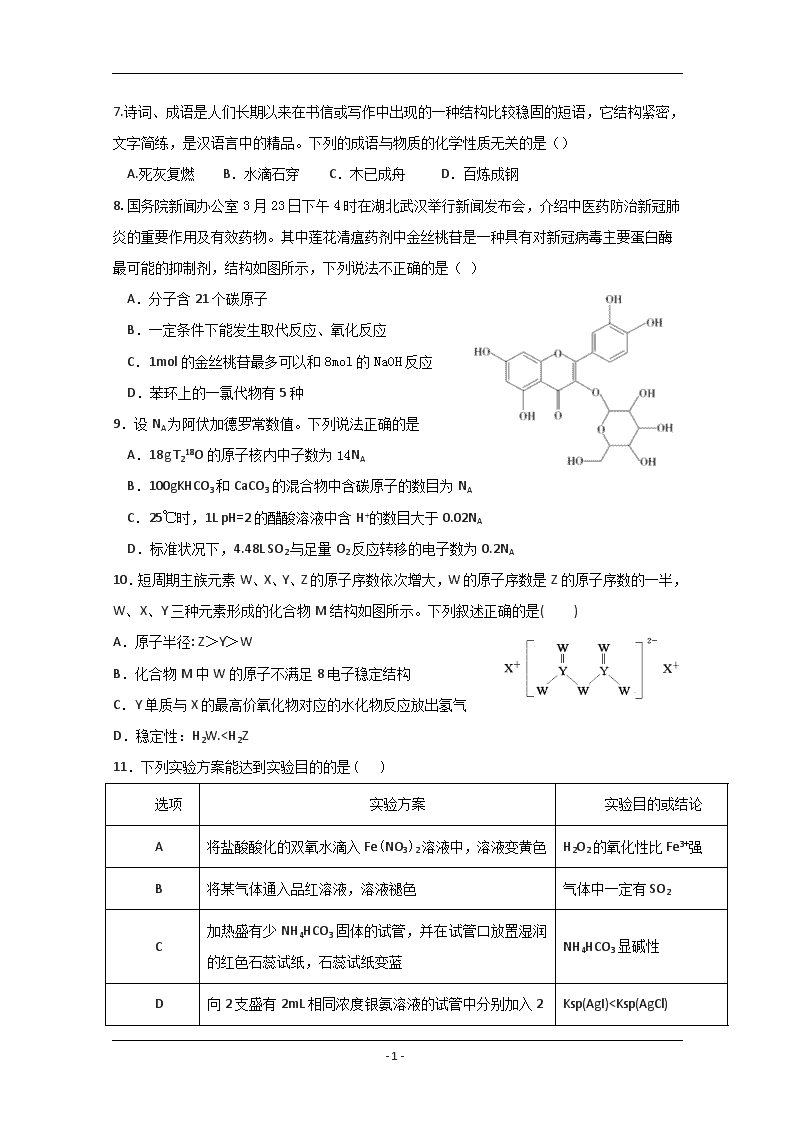
8.国务院新闻办公室3月23日下午4时在湖北武汉举行新闻发布会,介绍中医药防治新冠肺炎的重要作用及有效药物。其中莲花清瘟药剂中金丝桃苷是一种具有对新冠病毒主要蛋白酶最可能的抑制剂,结构如图所示,下列说法不正确的是( )
A.分子含21个碳原子
B.一定条件下能发生取代反应、氧化反应
C.1mol的金丝桃苷最多可以和8mol的NaOH反应
D.苯环上的一氯代物有5种
9.设NA为阿伏加德罗常数值。下列说法正确的是
A.18g T218O的原子核内中子数为14NA
B.100gKHCO3和CaCO3的混合物中含碳原子的数目为NA
C.25℃时,1L pH=2的醋酸溶液中含H+的数目大于0.02NA
D.标准状况下,4.48L SO2与足量O2反应转移的电子数为0.2NA
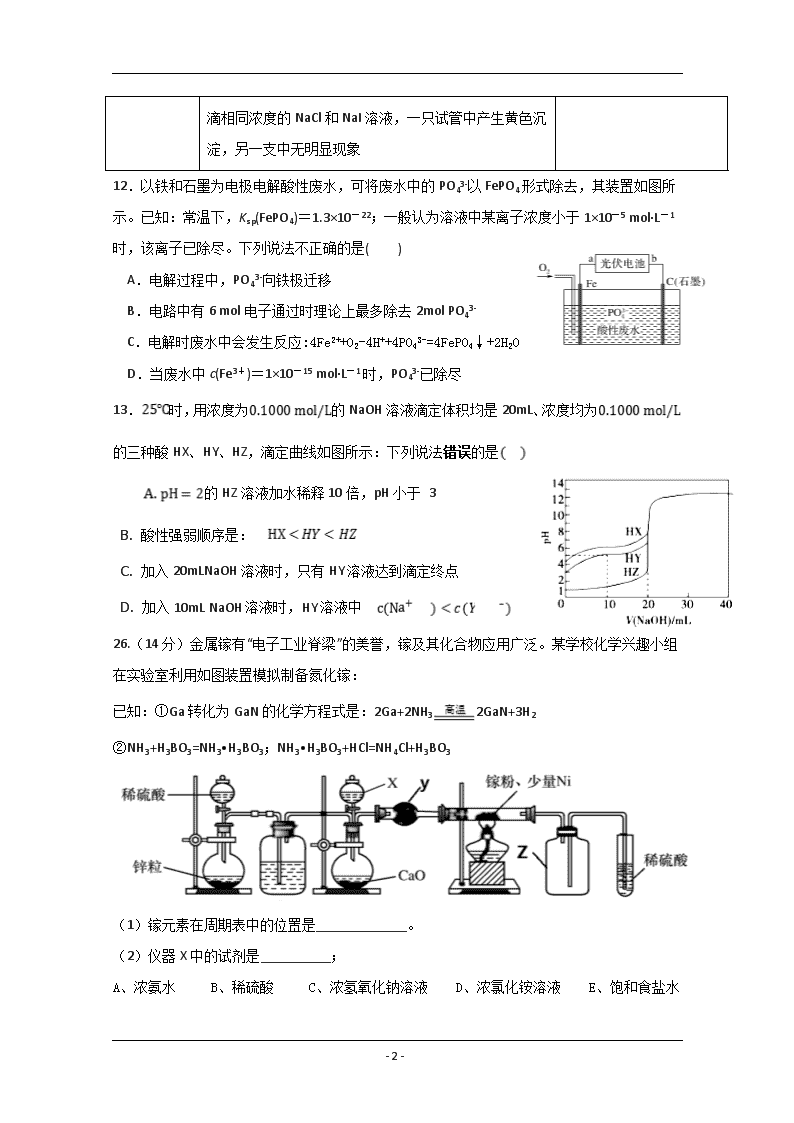
10.短周期主族元素W、X、Y、Z的原子序数依次增大,W的原子序数是Z的原子序数的一半,W、X、Y三种元素形成的化合物M结构如图所示。下列叙述正确的是( )
A.原子半径: Z>Y>W
B.化合物M中W的原子不满足8电子稳定结构
C.Y单质与X的最高价氧化物对应的水化物反应放出氢气
D.稳定性:H2W.
S>O,故Y>Z>W;B.由图可知,该化合物中O元素均满足8电子稳定结构;
C.X的最高价氧化物对应的水化物是NaOH,Si+2NaOH+H 2 O=Na 2 SiO 3+2H 2↑,故正确;
D.比较氢化物的稳定性,可比较其元素的非金属性,同一主族从上往下,非金属逐渐减弱,故非金属性O>S,稳定性H2O>H2S
11.D【解析】A. NO3-在酸性条件下具有强氧化性,可氧化Fe2+,故不能比较;B.Cl2等物质也能使品红溶液褪色;△
NH4HCO3=NH3↑+H2O+CO2↑,氨气可使湿润的红色石蕊试纸变蓝,不能说明NH4HCO3显碱性C.同类型,Ksp小的先沉淀,则由现象可知相同温度下,AgCl在水中的溶解度大于NaI的溶解度。
12. B【解析】利用Fe3+沉淀PO43-,铁为阳极,石墨为阴极,故a为正极,b为负极。在电解池中,阴离子向阳极迁移,即PO43-向铁极迁移,A项正确;铁极的电极反应式为Fe-2e-=Fe2+,O2氧化Fe2+生成Fe3+,废水中发生的总反应为4Fe2++02+4H++4P043-=4FePO4↓+2H2O,则电路中通过6mol电子时理论上最多除去3molPO43-,故B项错误,C项正确;当c(Fe3+)=1×10-15 mol·L
- 11 -
-1时,c(PO43-)=1.3×10-7mol·L-1<1×10-5 mol·L-,PO43-已除尽,D项正确。
13.C【解析】由图像开始时可以知道三种酸的pH,0.1000 mol·L-1HZ的pH=1,则HZ为强酸,故pH=2的HZ溶液加水稀释10倍,pH等于3 ,HX、HY为弱酸,且pH的大小为HX<HY,故酸性大小为HX<HY<HZ,A、B项正确;加入20mLNaOH溶液时,HX、HY、HZ溶液都完全中和,为中和点,滴定终点为指色剂变色点,中和点和滴定终点不是同一点,C项错误。
10mL、的NaOH溶液与20mL、的HY反应,只反应一半的HY,溶液显酸性,说明(H+)>(OH-),根据电荷守恒:c(H+)+c(Na+)=c(OH-)+c(Y-),可知 ,故D项正确。
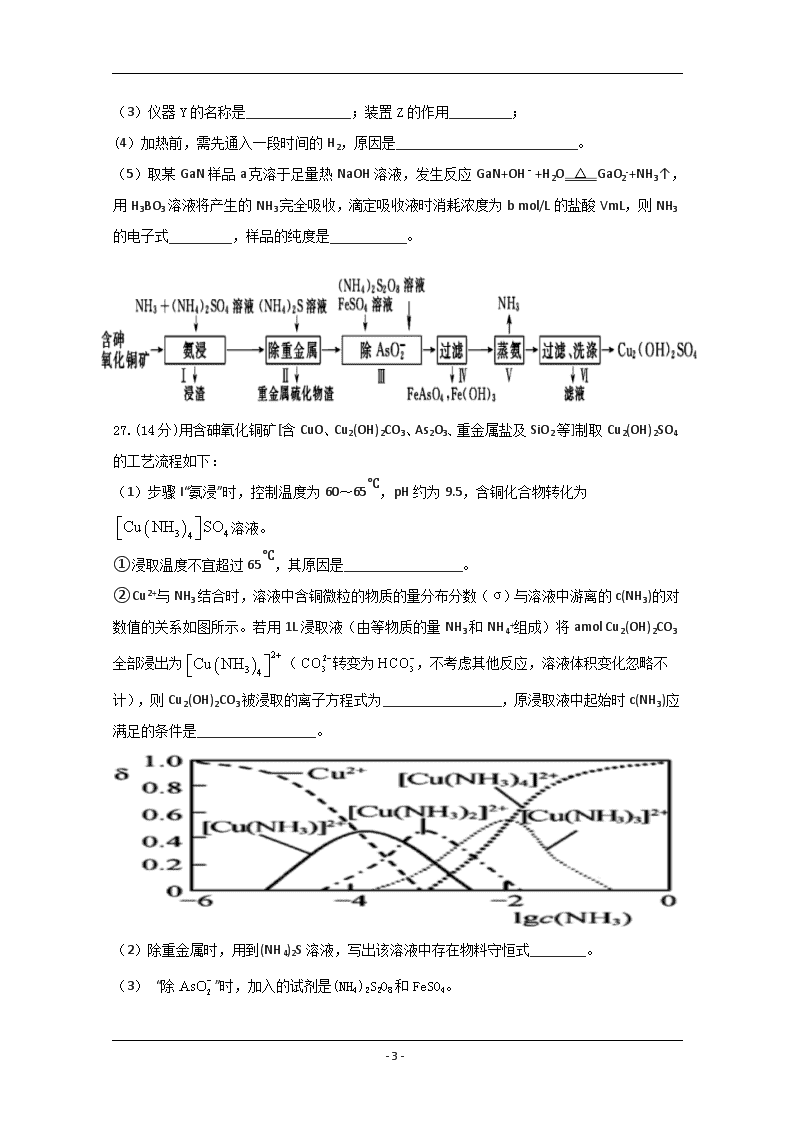
26.答案:(1)第四周期第IIIA族 (2)AD (3)球形干燥管 防倒吸
(4)排除装置中的空气,避免空气与镓反应产物不纯,防止氢气与氧气反应爆炸;
(5)
【解析】(1)Ga是32号元素,位于第四周期第IIIA族;(2)仪器X中的试剂是浓氨水,将浓氨水滴入盛有CaO的烧瓶中发生反应制取NH3;(3)装置Y为球形干燥管,装置Z作安全瓶,起到了防倒吸的作用;(4)空气中的氧气能与镓反应,且镓与氨气反应生成氢气能与空气中的氧气反应,发生爆炸,所以加热前需要通入一段时间的H2,排除装置中的空气,避免空气与镓反应,使产物不纯,防止氢气和氧气反应爆炸;(5)由题目所给方程式可知:GaN~NH3~NH3·H3BO3~HCl,由关系式可知n(GaN)=n(HCl)=cV·10-3mol,则样品的纯度为×100%=%
27.①温度过高,会加速NH3的挥发
②Cu(OH)2CO3 + 3NH4+ + 5NH3 = 2[Cu(NH3)4]2+ + HCO3- +2H2O;c(NH3)≥(5a+1)mol/L
(1) c(NH4+ )+ c(NH3· H2O) =2[c(S2-) + c(HS- ) + c(H2S )]
(2) 正六价;
(3) 2[Cu(NH3)4]SO4 + 2H2O Cu2(OH)2SO4↓ + 6NH3 ↑ +(NH4)2SO4
【解析】①浸取温度不宜超过65℃,其原因是温度过高,会加速NH3的挥发;
②a mol Cu(OH)2CO3全部浸出的反应为:Cu(OH)2CO3 + 3NH4+ + 5NH3 = 2[Cu(NH3)4]2+ + HCO3-+2H2O ,故参与反应的氨气为5a mol,浓度为5a mol/L,由图可知:全部浸出为[Cu(NH3)4]2+时lg(NH3)=0,则此时氨气浓度为1 mol/L,故原浸取液中起始时c(NH3)≥
- 11 -
(5a+1)mol/L。
(1) 由(NH4)2S的化学式可知元素原子个数比N:S = 2 : 1,且是弱酸弱碱盐,NH4+离子与S2-离子在溶液中会发生水解反应,NH4+ + H2O = NH3· H2O + OH-, S2- + H2O = HS- + H+ , HS- + H2O = H2S +H+,均为 1:1反应,即消耗一个NH4+,就产生一个 NH3· H2O,故物料守恒式为c(NH4+ )+ c(NH3· H2O) =2[c(S2-) + c(HS- ) + c(H2S )]。
(2) Na2S2O8中含有一个过氧根,故其中两个氧显负一价,其他六个氧显负二价,根据化合物价态和为0,可得过二硫酸钠中的硫显正六价;
(3) 根据流程,“蒸氨”时发生反应为[Cu(NH3)4]SO4分解Cu(OH)2SO4和氨气,故反应为:2[Cu(NH3)4]SO4 + 2H2O Cu2(OH)2SO4↓ + 6NH3 ↑ +(NH4)2SO4 。
28.答案Na(s)+Cl2(g)=NaCl(s) ΔH=-410.8 kJ/mol放热0.135 mol·L-1·min-1下移不能c(Na+)>c(SO)>c(OH-)>c(HSO)>c(H+)H2SO3+HCO=HSO+H2O+CO2↑先生成白色沉淀,后来变成砖红色
【解析】(1)已知:①NaCl的溶解热为3.8 kJ/mol(吸热),NaCl(s)=Na+(aq)+Cl-(aq) ΔH1=+3.8 kJ/mol,②Na(s)-e-=Na+(aq) ΔH2=-240 kJ/mol③Cl2(g)+e-=Cl-(aq) ΔH3=-167 kJ/mol,Na在氯气中燃烧的方程式为Na(s)+Cl2(g)=NaCl(s),该反应可由②+③-①得到,根据盖斯定律,该反应的焓变ΔH=ΔH2+ΔH3-ΔH1=-410.8 kJ/mol;(2)①随着温度升高,CO2平衡转化率降低,表明温度升高不利于反应正向进行,所以反应为放热反应;②温度为500 K时,CO2的平衡转化率为60%,CO2转化的浓度分别为Δc(CO2)==0.45 mol/L,根据化学计量数之比等于速率之比,可知H2转化的浓度Δc(H2)=3Δc(CO2)=1.35mol/L,所以其化学反应速率v(H2)===0.135 mol·L-1·min-1;③改充入2mol CO2和3molH2,相当于增加了CO2的比例,可使H2的转化率上升,自身转化率下降;所以图中的曲线会下移;(3)①因H2CO3为二元弱酸,第一步电离得到的HCO,第二步电离生成CO,所以根据NaClO和Na2CO3的pH值只能比较HClO和HCO的酸性强弱,不能比较HClO和H2CO3的酸性强弱;②0.1 mol/L Na2SO3溶液中,SO水解使溶液显碱性,溶液中存在SO+
- 11 -
H2O⇌HSO+OH-,HSO+H2O⇌H2SO3+OH-,H2O⇌H++OH-,综合考虑溶液中离子浓度大小顺序为:c(Na+)>c(SO)>c(OH-)>c(HSO)>c(H+);③根据电离常数及强酸制弱酸的原理分析,H2SO3的酸性比H2CO3的酸性强,因此H2SO3与NaHCO3溶液反应生成CO2,所以H2SO3与NaHCO3溶液发生的反应的离子方程式为:H2SO3+HCO=HSO+H2O+CO2↑;(5)开始形成AgCl时,需要的Ag+的浓度c(Ag+)==mol/L=1.5×10-9 mol/L,同理可得开始形成Ag2CrO4时,需要的Ag+的浓度c(Ag+)=mol/L≈4.5×10-6 mol/L,显然先生成沉淀AgCl,再生成沉淀Ag2CrO4,向Cl-和CrO浓度均为0.1 mol/L的混合溶液中逐滴加入AgNO3溶液至过量且不断搅拌,实验现象为:先生成白色沉淀,后来变成砖红色
35.H>B>Na (1分) sp2(1分) (2分) 范德华力、氢键(每个1分) (2分) (,,) (2分)
(2分) (3分)
【解析】(1)元素的非金属性越强,其电负性越大,故NaBH4涉及元素的电负性由大到小的顺序为H>B>Na;(2)已知硼氮苯分子在同一平面,且有相互平行的p轨道,则N、B原子均采取sp2杂化,B、N原子均有一个未杂化的p轨道,且这6个未杂化的p轨道互相平行,并垂直于分子所在平面,其中3个N原子未参与杂化的p轨道均有一对电子,这6个p电子在3个N原子和3个B原子间运动,形成“大π键”,故该“大π键”可表示为;(3)硼酸(H3BO3)分子间H、O原子之间可形成氢键,分子间存在范德华力,则硼酸晶体中存在的作用力有共价键、氢键和范德华力;(4)①由晶胞结构图可知,E原子的坐标参数为(,,);立方氮化硼的晶体结构类似于金刚石,故立方氮化硼晶体中N与B的原子半径之和为pm;
②以由12个原子构成的六棱柱为分析对象,其中N、B原子个数均为
- 11 -
,小六棱柱的底面为正六边形,底面面积为,故晶体密度的计算式为。
36. 3-苯基丙烯醛或者3-苯基-2-丙烯醛(2分) 加成反应(1分) 酯化反应(1分)
(2分)(3分)
(1分)、(1分)
(4分)
【解析】可以用逆推法推断,利用已知②,结合由G为甲苯的同分异构体,可以确定H 由G(C7H8)和F 反应生成;结合流程信息可知E为,D为,C为,B为,结合已知①,可以确定A为,据此解答。
- 11 -