高二化学教案:第6讲-物质结构(三)
辅导教案
学员姓名: 学科教师:
年 级: 辅导科目:
授课日期 ××年××月××日 时 间 A / B / C / D / E / F 段
主 题 物质结构-元素周期律
教学内容
【考纲】
主题 学习水平 学习内容
元素周期表
元素周期律 B (1)同主族元素性质递变规律
(2)短周期中同周期元素性质递变规律
元素周期表 C
(1)元素周期表的结构
(2)元素周期表与原子结构的关系
(3)元素周期表的应用
本次课的重点、难点,需要掌握的方法技巧
1.重点:元素周期表
2.难点:元素周期律及其运用
此环节设计时间在 15 分钟。
TR 可根据本次课的需要,选择不同的互动探究方式,例如:
1.小阶测,可以是 10 道与上节课相关的选择题,或 1-2 道填空、实验或计算题,然后由老师讲解学生交叉批
改)。
2. (较难)预习问题的讨论,学生讲解。
3. (简单)问题的抢答。
4. 生活中相关的应用实例,学生参与讨论说明。
5. 与本次内容相关的考题分析、趣味故事、猜谜、小游戏等。
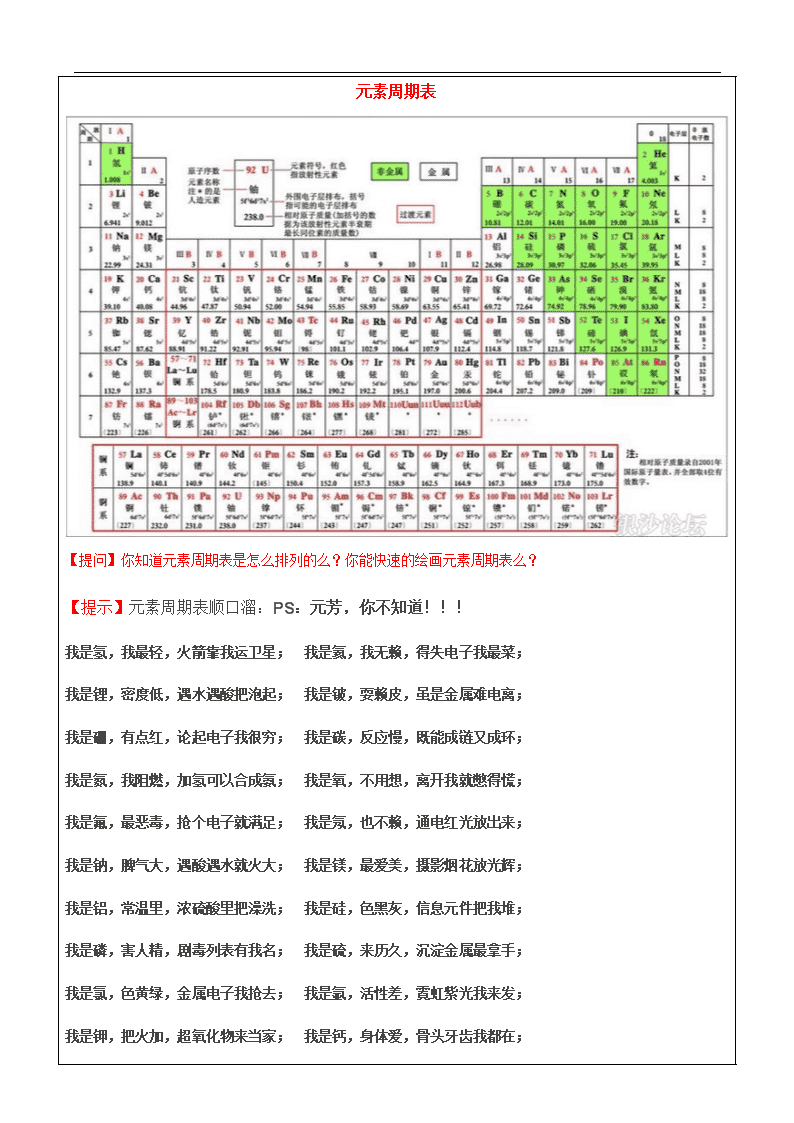
元素周期表
【提问】你知道元素周期表是怎么排列的么?你能快速的绘画元素周期表么?
【提示】元素周期表顺口溜:PS:元芳,你不知道!!!
我是氢,我最轻,火箭靠我运卫星; 我是氦,我无赖,得失电子我最菜;
我是锂,密度低,遇水遇酸把泡起; 我是铍,耍赖皮,虽是金属难电离;
我是硼,有点红,论起电子我很穷; 我是碳,反应慢,既能成链又成环;
我是氮,我阻燃,加氢可以合成氨; 我是氧,不用想,离开我就憋得慌;
我是氟,最恶毒,抢个电子就满足; 我是氖,也不赖,通电红光放出来;
我是钠,脾气大,遇酸遇水就火大; 我是镁,最爱美,摄影烟花放光辉;
我是铝,常温里,浓硫酸里把澡洗; 我是硅,色黑灰,信息元件把我堆;
我是磷,害人精,剧毒列表有我名; 我是硫,来历久,沉淀金属最拿手;
我是氯,色黄绿,金属电子我抢去; 我是氩,活性差,霓虹紫光我来发;
我是钾,把火加,超氧化物来当家; 我是钙,身体爱,骨头牙齿我都在;
我是钛,过渡来,航天飞机我来盖; 我是铬,正六铬,酒精过来变绿色;
我是锰,价态多,七氧化物爆炸猛; 我是铁,用途广,不锈钢喊我叫爷;
我是铜,色紫红,投入硝酸气棕红; 我是砷,颜色深,三价元素夺你魂;
我是溴,挥发臭,液态非金我来秀; 我是铷,碱金属,沾水烟花钾不如;
我是碘,升华烟,遇到淀粉蓝点点; 我是铯,金黄色,入水爆炸容器破;
我是钨,高温度,其他金属早呜呼; 我是金,很稳定,扔进王水影无形;
我是汞,有剧毒,液态金属我为独; 我是铀,浓缩后,造原子弹我最牛;
我是镓,易融化,沸点很高难蒸发; 我是铟,软如金,轻微放射宜小心;
我是铊,能脱发,投毒出名看清华; 我是锗,可晶格,红外窗口能当壳;
我是硒,补人体,口服液里有玄机; 我是铅,能储电,子弹头里也出现。
【习题检测】
1.下列关于元素周期律的叙述正确的是( )
A.随着元素原子序数的递增,原子最外层电子数总是从 1 到 8 重复出现
B.元素的性质随着原子序数的递增而呈周期性变化
C.随着元素原子序数的递增,元素的最高化合价从+1 到+7,最低化合价从-7 到-1 重复出现
D.元素性质的周期性变化是指原子核外电子排布的周期性变化、原子半径的周期性变化及元素主要化
合价的周期性变化
解析:K 层为最外层时,原子最外层电子数只能从 1 到 2,而不是从 1 到 8,A 项错误;最低化合价一般
是从-4 到-1,而不是从-7 到-1,C 项错误;D 项核外电子排布的周期性变化 是元素性质周期性变化的根
本原因,而不是内容。 答案:B
2.下列微粒半径的比较中,正确的是( )
A.r(Na+)>r(Na) B.r(Cl-)>r(Cl)
C.r (Ca2+)>r(Cl-) D.r(Mg)>r(Na)
解析:同一种元素:r 阳离子
Cl,则半径 r(Ca2+)Na,故半
径 r(Mg)X D.离子半径:Ym->Xn+
解析:xXn+和 bYm-的电子 层结构相同,说明原子序数 a>b,且 a-n=b+m 及 rXn+”“<”或“=”)。
(3)在两种元素形成的化合物中,标出它们的化合价________,并写出与水反应生成 O2 的化学方程式:
___________________________________________________________________________。
解析:OH-电子数为 10,故 A 原子核外电子数为 8,B 原子核外电子数为 11,即 A 为 O,B 为 Na;
O2-与 Na+具有相同电子层结构,则 r(O2-)>r(Na+)。Na 与 O 形成 Na2O 和 Na2O2 两种化合物,其中化合
价为 2,22。只有 Na2O2 与水反应生成 O2,方程式为 2Na2O2+2H2O===4NaOH+O2↑。
答案:(1)氧(或 O) 钠(或 Na) (2)>
(3) 2 22 2Na2O2+2H2O===4NaOH+O2↑
10.现有 A、B、C 三种元素,B 的原子序数大于 A,A 与 B 的质子数之和为 27,质子数之差为 5。
0.9 g 单质 C 与足量盐酸反应放出 1.12 L 标准状况下的氢气,且生成 C 的三氯化物。完成下列问题:
(1)A 是________,B 是________,C 是________。(填元素符号)
(2)3 种元素的原子半径由小到大的顺序是________。
解析:令三原子可表示为 aA、bB、cC,则由题意得方程组 a+b=27,
b-a=5,
解得 a=11,
b=16
即:A 为钠,B 为硫,由 C 与盐酸反应生成 CCl3 可知,1 mol C 可生成3
2 mol H2,由0.9 g
MC
×3
2
= 1.12 L
22.4 L·mol-1
得:M(C)=0.9 g×3×22.4 L·mol-1
2×1.12 L
=27 g·mol-1,且化合价为+3 价的是铝。
答案:(1)Na S Al (2)SMg>Al>Si>P>S>Cl.
2、同主族元素的原子半径随核电荷数的增大而增大。如:Li Na+>Mg2+>Al3+
5、同一元素不同价态的微粒半径,价态越高离子半径越小。如 Fe>Fe2+>Fe3+
①与水反应置换氢的难易
②最高价氧化物的水化物碱性强弱
金属性强弱 ③单质的还原性或离子的氧化性(电解中在阴极上得电子的先后)
④互相置换反应
依据: ⑤原电池反应中正负极
①与 H2 化合的难易及氢化物的稳定性
元素的 非金属性强弱 ②最高价氧化物的水化物酸性强弱
金属性或非金属 ③单质的氧化性或离子的还原性
编
排
依
据
具
体
表
现
形
式
七
主
七
副
零
和
八
三
长
三
短
一
不
全
性强弱的判断 ④互相置换反应
①、同周期元素的金属性,随荷电荷数的增加而减小,如:Na>Mg>Al;非金属性,随荷电荷数的增加
而增大,如:SiCl>Br>I。
③、金属活动性顺序表:K>Ca>Mg>Al>Zn>Fe>Sn>Pb>(H)>Cu>Hg>Ag>Pt>Au
2、要点归纳
(一)元素周期律
元素周期律:元素性质随着原子序数的递增而呈周期性的变化规律
1.元素的原子结构与元素周期表的关系
原子质子数=核电荷数=原子序数 核外电子层数=周期序数 最外层电子数=主族序数
2.元素性质的周期性变化规律
(1)原子半径
①同周期元素从左至右(稀有气体除外)随着原子序数的递增,原子半径逐渐 减小 。
如第三周期元素原子半径比较:Na>Mg>Al>Si>P>S>Cl(零族元素除外)
②同主族元素从上至下随着原子序数的递增原子半径逐渐 增大 。
同主族的离子半径随着原子序数的递增而依次增大
如 IA 族:Li+Na+;ClF->Na+>Mg2+>Al3+
(2)主要化合价
主族元素最高正价=主族序数=原子最外层电子数(0 和 F 除外)
最低负价绝对值或最低负价数值=8 一主族序数
除第 1 周期外,同周期从左到右,元素最高正价由碱金属+1 递增到+7,非金属元素负价由碳族-4 递增到
-1(氟无正价,氧无+6 价,除外)。
(3)金属性和非金属性
同周期内随原子序数的递增,元素的金属性逐渐 减弱 ,非金属性逐渐 增强 。所对应的简单阳
离子的氧化性逐渐 增强 ,简单阴离子的还原性 减弱 。
如:阳离子的氧化性:Na+Cl-
同主族内随原子序数的递增,元素的金属性逐渐 增强 ,非金属性逐渐 减弱 ,所对应的简单阳
离子的氧化性逐渐 减弱 ,简单阴离子的还原性 增强 。
如:阳离子的氧化性:Li+>Na+>K+>Rb+>Cs+ 阴离子的还原性:F-H2YO4>HXO4
B.非金属性:X>Y>Z
C.气态氢化物的稳定性按 X、Y、Z 顺序由弱到强
D.元素的负化合价的绝对值按 X、Y、Z 顺序由小到大
【解析】先将 X、Y、Z 视为自己熟知的 Cl、S、P,再根据元素的非金属性强弱的依据和主要化合价的周期
性变化规律进行判断。
答案:B.D
【归纳】如果题目给出的条件比较抽象,看似简单却容易出错时,可把抽象问题具体化。
【例 2】若短周期中的两种元素可以形成原子个数比为 2:3 的化合物,则这两种元素的原子序数之差不可能
是( )。
A.1 B.3 C.5 D.6
【解析】
解法一(具体法):
3 2
2 3X Y
中 X 可能是 5 13B Al ,Y 可能是 8O 、 16 S ,原子序数之差为 3、5、11;再考虑可变
价,化合物可能为 2 3N O ,原子序数之差为 1,则选项 D 不可能.
解法二(特征法):根据化合价规则,可知两种元素的化合价分别为奇数和偶数,它们的主族序数、原子序数也
必为奇数和偶数,而奇数和偶数之差只能为奇数,不能是偶数,故选项 D 不可能.
答案:D
【归纳】主族序数、原子序数与元素的最高正价数及负价数同为奇数或偶数——这是元素“位、构、性”关
系中的一大数值特征.抓住题目直接或间接提供的各种特征(还有位置特征、结构特征、性质特征等),进行大
跨度的推理,可以去表象、抓关键、快速求解.但要注意,若有多个可能的答案时,则还得用具体法“验根”。
【例 3】已知短周期元素的离子. 2
a A 、 b B 、 3
c C 、 d D 都具有相同的电子层结构,则下列叙述正确的是
( )
A.原子半径 A>B>D>C B.原子序数 d>c>b>a
C.离子半径 C>D>B>A D.单质的还原性 A>B>D>C
【解析】根据“同电子排布的离子,阴上阳下,序小径大”的规律,先确定这四种元素在周期表中的位置:
C Dc d
b aB A
;然后根据有关的“位、构、性”规律判断。
答案:C
【归纳】对于多种元素“位、构、性”的排序问题,先借助图示定位法确定这些元素在周期表中的相对位置,
然后根据有关规律排序,是一种“先见林、后见木”的直观解题策略.
【例 4】1999 年 1 月,俄美科学家联合小组宣布合成出 114 号元素的一种同位素,该同位素原子的质量数为
298.以下叙述不正确的是( )
A.该元素属于第七周期
B.该元素为金属元素,性质与 82 Pb 相似
C.该元素位于ⅢA 族
D.该同位素原子含有 114 个电子,184 个中子
【解析】先由原子序数确定 114 号元素在周期表中的位置:114 一(86+14)一 14(列),处于第 7 周期、ⅣA 族,
在铅的下方;然后判断其性质与同主族的 82 Pb 相似.
答案:C
【归纳】由原子序数确定元素位置的方法是:记住稀有气体元素的原子序数:2、10、18、36、54、86.用原
子序数减去比它小而相近的稀有气体元素原子序数(第 7 周期再减 14 种锕系元素),即得该元素所在的列数.第
l、2 列为 IA.ⅡA 族;第 3~7 列为ⅢB~ⅦB 族;第 8~10 列为第Ⅷ族;第 11、12 列为 IB.ⅡB 族;第 13~
17 列为ⅢA~ⅦA 族;第 18 列为零族.对于主族元素,列数的个位数即为主族序数.这种元素的周期数比相
近的原子序数小的稀有气体元素的周期数大 1.
2.有关未知元素“位、构、性”的综合推断
【例 5】 W、X、Y、Z 四种短周期元素的原子序数 X>W>Z>Y.W 原子的最外层没有 p 电子,X 原子核外 s
电子与 p 电子数之比为 1:1,Y 原子最外层 s 电子与 p 电子数之比为 l:1,Z 原子核外电子中 p 电子数比 Y
原子多 2 个.
(1)X 元素的单质与 Z、Y 所形成的化合物反应,其化学方程式:
(2)W、X 元素的最高价氧化物对应水化物的碱性强弱为______<_______(用分子式表示).
这四种元素原子半径的大小为______>______>______>______ (填元素符号)
【解析】首先要将未知元素全部推断出来.根据“X 原子核外 s 电子与 p 电子数之比为 1:l”,推断:X 可能
是 O(1s22s22p4。)或 Mg(1s22s22p63s2);根据“Y 原子最外层 s 电子与 p 电子数之比为 l:1”(即最外层电子排
布为 ns2np2),推断:Y 可能是ⅣA 族的短周期元素 C 或 Si;根据“Z 原子核外电子中 p 电子数比 Y 原子多 2
个”(即最外层电子排布为 ns2np2+2),推断:Z 可能ⅥA 族的短周期元素 O 或 S;根据“原子序数 X>W>Z>Y”,
推断:X 只能是 Mg;根据“W 原子的最外层没有 p 电子”,且原子序数小于 Mg,W 为 Na,Z 为 O,Y 为 C.然
后借助图示定位法(如右图)推断有关的性质. 原子半径 C O
Na Mg
答案:(1)2Mg+CO2 点燃 2MgO+C (2)Mg(OH)2Mg>C>O
【归纳】推断未知元素应根据元素的“位、构、性”特征,在平时学习时,应注意这方面的小结与积累。
3.证明元素性质的实验设计
【例 6】设计一个实验证明铍元素的氢氧化物(难溶于水)是两性氢氧化物,并写出有关的化学方程式。
【解析】根据两性氢氧化物既能跟酸反应,又能跟碱反应生成盐和水的特性设计实验。
答案:取氢氧化铍样品少量,分盛在两支试管中,然后分别加入适量稀硫酸和 NaOH 溶液,如果氢氧化铍都
溶解了,就能证明氢氧化铍是两性氢氧化物.化学方程式为:
Be(OH)2+H2SO4→BeSO4+2H2O;Be(OH)2+2NaOH→Na2BeO,+2H2O.
4.有关元素周期表应用的信息迁移
【例 7】致冷剂是一种易被压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到
致冷目的.人们曾采用过乙醚、NH4、CH3Cl 等作致冷剂,但它们不是有毒,就是易燃、于是科学家根据元素
性质的递变规律来开发新的致冷剂.
据现有知识,某些元素化合物的易燃性、毒性变化趋势如下:
(1)氢化物的易燃性:第二周期______>______>H20、HF;第三周期 SiH4>PH3
(2)化合物的毒性:PH3>NH3;H2S: H2O;CS CO2;CCl4>CF4(选填>或< =).
于是科学家们开始把注意力集中在含 F、C1 的化合物上.
(3)已知 CCl4 的沸点为 76.8℃,CF4 的沸点为一 128℃’,新致冷剂的沸点范围应介于其间.经过较长时间反
复试验,一种新的致冷剂氟里昂 CF2Cl2 终于诞生了,其它类似的还可以是 .
(4)然而,这种致冷剂造成了当今的某一环境问题是________.但求助于周期表中元素及其化合物的________
变化趋势来开发致冷剂的科学思维方法是值得借鉴的.
①毒性 ②沸点 ③易燃性 ④水溶性 ⑤颜色
(a)①②③ (b)②④⑤ (c)②③④
【解析】
(1)根据题给第三周期氢化物易燃性顺序:SiH4>PH3 的信息,推出同周期元素的氢化物易燃性随原子序数的递
增而减弱的规律;
(2)根据题给化合物的毒性:PH3>NH4、CCl4>CF4 的信息,推出“相同类型的化合物,相对分子质量越大,其
毒性也越大”的规律;
(3)根据题给新致冷剂的沸点范围,推出新致冷剂的元素组成是 C.F、Cl,式量在 154 与 88 之间的经验规律;
然后分别应用自己推出的规律解答有关问题.
答案:(1)CH4>NH3,H2S>HCl;(2)>,>;(3)CFCl3(或 CF3C1);(4)使大气臭氧层出现空洞;a.
【归纳】如果本题增设一问:最新研究发现氟里昂中的氯原子能催化臭氧转化为氧气,试推出一种不含氯原
子的新致冷剂(写出分子式)_______.则可根据新致冷剂的类似元素组成和式量范围,全部用 F 替代 Cl,推出
全氟致冷剂 C2F6(式量为 138).这种推断要求更进一步的创新思维.
此环节教案预期时间 20(练题)+15(互动讲解)分钟。
本单元综合检测,教案在提供基本练习题(简单+中档)之外,设置“附加题”环节,为本次知识的加深题型,
供 TR 根据情况选择使用。通过竞赛的互动方式进行,并给予学生相应的鼓励与表扬。
【教学建议】限时完成基础练习,最后一个完成的或者错误率最高的,将要受到惩罚。惩罚措施由该部分学
习最好的学员制定,如真心话、大冒险、15 个深蹲或者俯卧撑。。。
基础训练
1、下列关于物质性质的比较,正确的是 ( )D
A.相同温度下,水中的溶解度:NaHCO3>Na2CO3
B.熔点:铯>钾>钠>钠和钾的合金
C.熔沸点:HI>HBr>HCl>HF
D.热稳定性:HF>HCl>HBr>HI
2、下列各组顺序的排列不正确的是 ( )D
A.离子半径:F->Mg2+>Al3+ B.热稳定性:HCl>H2S>AsH3
C.酸性:H3AlO3异戊烷>新戊烷
D.稳定性:H2S>H2O>PH3
4、以下性质的比较中,错误的是( )B
A. 热稳定性:H2S>PH3 B. 密度: 1-氯己烷>1-氯戊烷
C. 酸性 H2CO3>H2SiO3 D.原子半径:Na>Cl
5、短周期元素 X、Y、Z 的原子序数依次递增,其原子的最外层电子数之和为 13。X 与 Y、Z 位于相邻周期,
Z 原子最外层电子数是 X 原子内层电子数的 3 倍或者是 Y 原子最外层电子数的 3 倍。下列说法正确的是 ( )
B
A.X 的氢化物溶于水显酸性
B.Y 的氧化物是离子化合物
C.Z 的氢化物的水溶液在空气中存放不易变质
D.X 和 Z 的最高价氧化物对应的水化物都是弱酸
6、已知短周期元素的离子,aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )BC
A.原子半径 A>B>D>C B.原子序数 a>b>d>c
C.离子半径 C>D>B>A D.单质的还原性 A>B>D>C
7、下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
请你根据表中所给元素,回答下列问题
⑴ L 层上未成对电子数最多的元素是 (填元素符号),原子核外有 5 种不同能量的电子且最外层上 p
电子数比 s 电子数多 2 个的元素是 (填元素符号)
(2)h 和 g 的最高价氧化物比较,熔点高的是 (填写氧化物化学式),其理由
是 ;j 和 k 的氢化物比较,沸点高的是 (填写氢化物
化学式),其理由是
(3)以上元素两两形成的中学中常见的化合物中既有离子键,又有非极性共价键的有
(写一种)(填写化学式)
(4)B.i、l 三元素形成的离子化合物的电子式为
答案:(1)N,S
(2)SiO2,SiO2 是原子晶体,而 CO2 是分子晶体; H2O,水分子间作用力大于 H2S 分子间作用力;
(3)Na2O2 (或 FeS2;Na2SX 等等,填写任意一个正确的即可);
(4)
8、五种短周期元素的性质或原子结构信息如下表:
元素 元素性质或原子结构信息
Q 原子核外有 6 种不同运动状态的电子
R 最外层电子数是次外层电子数的 3 倍
X 气态氢化物的水溶液呈弱碱性
Y 第三周期元素的简单离子中离子半径最小
Z 单质为银白色固体,在空气中燃烧发出黄色火焰
请根据表中信息回答下列问题:
(1)Q 原子的电子排布式为___________________________,其同位素有 。
(2)R 与 Z 组成的化合物的化学式是 。
(3)X 气态氢化物分子的空间构型为 。X 的最高价氧化物对应的水化物其浓溶液与同类物
质相比在化学性质上表现的特殊性有 。
(4)Y 单质与 V2O5 反应的化学方程式为 。
(5)在 1.01×105PA.298K 时,1.4gQR 气体在 1.6gR2 气体中完全燃烧,生成 QR2 气体时放出 14.15kJ 热量,
表示 QR 燃烧的热化学方程式为 。
答案:(1)1s22s22p2 12C.13C.14C
(2)Na2O、Na2O2
(3)三角锥形 不稳定性和强氧化性
(4)10Al+3V2O5 高温 5Al2O3 +6V
(5)2CO(g)+O2(g)→2CO2(g)+566KJ
五、拓展训练
1、X、Y、Z 三种非金属,原子最外层电子数相等。等物质的量的单质 X2、Y2、Z2 分别与足量钠反应时放热,
反应热分别为 Q1、Q2、Q3,且 Q1>Q2>Q3,下列判断一定正确的是 ( ) BD
A.气态氢化物的沸点 HX>HY>HZ
B.最高价氧化物的水化物酸性 HXO4>HYO4>HZO4
C.气态氢化物的稳定住 HXMg2。“>Al3+>F-
B.热稳定性:HCl>H2S>PH3>AsH3。
C.酸性强弱:H3A1O3NaOH>Mg(OH)2>Al(OH)3
3.某元素原子最外层只有 1 个电子,下列事实能证明其金属性比钾强的是( ).
A.其单质跟冷水反应,发生剧烈爆炸 B.其原子半径比钾原子半径大
c.其单质的熔点比钾的熔点低 D.其氢氧化物能使氢氧化铝溶解
4.短周期元素 X 和 Y 可形成原子个数比为 2:3 的化合物,且 X 呈最高价态,Y 的原子序数为 n,则 X 的原
子序数不可能是( ).
A.n+5 B.n+3 C.n - 3 D.n - 11
5.原子序数为 z 的元素 E 与周期表中 A.B.C.D 四种元素上下左右紧密相邻,则 A.B.C.D 四种元素
的原子序数之和不可能的是(镧系、锕系、零族元素除外)( ).
A.4z B.4z+6 C.4z+lO D.4z+14
6.X 和 Y 属短周期元素,X 原子的最外层电子数是次外层电子数的一半,Y 位于 X 的前一周期,且最外层
只有一个电子,则 X 和 Y 形成的化合物的化学式可表示为( ).
A.XY B.XY2 C.XY3 D.X2Y3
7.国际无机化学命名委员会在 1988 年作出决定:把长式周期表原有的主、副族及族号取消,由左至右按原
顺序改为 18 列.按这个规定,下列说法中正确的是( ).
A.第 3 列元素种类最多,第 14 列元素形成的化合物种类最多
B.第 8、9、10 三列元素中没有非金属元素
C.从上到下第 17 列元素的单质熔点逐渐降低
D.只有第 2 列元素的原子最外层有 2 个电子
8.有人认为在元素周期表中,位于 I A 族的氢元素,也可以放在ⅦA 族,下列物质能支持这种观点的是( ).
A.HF B.H3O+ C.NaH D.H2O2
9.已知 X、Y、Z、T 四种非金属元素,X、Y 在反应时各结合一个电子形成稳定结构所放出的能量是 Y>X;
氢化物稳定性是 HX>HT;原子序数 T>Z,其稳定结构的离子核外电子数相等,而其离子半径是 Z>T.四
种元素的非金属性从强到弱排列顺序正确的是( ).
A.X、Y、Z、T B.Y、X、Z、T C.X、Y、T、Z D.Y、X、T、Z
10.我国最早报道的超高温导体中,铊是重要组成之一.已知铊是ⅢA 族元素,关于铊的性质判断值得怀疑
的是( ).
A.铊既能与强酸反应又能与强碱反应
B.能生成+3 价的化合物
C.Tl(OH)3 的碱性比 Al(OH)3 强
D.Tl(OH)3 与 Al(OH)3 一样是两性氢氧化物
11.元素周期表中前七周期的元素种类数如下:
周期数 一 二 三 四 五 六 七
所含元素种类数 2 8 8 18 18 32 32
请预言第八周期最多可能含有的元素种类数为( ).
A.18 B.50 C.32 D.64
12.有 X、Y、Z、W 四种短周期元素,原子序数依次增大,其质子数总和为 32,价电子数总和为 18,其中
X 与 Z 可按原子个数比为 l:1 或 2:1 形成通常为液态的化合物,Y、Z、W 在周期表中三角相邻,Y、Z
同周期,Z、W 同主族.
(1)写出元素符号:X 、Y 、Z 、W .
(2)这四种元素组成的一种化合物的化学式是 .
13.A.B.C.D 是短周期元素,A 元素的最高价氧化物的水化物与它的气态氢化物反应得到离子化合物,1
mol 该化合物含有 42 mol 电子,B 原子的最外层电子排布式为 nsnnp2n.C.D 两原子的最外层电子数分别
是内层电子数的一半.C 元素是植物生长的营养元素之一.试写出:
(1)A.B 元素形成的酸酐的化学式
(2)D 元素的单质与水反应的化学方程式 ;
(3)A.C 元素气态氢化物的稳定性大小 < (用分子式表示).
14.在周期表中,有些主族元素的化学性质和它左上方或右下方的另一主族元素相似,如锂与镁都能与氮气
反应、铍与铝的氢氧化物均有两性等,这称为对角线规则.请回答:
(1)下列关于锂及其化合物性质的叙述中正确的是( ).
A.Li 跟过量 O2 反应生成 Li2O: B.LiOH 加热时,不会分解
C.Li 遇浓 H2SO4 不发生钝化 D.Li2CO3 加热时,分解成 Li2O 和 CO2
(2)锂在空气中燃烧,除生成 外,也生成微量的 .
(3)铍的最高价氧化物的水化物的化学式是 ,具有 性,证明这一结论的离子方程式
是 .
(3)若已知 Be2C+4H2O→2Be(OH)2+CH4↑,则 Al4C3 与过量强碱溶液反应的离子方程式
为 .
15.下表是元素周期表的一部分
族
周期
ⅠA ⅡA ⅢA ⅣA V A ⅥA ⅦA
2 ① ② ⑨ ③
3 ④ ⑤ ⑥ ⑦ ⑧
(1)表中元素⑧的最高价氧化物对应的水化物的化学式为 ,它的 性(填“酸”或“碱”)比元素
⑦的最高元素氧化物对应的水化物的 (填“强”或“弱”).
(2)位于第二周期的某元素的原子核外 p 电子数比 s 电子数多 1 个,该元素是表中的 (填编号),该元
素与元素⑤形成的化合物的电子式是 ,其中的化学键是 键;该元素与元素⑨形成的化合
物中,元素⑨显 价.
(3)设计一个简单实验证明元素⑦与⑧的非金属性的相对强弱,并写出有关的离子方程式.
答案:
1.C 2.A 3.A 4.B[提示:采用具体法.] 5.B[提示:围绕 E 图示定位.]
6.A[提示:综合应用电子排布的特征法和 X、Y 的图示定位法及选项筛选法,判断 X 与 Y 形成 LiH.]
7.A.B 8.C 9.D 10.A.D 11.B[提示:公差为 4.]
12.(1)H、N、O、S; (2) (NH4)2SO4、(NH4)2SO3、NH4HSO4、NHSO3 等均可.[提示:三角相邻的元素有多
种排列方式,可通过平均质子数和平均价电子数来速推.]
13.(1)N2O3 或 N2O5 (2)2Li + 2H2O→2LiOH+H2↑ (3)PH3Q
解析:选 B、D 表中所示的元素 R 为 F,X 为 S,T 为 Cl,Z 为 Ar,Q
为 Br。非金属性:Cl>S,A 错误;F、Br 原子的核外电子数分别为 9、35,相
差 26,B 正确;元素周期表中,同主族元素从上到下,非金属性逐渐减弱,对
应气态氢化物的稳定性逐渐减弱,最高价氧化物的水化物的酸性逐渐减弱,故
HF、HCl、HBr 的稳定性逐渐减弱,C 错误;HClO4 的酸性强于 HBrO4 的酸性,D 正确。
2.(2013·福建高考)四种短周期元素在周期表中的位置如图,其中只有 M 为金属元素。下列说法不正确
的是( )
A.原子半径 ZSi>N>O,
A 正确;因为 N 的非金属性比 Si 强,所以 HNO3 的酸性比 H2SiO3 强,B 错误;因为 O 的非金属性比 Si 强,
所以气态氢化物的热稳定性 H2O>SiH4,C 正确;O 元素位于周期表的第二周期第ⅥA 族,D 正确。
3.(2011·江苏高考)短周期元素 X、Y、Z、W、Q 在元素周期表中的相对位置如图所示。下列说法正确
的是( )
X Y
Z W Q
A.元素 X 与元素 Z 的最高正化合价之和的数值等于 8
B.原子半径的大小顺序为:rX>rY>rZ>rW>rQ
C.离子 Y2-和 Z3+的核外电子数和电子层数都不相同
D.元素 W 的最高价氧化物对应的水化物的酸性比 Q 的强
解析:选 A 根据表格,可以推出 X 为 N 元素,Y 为 O 元素,Z 为 Al 元素,W 为 S 元素,Q 为 Cl 元素。
A 项,N 的最高正价为+5,Al 的最高正价为+3,其和的数值为 8,正确;B 项,原子半径应为 rZ>rW>rQ>rX>rY,
错误;C 项,O2-与 Al3+的核外电子数和电子层数均相同,错误;D 项,元素 S 的最高价氧化物对应水化物的
酸性小于 Cl 的最高价氧化物对应水化物的酸性,错误。
4.(2013·天津高考)下列有关元素的性质及其递变规律正确的是( )
A.第ⅠA 族与第ⅦA 族元素间可形成共价化合物或离子化合物
B.第二周期元素从左到右,最高正价从+1 递增到+7
C.同主族元素的简单阴离子还原性越强,水解程度越大
D.同周期金属元素的化合价越高,其原子失电子能力越强
解析:选 A 第ⅠA 族和第ⅦA 族元素如:H、Na 与 Cl 可形成 HCl 和 NaCl,两者分别属于共价化合物
和离子化合物,A 正确;第二周期 F 元素无正价,B 错误;如第ⅦA 族的元素中,还原性 F-I-,C 错误;同周期金属元素从左到右化合价升高,其还原性减弱,原子失电子能力减弱,D 错误。
5.(2013·重庆高考)下列排序正确的是( )
A.酸性:H2CO3<C6H5OH<CH3COOH
B.碱性:Ba(OH)2<Ca(OH)2<KOH
C.熔点:MgBr2<SiCl4<BN
D.沸点:PH3<NH3<H2O
解析:选 D A 项,由化学方程式 CO2+C6H5ONa+H2O===C6H5OH+NaHCO3 可知,酸性:H2CO3>C6H5OH;
B 项,Ba 和 Ca 同主族,元素金属性 Ba>Ca,故碱性 Ba(OH)2>Ca(OH)2;C 项,SiCl4 为分子晶体,MgBr2 为
离子晶体,BN 为原子晶体,故 SiCl4 的熔点最低;D 项,因为 NH3 分子间存在氢键使其沸点高于 PH3,H2O
分子间的氢键强于 NH3,使 H2O 的沸点更高(或根据 H2O 常温下为液态,而 NH3 为气态判断)。
6.(2012·北京高考)已知 33As、35Br 位于同一周期。下列关系正确的是( )
A.原子半径:As>Cl>P
B.热稳定性:HCl>AsH3>HBr
C.还原性:As3->S2->Cl-
D.酸性:H3AsO4>H2SO4>H3PO4
解析:选 C 同一周期中原子半径从左到右依次减小,A 项中 P 的半径大于 Cl,A 错误;非金属性越强,
其气态氢化物越稳定,其最高价氧化物对应水化物酸性越强,故 B 项中热稳定性:HCl>HBr>AsH3,D 项中酸
性 H2SO4>H3PO4>H3AsO4,B、D 均错误;C 项,单质氧化性:Cl2>S>As,故阴离子的还原性:As3->S2->Cl-,
C 正确。
7.(2011·福建高考)依据元素周期表及元素周期律,下列推断正确的是( )
A.H3BO3 的酸性比 H2CO3 的强
B.Mg(OH)2 的碱性比 Be(OH)2 的强
C.HCl、HBr、HI 的热稳定性依次增强
D.若 M+和 R2-的核外电子层结构相同,则原子序数:R>M
解析:选 B 本题考查元素周期表与元素周期律知识及考生运用元素周期律判断元素及其化合物性质的
能力。B、C 同周期,B 在 C 左边,故硼酸酸性弱于碳酸,A 错误;Mg、Be 同主族,镁在下方,Mg(OH)2 的
碱性强些,B 正确;同主族元素从上到下,其氢化物的热稳定性依次减弱,C 错误;阴阳离子电子层结构相同
时,阴离子对应的元素在阳离子对应元素的上一周期,原子序数小些,D 错误。
8.(2013·山东高考)W、X、Y、Z 四种短周期元素在元素周期表中的相对位置如图所示,W 的气态氢化
物可与其最高价含氧酸反应生成离子化合物,由此可知( )
A.X、Y、Z 中最简单氢化物稳定性最弱的是 Y
B.Z 元素氧化物对应水化物的酸性一定强于 Y
C.X 元素形成的单核阴离子还原性大于 Y
D.Z 元素单质在化学反应中只表现氧化性
解析:选 A 由题意可知,W 是 N 元素,X 是 O 元素,Y 是 S 元素,Z 是 Cl 元
素。H2S 的稳定性小于 H2O 的稳定性,也小于 HCl 的稳定性,A 正确;HClO 的 酸性弱
于 H2SO4 的酸性,B 错误;S2-的还原性大于 O2-的,C 错误;Cl2 和 H2O 反应时,Cl2 既是氧化剂,又是还原
剂,D 错误。
9.(2013·浙江高考)短周期元素 X、Y、Z、W、Q 在元素周期表中的位置如表所示,其中 X 元素的原子
内层电子数是最外层电子数的一半,则下列说法中正确的是( )
X Y
Z W Q
A.钠与 W 可能形成 Na2W2 化合物
B.由 Z 与 Y 组成的物质在熔融时能导电
C.W 得电子能力比 Q 强
D.X 有多种同素异形体,而 Y 不存在同素异形体
解析:选 A 根据题意可知,X、Y、Z、W、Q 分别为 C、O、Si、S、Cl。A 项,Na 与 S 可形成 Na2S2;
B 项,SiO2 在熔融时不能产生自由移动的离子,故不能导电;C 项,S 得电子能力比 Cl 弱;D 项,氧元素也
存在同素异形体。
10.(2013·江苏高考)短周期元素 X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为 13。X
的原子半径比 Y 的小,X 与 W 同主族,Z 是地壳中含量最高的元素。下列说法正确的是( )
A.原子半径的大小顺序:r(Y)>r(Z)>r(W)
B.元素 Z、W 的简单离子的电子层结构不同
C.元素 Y 的简单气态氢化物的热稳定性比 Z 的强
D.只含 X、Y、Z 三种元素的化合物,可能是离子化合物,也可能是共价化合物
解析:选 D 根据题意可推断出 X、Y、Z、W 四种元素依次是 H、N、O、Na。原子半径 r(Na)>r(N)>
r(O),A 错误;O2-和 Na+的电子层结构相同,B 错误;由于 O 的非金属性强于 N,所以 H2O 的热稳定性强于
NH3,C 错误;只含 H、N、O 三种元素的化合物可能是共价化合物 HNO3,也可能是离子化合物 NH4NO3,D
正确。
11.(2012·福建高考)短周期元素 R、T、Q、W 在元素周期表中的相对位置如图所示,其中 T 所处的周期
序数与族序数相等。下列判断不正确的是( )
A.最简单气态氢化物的热稳定性:R>Q
B.最高价氧化物对应水化物的酸性:Q<W
C.原子半径:T>Q>R
D.含 T 的盐溶液一定显酸性
解析:选 D 由图和 R、T、Q、W 是短周期元素推知:R 在第二周期,T、Q、W 在第三周期,故 T 在
第ⅢA 族为 Al 元素,Q 为 Si 元素,W 为 S 元素,R 为 N 元素。A 项,非金属性 N>Si,故热稳定性 NH3>
SiH4,正确;B 项,H2SiO3 的酸性小于 H2SO4,正确;C 项,原子半径 Al>Si>N,正确;D 项,NaAlO2 显
碱性,错误。