- 2021-08-06 发布 |
- 37.5 KB |
- 16页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高二化学教案:第15讲-铝及其化合物
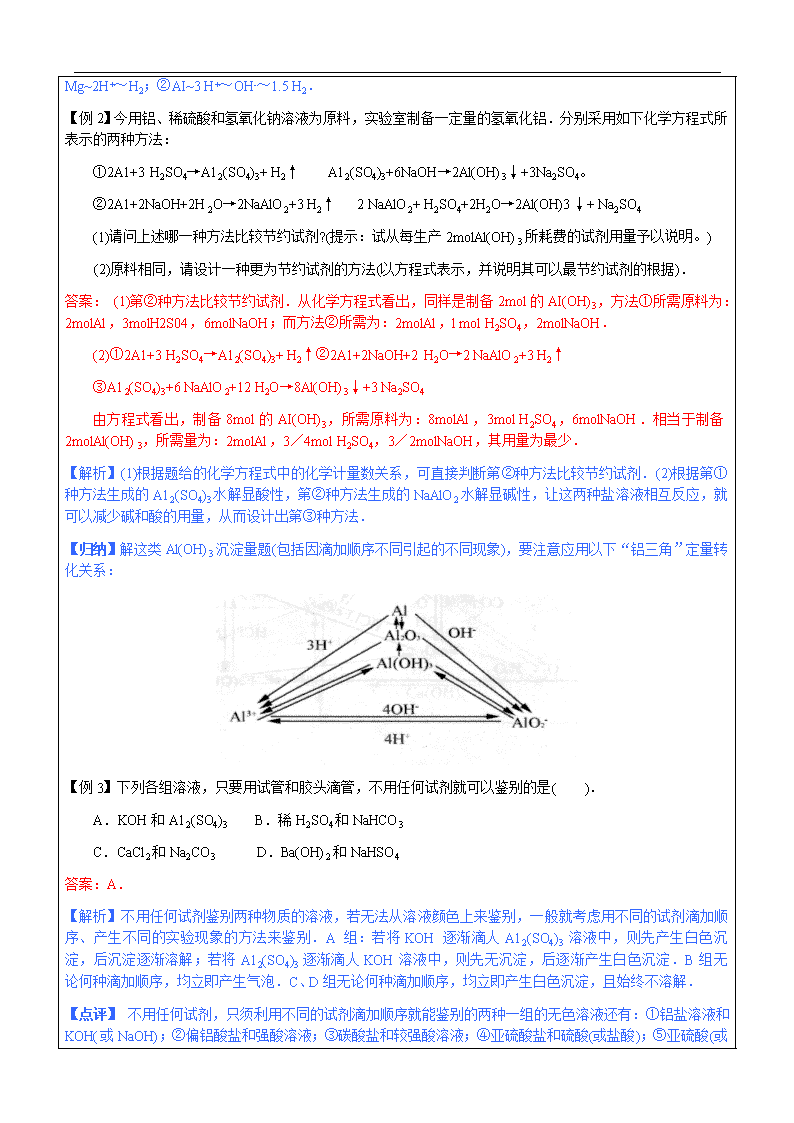
辅导教案 学员姓名: 学科教师: 年 级:高二 辅导科目: 授课日期 ××年××月××日 时 间 A / B / C / D / E / F段 主 题 铝及其化合物 教学内容 1.了解金属铝的物理性质。 2.掌握金属铝的化学性质。 3.掌握氧化铝和氢氧化铝的两性。 4.复习铝及其化合物的性质,及其转化关系。 5.掌握铝及其化合物有关的应用与计算。 重点:氧化铝和氢氧化铝的两性,铝及其化合物的转化关系 难点:试剂相同、滴加顺序不同其反应原理与现象的差异 【教学建议】独立思考+小组讨论。建议用时15分钟。 【具体操作】学生先独立思考完成,然后进行讨论,达成共识。然后由学生回答,每人回答若干小题。可根据学生的程度,选择适宜难度的试题让其回答,给出选择答案的理由。 【例1】将等物质的量的镁和铝相混合,取四份等质量的该混合物分别加到足量的下列溶液中,充分反应后,放出氢气最多的是( ). A.3mol/L HCl B.4mol/L HNO3 C.8mol/L NaOH D.18mol/L H2SO4 答案:A. 【解析】通过比较镁、铝分别与酸碱作用的性质及其定量关系求解.令镁、铝各为lmol,与足量盐酸反应生成(1+1.5)molH2;与硝酸、浓硫酸反应均不生成H:;镁不与NaOH溶液反应,lmolAl与足量NaOH溶液反应生成1.5molH2. 【点评】这类题只要通过比较镁、铝性质的异同及其定量关系,便可迅速求解.注意记住两个定量关系:① Mg~2H+~H2;②AI~3 H+~OH-~1.5 H2. 【例2】今用铝、稀硫酸和氢氧化钠溶液为原料,实验室制备一定量的氢氧化铝.分别采用如下化学方程式所表示的两种方法: ①2A1+3 H2SO4→A12(SO4)3+ H2↑ A12(SO4)3+6NaOH→2Al(OH)3↓+3Na2SO4。 ②2A1+2NaOH+2H2O→2NaAlO2+3 H2↑ 2 NaAlO2+ H2SO4+2H2O→2Al(OH)3↓+ Na2SO4 (1)请问上述哪一种方法比较节约试剂?(提示:试从每生产2molAl(OH)3所耗费的试剂用量予以说明。) (2)原料相同,请设计一种更为节约试剂的方法(以方程式表示,并说明其可以最节约试剂的根据). 答案: (1)第②种方法比较节约试剂.从化学方程式看出,同样是制备2mol的AI(OH)3,方法①所需原料为:2molAl,3molH2S04,6molNaOH;而方法②所需为:2molAl,l mol H2SO4,2molNaOH. (2)①2A1+3 H2SO4→A12(SO4)3+ H2↑②2A1+2NaOH+2 H2O→2 NaAlO2+3 H2↑ ③A12(SO4)3+6 NaAlO2+12 H2O→8Al(OH)3↓+3 Na2SO4 由方程式看出,制备8mol的AI(OH)3,所需原料为:8molAl,3mol H2SO4,6molNaOH.相当于制备2molAl(OH)3,所需量为:2molAl,3/4mol H2SO4,3/2molNaOH,其用量为最少. 【解析】(1)根据题给的化学方程式中的化学计量数关系,可直接判断第②种方法比较节约试剂.(2)根据第①种方法生成的A12(SO4)3水解显酸性,第②种方法生成的NaAlO2水解显碱性,让这两种盐溶液相互反应,就可以减少碱和酸的用量,从而设计出第③种方法. 【归纳】解这类Al(OH)3沉淀量题(包括因滴加顺序不同引起的不同现象),要注意应用以下“铝三角”定量转化关系: 【例3】下列各组溶液,只要用试管和胶头滴管,不用任何试剂就可以鉴别的是( ). A.KOH和A12(SO4)3 B.稀H2SO4和NaHCO3 C.CaCl2和Na2CO3 D.Ba(OH)2和NaHSO4 答案:A. 【解析】不用任何试剂鉴别两种物质的溶液,若无法从溶液颜色上来鉴别,一般就考虑用不同的试剂滴加顺序、产生不同的实验现象的方法来鉴别.A组:若将KOH逐渐滴人A12(SO4)3溶液中,则先产生白色沉淀,后沉淀逐渐溶解;若将A12(SO4)3逐渐滴人KOH溶液中,则先无沉淀,后逐渐产生白色沉淀.B组无论何种滴加顺序,均立即产生气泡.C、D组无论何种滴加顺序,均立即产生白色沉淀,且始终不溶解. 【点评】 不用任何试剂,只须利用不同的试剂滴加顺序就能鉴别的两种一组的无色溶液还有:①铝盐溶液和KOH(或NaOH);②偏铝酸盐和强酸溶液;③碳酸盐和较强酸溶液;④亚硫酸盐和硫酸(或盐酸);⑤ 亚硫酸(或磷酸)和Ca(OH)2[或Ba(OH)2];⑥AgNO3和氨水. 【例4】要使Ba2+、A13+、Cu2+、Mg2+、Ag+五种离子从溶液中逐一沉淀析出,选用的试剂和加入的顺序是( ). A.H2SO4→HCl→K2S→NaOH→CO2 B.NaCl→Na2SO4→Na2S→NH3·H2O→HCl C.NaCl→Na2SO4→H2S→NaOH→CO2 D.Na2S→Na2SO4→NaCl→NaOH→HCl 答案:C. 【解析】逐项分析每种试剂(包括过量时)只能沉淀一种离子的选项.A组:H2SO4能沉淀Ba2+、Ag+两种离子;B组:加入Na2S时,能沉淀Al3+、Cu2+两种离子;C组:能先后分别沉淀Ag+、Ba2+、Cu2+、Mg2+、A13+;D组:加人Na2S时,能沉淀A13+、Cu2+、Ag+三种离子. 【归纳】解这类题要采用符合“逐一沉淀”的筛选方法.要注意:在加入强碱溶液时,A13+转化为AlO2-,最后通人CO2,再把AlO2-转化为Al(OH)3沉淀. 【例5】在托盘天平两边各放一个盛有等质量稀盐酸(各含nmolHCl)的甲、乙两个烧杯,调节天平达平衡,然后分别投入n mol Mg、b mol A1,充分反应后,天平仍保持平衡. (1)若天平两边酸均过量,则甲、乙两边净增重分别为____________________。 (2)若天平两边金属均过量,则甲、乙两边产生的H2的质量__________,所加金属的质量__________。 (3)若天平两边酸均用完,其中一边金属过量,则过量的金属必为__________,这是因为____________________.由此推出天平平衡的条件是(用含a、b、n的代数式表示,下同) __________。 (4)若天平一边酸过量,另一边金属过量,则过量金属必为__________,此时满足天平平衡的条件是__________. 答案:(1)(24—2)n;(27—3)b (2)相等;也相等 (3)A1;生成等量H2所需A1的质量比Mg的要小;24a-n=27b-n (4)A1;(24-2)a=27b-n 【解析】根据天平两边只有“净增重相等”,才能保持平衡的原理,依题意解答. 【教学建议】学生在说解题思路时其他学生可以指出不足或错误的地方,以【相互PK】的形式互动。 【教学建议】请根据互动探索中学生暴露出来的问题,选择性的安排精讲的内容。建议用时60分钟。过程中注意照顾不爱抢答或者抢答较少的学生,鼓励抢答 1、 铝的物理性质及用途 【教学建议】教师提问,学生自由回答(或教师指定学生回答)。 【例1】食品包装中经常用到铝箔,铝能制成铝箔说明铝具有良好的 ( ) (A)导电性 (B)延展性 (C)导热性 (D)抗腐蚀性 【解析】由于铝具有延展性,故可以制成铝箔,应选B。 【教学建议】所有例题均交叉批阅、交流分享方法,简单选择题也可使用【问题抢答】方式进行,较难计算及填空可采取【讨论合作】解题。建议用时10分钟。 1、 铝的化学性质 【教学建议】填空部分由基础较差学生回答,基础较好学生补充 (1)铝是比较活泼的金属,在化学反应中较容易失去3个电子变成带3个单位正电荷的阳离子。 (2)铝原子结构示意图: (3)铝的氧化反应 ▲A1与O2反应,发出耀眼的白光,生成Al2O3:4Al+3O22Al2O3 ▲铝的钝化:铝在冷的浓硝酸和浓硫酸中发生钝化现象。 (4)铝与其他非金属单质反应:2Al+3C122Al C13 (5)铝热反应:2Al+Fe2O3Al2O3 +2Fe;Al+Cr2O32Cr+Al2O3 【归纳】(1)铝粉与氧化铁的混合物叫做铝热剂。 (2)V2O5、Cr203、Mn02能发生与氧化铁相似的铝热反应。 (3)工业上常利用铝热反应冶炼某些难熔的金属。 (6)铝与热水反应:2Al+6H2O2Al(OH)3+3H2↑ 白色胶状沉淀 (7)铝与盐酸、稀硫酸反应: 2Al+6HCl→2AlCl3+3H2↑ 2Al+3H2SO4(稀) →A12(S04)3+3H2↑ (8)铝与碱反应: 2Al+6H2O→2Al(OH)3+3H2↑ ① AI(OH)3+NaOH→NaAlO2+2H20 ② 反应①不易进行的原因是:a.Al的金属性相对较弱.b.产生的AI(OH)3不溶于水覆盖在金属表面而阻止反应的进行。由反应②可知AI(OH)3能溶于NaOH溶液中,能促使反应①向右进行,所以Al能与NaOH溶液反应,将①与②相加可得总反应: 可简写为: 2Al+2NaOH+2H2O→2NaAlO2+3H2↑ 【归纳】(1)铝与NaOH溶液反应时,H2O作为反应物参加反应。 (2)铝与碱反应过程中,AI(OH)3起酸的作用; (3)铝制品不能用来存放酸性和碱性的物质。 【例2】近年来,科学家一直在探索利用铝粉作燃料的可能性,以期铝能成为一种石油的取代物。假如铝作为一种普遍使用的新型熊源被开发利用,下列关于其有利因素的说法中,你认为哪项是错误的 ( ) (A)铝质轻,便于运输、贮存,且安全 (B)铝燃烧时放出的热量大,且燃烧后新产物对环境的污染容易得到有效的控制 (C)在地球上,铝矿资源丰富 (D)现代电冶铝的工业技术已为铝作为新能源奠定了重要基础 答案:D 【解析】根据铝的有关性质知(A)、(B)两项说法正确;又铝在自然界的含量丰富,所以为其作为能源提供了保障,但铝在自然界中主要以化合态形式存在,就目前制铝的方法本身就消耗大量的能量,因此D项说法错误。 【例3】收藏家收藏的清末铝制品,至今保存仍十分完好,该艺术品不易锈蚀的主要原因是 ( ) (A)铝不易发生化学反应 (B)铝的氧化物易发生还原反应 (C)铝不易氧化 (D)铝易氧化,但铝表面生成的氧化铝具有保护内部铝的作用 【解析】铝金属活动性较强,易于氧化,但表面生成物——致密的氧化铝薄膜能阻止内部的铝继续被氧化,因此,铝具有很好的抗腐蚀性能。 答案:D 【例4】下列物质中,常温下与铝不反应的是 ( ) (A)稀硝酸 (B)浓硫酸 (C)盐酸 (D)CuSO4溶液 【解析】铝遇冷的浓硫酸或浓硝酸发生钝化,在金属的表面形成致密的氧化膜,阻止金属与酸反应,起到保护作用。 答案:B 【例5】称取两份铝粉,第一份加足量NaOH溶液,第二份加足量盐酸,如果要得到相同体积(同温同压)的氢气,两份铝粉的质量比为( )。 A.1:2 B.1:3 C.3:2 D.1:1 【解析】由方程式可知,相同质量的铝粉与足量的盐酸或足量NaOH溶液反应,放出氢气的体积(同温同压)是相同的。现在要得到相同体积的氢气,则两份铝粉的质量应相等。故正确答案选D。 3、Al(OH)3的弱酸性和弱碱性 (1)Al(OH)3能跟强酸和强碱溶液反应,具有两性。 Al(OH)3+NaOH→NaAlO2+2H2O Al(OH)3+3HCl→AlCl3+3H2O (2)Al(OH)3溶于强酸强碱,而不溶于弱酸弱碱,所以在反应中可把Al(0H)3认为是一元弱酸或三元弱碱。 【归纳】A12O3也具有两性,既能和强酸、强碱反应,但不能和弱酸、弱碱反应。具体反应如下: Al2O3+2NaOH→2NaAlO2+H2O Al2O3+6HCl→2AlCl3+3H2O 4、铝盐 明矾[KAI(SO4)2·12H2O]或A12(SO4)3溶于水后,由于Al3+在水中水解产生Al(OH)3胶体,胶体颗粒具有较大的表面积,可吸附水中固体悬浮物,故能作净水剂。另外膨化剂中铝盐常用来与NaHCO3充分反应,离子反应式为:3HCO3-+A13+→Al(OH)3+3CO2↑(该反应本质是双水解反应),铝盐在这儿代替了酸起的作用。 【例6】下列溶液中,不能溶解新制的氢氧化铝的是 ( ) (A)氨水 (B)氢氧化钾溶液 (C)硝酸 (D)硫酸 【解析】氢氧化铝具有两性,能溶于强碱溶液和强酸溶液,但不能溶于弱酸和弱碱溶液。 答案:A 5、 “铝三角”及其应用 【教学建议】学生自查与自学,用时5-10分钟。 (1) “铝三角”系指A13+、AI(OH)3、A1O2-相互依存的三角关系,如右图所示。有关离子方程式为: Al(OH)3+3H+→A13++3H2O A13++3OH-→Al(OH)3↓ Al(OH)3+ OH-→A1O2-+2 H2O A1O2-+ H++ H2O→Al(OH)3↓ A1O2-+4 H+→A13++2 H2O A13++4OH- →A1O2-+2 H2O A13++3 A1O2-+6 H2O→4 Al(OH)3↓(双水解) (2)“铝三角”的应用 ▲制取AI(OH)3: Al3++3NH3·H2O→Al(OH)3↓+3NH4+ A1O2-+CO2+2 H2O→Al(OH)3↓+ HCO3- (若CO2少量则生成CO32-) ▲AI3+的水解: Al3++3 H2O Al(0H)3+3H+ ▲离子共存问题:Al3+与OH-、S2-、A1O2-、HCO3- -、CO32-因生成沉淀或发生双水解反应而不能大量共存;A1O2-与H+、NH4+、Al3+、Fe3+等不能大量共存。 【例7】下列离子在碱性溶液中能大量存在的是( ) (A) Al3+ (B) A1O2- (C) NH4+ (D)Cu2+ 【解析】在碱性溶液中能大量存在的离子是不与OH-反应的离子。 答案:B 【例8】今用铝、稀硫酸和氢氧化钠溶液为原料,在实验室制备一定量的氢氧化铝。可分别采用如下化学方程式所表示的两种方法: ①2Al+3H2SO4(稀) →A12(S04)3+3H2↑,A12(SO4)3+6NaOH→2Al(OH)3↓+3Na2SO4; ②2Al+2NaOH+2H2O→2NaAlO2+3H2↑,2NaAlO2+H2SO4+2H2O→2Al(OH)3↓+Na2SO4。 (1)上述哪一种方法比较节约试剂?(提示:试从每生产2 mol Al(OH)3所耗费的试剂用量予以说明) (2)原料相同,请设计一种更为节约试剂的方法。(以方程式表示,并说明其可以最节约试剂的根据) 【解析】(1)A1既可跟稀H2SO4反应,也可跟NaOH溶液反应,Al溶解并放出H2。溶解后如果再用NaOH溶液或H2SO4处理,实际上是调控pH,使之得到Al(OH)3,达到制备目的。先用酸,后用碱,还是先用碱,后用酸,都是可行的,但是耗用的酸、碱用量却不同。同样是制备2 mol Al(OH)3,方法①需2molA1、3 molH2SO4、6 mol NaOH;方法②只需2 mol Al、1 mol H2SO4、2 molNaOH。显然,方法②较方法①节约了酸、碱试剂。 (2)仔细观察第一种方法,它第一步生成的是A12(S04)3,略有酸性,所以要用较多的Na0H。第二种方法,其第一步生成的是NaAlO2,略有碱性,所以要用较多的H2SO4。因此,设想是否能用略有酸性的A12(S04)3和略有碱性的NaAlO2自己中和呢?联合两种方法可以设计出第三种方法:2Al+3H2SO4(稀) →A12(S04)3+3H2↑,2Al+2NaOH+2H2O→2NaAlO2+3H2↑,A12(SO4)3+6 NaAlO2+12 H2O→8 Al(OH)3↓+3 Na2SO4。相当于制备2molAl(OH)3所用原料为2 mol Al、3/4mol H2SO4、1.5 mol NaOH,确实节约了试剂。 答案:(1)第2种方法节约试剂,以制备2 mol Al(OH)3为例,第1种方法需2molA1、3 molH2SO4、6 mol NaOH,第2种方法只需2 mol Al、1 mol H2SO4、2 molNaOH。 (2) 2Al+3H2SO4(稀) →A12(S04)3+3H2↑, 2Al+2NaOH+2H2O→2NaAlO2+3H2↑, A12(SO4)3+6 NaAlO2+12 H2O→8 Al(OH)3↓+3 Na2SO4。 制备2molAl(OH)3所用原料为2 mol Al、3/4mol H2SO4、1.5 mol NaOH。 5、 有关铝的图象问题 【教学建议】小组讨论、汇报。建议用时10分钟。 具体操作:让学生通过讨论的形式,归纳出以下问题解析,然后由学生汇报,每个学生汇报1-2题。教师给予补充讲解。 (1)如图1所示,向AlCl3溶液中滴加NaOH溶液直到过量 A13++3OH-→Al(OH)3↓ AI(OH)3+ OH-→A1O2-+2 H2O 【现象】白色沉淀逐渐增多达到最大值(A点),继续加NaOH溶液沉淀逐渐溶解,直到完全消失。 (2)如图2所示,向AlCl3溶液中滴加氨水直到过量: Al3++3NH3·H2O→Al(OH)3↓+3NH4+ 【现象】白色沉淀逐渐增多直至达到最大值(A点),继续加NH3·H2O,沉淀量不变。 (3)如图3所示,向NaOH溶液中滴加A1Cl。溶液直至过量: A13++3OH-→Al(OH)3↓ A13++3 A1O2-+6 H2O→4 Al(OH)3↓ 【现象】开始时无沉淀,接着产生沉淀,达最大值(A点)时,继续滴加AlCl3溶液,沉淀不增减。 (4)如图4所示,向AlCl3溶液中滴加NaA1O2溶液直至过量: A13++3 A1O2-+6 H2O→4 Al(OH)3↓ 【现象】白色沉淀逐渐增多直至达到最大值(A)点,继续加入NaA1O2溶液,沉淀不增减。 (5)如图5所示,向NaA1O2溶液中滴加AlCl3溶液直至过量:现象与离子方程式同4。 (6)如图6所示,向NaA1O2溶液中滴加盐酸直至过量: A1O2-+ H++ H2O→Al(OH)3↓ Al(OH)3+3H+→A13++3H2O 【现象】 白色沉淀逐渐增多直至达到最大值(A点),继续加盐酸,沉淀逐渐减少,最后完全消失。 (7)如图7所示,向盐酸溶液中滴加NaA1O2溶液,直至过量: A1O2-+ H++ H2O→Al(OH)3↓ A13++3 A1O2-+6 H2O→4 Al(OH)3↓ 【现象】开始无沉淀,接着产生白色沉淀,逐渐增多直至达到最大值(A点),继续加入NaA1O2溶液,沉淀不增减。 (8)如图8所示,向NaA1O2溶液中通入足量CO2; A1O2-+CO2+2 H2O→Al(OH)3↓+ HCO3- CO2+H2O+ CO32-→2 HCO3- 【现象】白色沉淀逐渐增多直至达到最大值(A点),继续通入CO2,沉淀不增减。 (9)如图9所示,向MgCl2、A1C13和盐酸的混合溶液中滴加NaOH直到过量: H++OH-→H2O Mg2++2OH-→Mg(OH)2↓ Al3++3OH-→Al(OH)3↓ Al(OH)3+ OH-→A1O2-+2 H2O 【现象】开始无沉淀,接着产生白色沉淀,当沉淀量达到最大值(A点)时,继续加入NaOH溶液,沉淀减少至E,继续滴加沉淀无变化。 【例9】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量的水后,产生1.16 g白色沉淀,再向所得浊液中加入1.00 mol·L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的关系如右图所示。 试回答: (1)A点的沉淀物的化学式为 理由 。 (2)写出A点到B点发生反应的离子方程式 。 (3)原混合物中MgCl2的质量是 。AlCl3的质量是 ,NaOH的质量是 。 (4)C点HCl溶液的体积为 mL。 【解析】(1)加入10.0 mL HCl后沉淀才增加,说明加入10.0 mL HCl正好把过量的NaOH中和掉,故A点的沉淀物只有Mg(OH)2。 (2)A→B,A1O2-刚好生成Al(OH)3,反应为 A1O2-+ H++ H2O→Al(OH)3↓ (3) 1.90 g 2.67 g 5.20 g (4)130.0 【教学建议】“常规练习”中习题难度不大,一般学生可以在15min内完成。可以等学生做完题后,交换批改,然后做对的学生对做错的学生讲解自己的方法,如果有不对的地方老师再加以纠正/补充。“附加题”部分难度较大,通过竞赛的互动方式进行,也可以对于程度较好的学生选择性使用。 基础过关 1、下列物质中,常温下与铝不反应的是( ) A.稀硝酸 B.浓硫酸 C.盐酸 D.CuSO4溶液 2、把Ba(OH)2溶液滴入明矾溶液中,使SO42—全部转化成BaSO4沉淀;此时铝元素的主要存在形式是( ) A、Al3+ B、Al(OH)3 C、AlO2— D、Al3+和Al(OH)3 3、下列离子组一定能大量共存的是( ) A.甲基橙呈黄色的溶液中:、、、 B.石蕊呈蓝色的溶液中:、、、 C.含大量Al3+的溶液中:、、、 D.含大量0H一的溶液中:、、、 答案:1、B 2、C 3、D 4.1989年世界卫生组织把铝确定为食品污染源之一,应加以控制使用,铝在下列应用时应加以控制的是 ( ) ①制铝合金 ②制电线 ③制炊具 ④银色漆颜料 ⑤明矾净水 ⑥明矾与苏打制食品膨松剂 ⑦易拉罐 ⑧用氢氧化铝凝胶制胃舒平药品 ⑨包装糖果和小食品 (A)③⑤⑧⑨ (B)⑥⑧⑨ (C)③⑤⑨ (D)③⑤⑥⑦⑧⑨ 【解析】人类摄入的铝元素主要来自炊具、食品包装(饮料、糖果)、药物、食品添加剂等。 答案:D 5、下列物质中,跟铝粉混合后不能作铝热剂的是 ( ) (A)Na2O (B)Fe2O3 (C)Cr2O3 (D)MnO2 【解析】铝热反应的原理是铝作还原剂,将金属氧化物中的金属还原出来,因此铝只能还原比铝不活泼的金属。组成铝热剂的物质是铝以及可以被铝还原出来的金属氧化物。 答案:A 6、在下图中,横坐标为向一定量的某溶液中加入某种物质的量,纵坐标为生成沉淀的量。从图中,选择适合表中各题要求的序号填入表中 溶液 加(或通入)物质 序号 ⑴饱和石灰水 通入过量CO2 ⑵AlCl3溶液 加入过量浓氨水 ⑶含少量NaOH的NaAlO 2溶液 通入过量CO2 ⑷含少量NaOH的NaAlO 2溶液 逐滴加入稀盐酸 ⑸MgCl2、AlCl3混合溶液 逐滴加入NaOH溶液至过量 ⑹NaOH溶液 逐滴加入Al2(SO4)3溶液至过量 ⑺稀硫酸溶液 逐滴加入NaAlO 2溶液至过量 ⑻含少量盐酸的AlCl3溶液 逐滴加入KOH溶液至过量 答案:⑴A ⑵B ⑶F ⑷D ⑸E ⑹C ⑺F ⑻G 【教学建议】相互pk,比较程度相近学生的解题速度以及正确率 m(g) D E F C 31 34 36 VNaOH(mL) 100 V(mL) D E F C 31 34 36 VNaOH(mL) 7、有AlCl3和MgCl2的固体混合物,取一定量的该混合物加水溶解配成溶液,实验测知Cl-的物质的量为0.70摩尔,如向该混合溶液中逐滴加入8.00mol/L的氢氧化钠溶液(密度为1.27g/mL),加入氢氧化钠溶液的体积(V)和沉淀的质量(m)有右图所示的关系。 求:(1)原NaOH溶液的质量分数为 。 (2)AlCl3和MgCl2的物质的量分别是多少? (3)另取64.70克该混合物溶于水,要使沉淀质量最大,需要加入8.00mol/L的氢氧化钠溶液多少毫升? 答案:(1)25.2% (2)0.1mol 0.2mol (3)175mL 8、将Mg和Al粉末均匀混合,加入到100mL某浓度的硫酸中,产生氢气的体积(标准状况下 )与加入粉末的质量关系如右图所示: (1)硫酸物质的量浓度是 mol·L- 1 。 (2)当硫酸溶液为350mL ,固体粉末为33.3g时,充分反应后产生的气体体积为 L(S.T.P) (3)原固体混合物中Mg和Al的物质的量之比为 。 答案:(1)5 mol·L- 1 (2)33.6L (3)7:2 拓展训练 1、铝、铍(Be)及其化合物具有相似的物理、化学性质,如其氯化物分子内键型相同,故其氯化物晶体的熔点都较低。已知反应:BeCl2+Na2BeO2+2H2O→2NaCl+2Be(OH)2↓能完全进行,则下列推断中不正确的是( ) A.Be(OH)2既能溶于盐酸,又能溶于NaOH溶液 B.BeCl2溶液的pH<7,将其蒸干并灼烧后得到的残留物为BeO C.Na2BeO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为BeO D.虽然BeCl2的水溶液导电性强,但熔融态的BeCl2却不能被电解 2、把铝粉与Fe3O4的混合物,分为两等份。前一份在高温下恰好完全反应,之后将生成物与足量盐酸充分反应;后一份直接加入足量NaOH溶液充分反应。前后两种情况下生成的气体在同温同压下的体积比是( ) A. 1:1 B. 3:4 C. 9:8 D. 4:3 3、将一定质量的镁和铝的混合物投入100 mL盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如右图所示。若不考虑金属和盐酸反应时HCl的挥发,则下列说法正确的是( ) A.镁和铝的总质量为9 g B.生成的氢气在标准状况下的体积为11.2L C.盐酸的物质的量浓度为6 mol/L D.NaOH溶液的物质的量浓度为5 mol/L 4、实验室将9g铝粉跟一定量的金属氧化物粉末混合形成铝热剂。发生铝热反应之后,所得固体中含金属单质为18g,则该氧化物粉末可能是( ) A. B.和 C.和 D 和FeO 5、已知Ba(AlO2)2可溶于水。右图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系。下列有关叙述正确的是( ) A.a-b时沉淀的物质的量:A1(OH)3比BaSO4多 B.c-d时溶液中离子的物质的量:AlO2-比Ba2+多 C.a-d时沉淀的物质的量:BaSO4可能小于A1(OH)3 D.d-e时溶液中离子的物质的量:Ba2+可能等于OH- 6、将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为 O n(沉淀) V(CO2) O n(沉淀) V(CO2) O n(沉淀) V(CO2) O n(沉淀) (沉淀) V(CO2) A B C D 答案: 1、C(B选项中,因为氯化铝水解生成了HCl,加热过程中HCl挥发,促进水解,蒸干后视氢氧化铝,灼烧后为氧化铝,Be可以类推。但是C选项中,因为偏铝酸钠水解产生的是氢氧化钠和氢氧化铝,两个都不是挥发性物质,水解是微弱的,所以蒸干、灼烧后仍为偏铝酸钠,Be可以类推。) 2、B 3、AD 4、A 5、B 6、C 7、现有一包铝热剂是铝粉和氧化铁粉末的混合物,在高温下使之充分反应,将反应后的固体分为两等份,进行如下实验(计算pH时假定溶液体积没有变化): ①向其中一份固体中加入100 mL 2.0 mol·L—1的NaOH溶液,加热使其充分反应后过滤,测得滤液的pH=14; ②向另一份固体中加入140 mL 4.0 mol·L—1的HCl溶液,使固体全部溶解,测得反应后所得溶液中只有H+、Fe2+和Al3+三种阳离子且pH=0。计算: (1)实验①中用去NaOH的物质的量为 ; (2)这包铝热剂中铝的质量为 ,氧化铁的质量为 ; (3)实验②产生氢气的体积(标准状况)为 。 答案:(1)0.1 mol (2)5.4 g 9.6 g (3)2.688 L 8、小苏打、胃舒平、达喜都是常用的中和胃酸的药物。 ⑴小苏打片每片含0.50gNaHCO3,2片小苏打片和胃酸完全中和,被中和的氢离子是 mol。 ⑵胃舒平每片含0.245gAl(OH)3。中和胃酸时,6片小苏打片相当于胃舒平 片。 ⑶达喜的化学成分是铝和镁的碱式盐。 ①取该碱式盐3.01g,加入2.0mol/L盐酸使其溶解,当加入盐酸42.5mL时开始产生CO2,加入盐酸至45.0mL时正好反应完全,计算该碱式盐样品中氢氧根与碳酸根的物质的量之比。 ②在上述碱式盐溶于盐酸后的溶液中加入过量氢氧化钠,过滤,沉淀物进行干燥后重1.74g,若该碱式盐中氢元素的质量分数为0.040,试推测该碱式盐的化学式。 答案:⑴ 0.012mol ⑵ 3.8 ⑶ n (OH-):n (CO32-)=16:1 ⑷ Al2Mg6(OH) 16CO2·4H2O (此环节设计时间在10分钟内) (以学生自我总结为主,TR根据教案中的总结进行引导为辅,为本次课做一个总结回顾;总结方式可以多种多样,如画思维导图、默想回忆、抢答形式等。教案中给到重难点/易错点等的总结条目。) 【教学建议】 以教代学,针对某一指定内容,让学生来做老师,把自己的理解讲授给其他的学生。注意调控整个课堂全体学生的注意力。不足不全面地方引导其他学生补充。此处由每位学生整理课后还需强化理解和记忆的内容,列出来。以便考前做好更充分的准备。 (以学生复述为主,老师适当引导,解答请见前面精讲提升。) ▲有关AI(OH)3沉淀量的计算 A13+与OH-随着相对量的不同发生下列有关反应: A13++3OH-→Al(OH)3↓ ① Al(OH)3+ OH-→A1O2-+2 H2O ② 由①、②得:A13++4OH-→A1O2-+2 H2O ③ 由于A13+与OH-反应的产物能与反应物之一的OH-反应,规律如下: (1)求Al(OH)3的量 n(OH-)/n(A13+)≤3时,发生反应①,则:n[Al(OH)3]=1/3n(OH-) n(OH-)/n(A13+)≥4时,发生反应③,无Al(OH)3生成。 3查看更多
相关文章
- 当前文档收益归属上传用户