- 2021-08-07 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019-2020学年高二化学人教版选修4练习:第2章 第3节 第4课时 化学平衡常数 Word版含解析
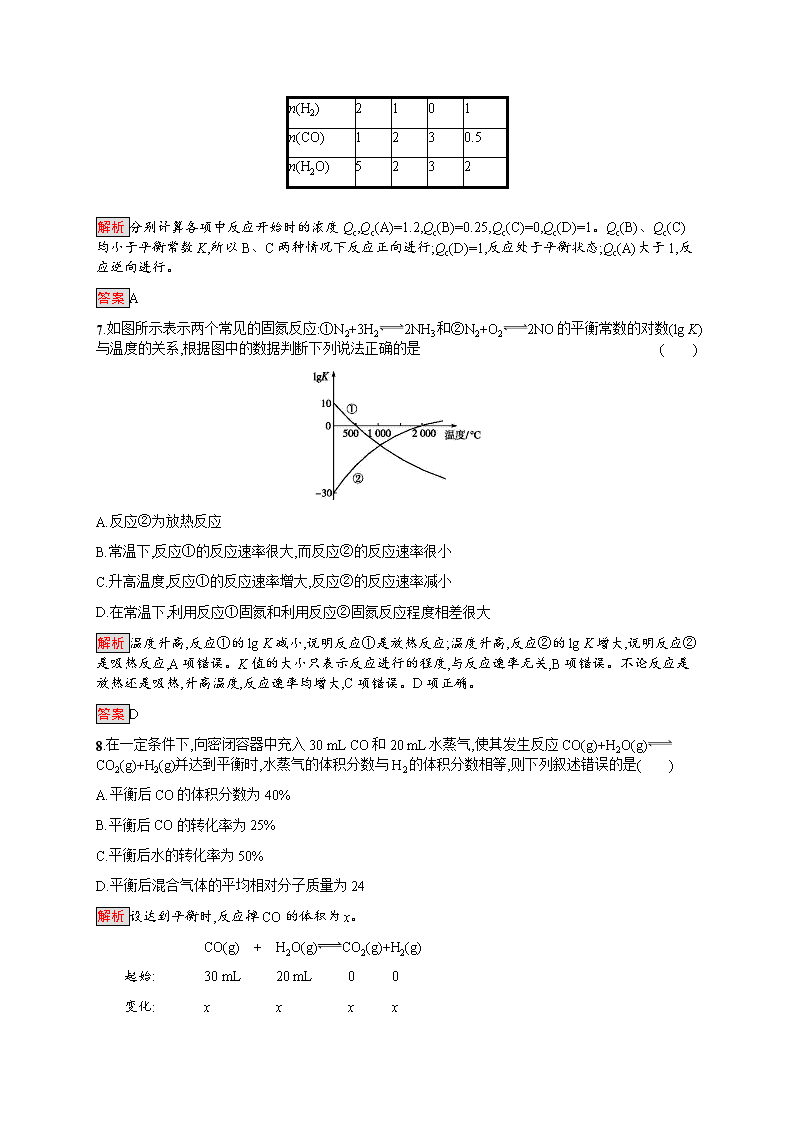
第4课时 化学平衡常数 课后篇巩固提升 基础巩固 1.化学平衡常数可以用K来表示,下列关于化学平衡常数的说法中正确的是( ) A.K越大,反应物的转化率越小 B.K与反应物的浓度有关 C.K与生成物的浓度有关 D.K与温度有关 解析 K越大,反应物的转化率越大;一个确定的化学反应,其化学平衡常数只与反应体系的温度有关。 答案 D 2.某温度时,反应SO2(g)+12O2(g)SO3(g)的平衡常数K=50。在同一温度下,反应2SO3(g)2SO2(g)+O2(g)的平衡常数K1应为( ) A.2 500 B.100 C.4×10-4 D.2×10-2 解析 K=c(SO3)c(SO2)·c12(O2),K1=c2(SO2)·c(O2)c2(SO3),K1=1K2=4×10-4。 答案 C 3.将一定体积的SO3(g)充入恒容的密闭容器中,发生反应2SO3(g)2SO2(g)+O2(g)并达到平衡;保持温度不变,再充入相同体积的SO3(g),达到新平衡后,与原平衡相比,下列值减小的是( ) A.平均相对分子质量 B.SO3(g)的转化率 C.c(SO3)c(SO2) D.c2(SO3)c2(SO2)·c(O2) 解析 将题中反应过程进行如下分析,假设在原容器上增加一个相同的容器(两容器有隔板),保持温度不变,向增加的容器中充入相同体积的SO3(g),则可建立与原平衡一样的平衡,此时A、B、C、D各项的值均不变,然后抽掉隔板,将两容器压缩为一个容器大小,则压强增大,平衡逆向移动,气体的总物质的量减小,但总质量不变,因此平均相对分子质量增大;SO3(g)的转化率减小;c(SO2)、c(SO3)均增大,但c(SO3)增大的程度比c(SO2)增大的程度大,则c(SO3)c(SO2)增大;c2(SO3)c2(SO2)·c(O2)可看作该反应的平衡常数的倒数,而平衡常数只与温度有关,则不发生变化。 答案 B 4.汽车尾气净化中的一个反应如下: NO(g)+CO(g)12N2(g)+CO2(g) ΔH=-373.4 kJ·mol-1 在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是( ) 解析 该反应为气体分子数减小的放热反应,升高温度,平衡逆向移动,生成物浓度减小,反应物浓度增大,平衡常数减小,A项错误;同理升高温度,平衡逆向移动,CO的转化率减小,B项错误;平衡常数只受温度影响,与物质的量无关,C项正确;增加氮气的物质的量,平衡逆向移动,NO的转化率减小,D项错误。 答案 C 5.X、Y、Z三种气体,取X和Y按1∶1的物质的量之比混合,放入密闭容器中发生如下反应:X(g)+2Y(g)2Z(g),达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于( ) A.33% B.40% C.50% D.66% 解析 设X和Y起始物质的量均为n,转化的X的物质的量为x。 X(g) + 2Y(g) 2Z(g) 起始物质的量/mol n n 0 转化物质的量/mol x 2x 2x 平衡物质的量/mol n-x n-2x 2x 2n-3x2x=32,x=13n。 所以Y的转化率为2xn×100%=66.7%。 答案 D 6.已知830 ℃时,反应CO(g)+H2O(g)H2(g)+CO2(g)的平衡常数K=1,将各物质按表中的物质的量(单位:mol)投入恒容容器中,则开始时反应逆向进行的是( ) 选项 A B C D n(CO2) 3 1 0 1 n(H2) 2 1 0 1 n(CO) 1 2 3 0.5 n(H2O) 5 2 3 2 解析 分别计算各项中反应开始时的浓度Qc,Qc(A)=1.2,Qc(B)=0.25,Qc(C)=0,Qc(D)=1。Qc(B)、Qc(C)均小于平衡常数K,所以B、C两种情况下反应正向进行;Qc(D)=1,反应处于平衡状态;Qc(A)大于1,反应逆向进行。 答案 A 7.如图所示表示两个常见的固氮反应:①N2+3H22NH3和②N2+O22NO的平衡常数的对数(lg K)与温度的关系,根据图中的数据判断下列说法正确的是( ) A.反应②为放热反应 B.常温下,反应①的反应速率很大,而反应②的反应速率很小 C.升高温度,反应①的反应速率增大,反应②的反应速率减小 D.在常温下,利用反应①固氮和利用反应②固氮反应程度相差很大 解析 温度升高,反应①的lg K减小,说明反应①是放热反应;温度升高,反应②的lg K增大,说明反应②是吸热反应,A项错误。K值的大小只表示反应进行的程度,与反应速率无关,B项错误。不论反应是放热还是吸热,升高温度,反应速率均增大,C项错误。D项正确。 答案 D 8.在一定条件下,向密闭容器中充入30 mL CO和20 mL水蒸气,使其发生反应CO(g)+H2O(g)CO2(g)+H2(g)并达到平衡时,水蒸气的体积分数与H2的体积分数相等,则下列叙述错误的是( ) A.平衡后CO的体积分数为40% B.平衡后CO的转化率为25% C.平衡后水的转化率为50% D.平衡后混合气体的平均相对分子质量为24 解析 设达到平衡时,反应掉CO的体积为x。 CO(g) + H2O(g)CO2(g)+H2(g) 起始: 30 mL 20 mL 0 0 变化: x x x x 平衡: 30 mL-x 20 mL-x x x 由题意知:20 mL-x=x,故x=10 mL 故平衡后CO的体积分数为30 mL-10 mL50 mL×100%=40%,CO的转化率为10 mL30 mL×100%≈33.3%,H2O的转化率为10 mL20 mL×100%=50%,平衡后混合气体的平均相对分子质量不变,仍为30×28+20×1850=24。 答案 B 9.一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应2HI(g)H2(g)+I2(g),H2的物质的量随时间的变化如图所示。 (1)0~2 min内的平均反应速率v(HI)= 。该温度下,H2(g)+I2(g)2HI(g)的平衡常数K= 。 (2)相同温度下,若开始加入HI(g) 的物质的量是原来的2倍,则 是原来的2倍。 A.平衡常数 B.HI的平衡浓度 C.达到平衡的时间 D.平衡时H2的体积分数 解析 (1) H2(g) + I2(g)2HI(g) 起始/mol 0 0 1 转化/mol 0.1 0.1 0.2 平衡/mol 0.1 0.1 0.8 0~2 min内的平均反应速率v(HI)=0.1 mol·L-1·min-1,该温度下,反应H2(g)+I2(g)2HI(g)的平衡常数K=64。 (2)若开始加入HI的物质的量是原来的2倍,相当于先将2 mol HI加入到2 L的容器中(达到的平衡状态与原平衡一致,即HI的平衡浓度、H2的体积分数与原平衡相同),达到平衡后再将体积压缩至1 L,因为该反应为气体体积不变的反应,加压时平衡不移动,所以HI的平衡浓度为原来的2倍,H2的体积分数不变;温度不变,平衡常数不变;加入HI的物质的量增大,反应物浓度增大,反应速率增大,达到平衡的时间小于原来的2倍。 答案 (1)0.1 mol·L-1·min-1 64 (2)B 10.在830 K时,在密闭容器中发生下列可逆反应: CO(g)+H2O(g)CO2(g)+H2(g) ΔH<0。 试回答下列问题: (1)若起始时c(CO)=2 mol·L-1,c(H2O)=3 mol·L-1,4 s后达到平衡,此时CO的转化率为60%,则在该温度下,该反应的平衡常数K= 。用H2O表示的化学反应速率为 。 (2)在相同温度下,若起始时c(CO)=1 mol·L-1,c(H2O)=2 mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态 (填“是”或“否”),此时v(正) v(逆)(填“大于”“小于”或“等于”)。 (3)若降低温度,该反应的K值将 。 解析 (1) CO(g)+H2O(g)CO2(g)+H2(g) 起始浓度(mol·L-1) 2 3 0 0 变化浓度(mol·L-1) 1.2 1.2 1.2 1.2 平衡浓度(mol·L-1) 0.8 1.8 1.2 1.2 该反应的平衡常数K=c(CO2)·c(H2)c(CO)·c(H2O)=1.2×1.20.8×1.8=1, v(H2O)=1.2mol·L-14 s=0.3 mol·L-1·s-1。 (2)反应进行到某时刻时,c(H2)=c(CO2)=0.5 mol·L-1,c(CO)=0.5 mol·L-1,c(H2O)=1.5 mol·L-1,Q=c(CO2)·c(H2)c(CO)·c(H2O)=0.5×0.50.5×1.5=13查看更多