高中化学第二章分子结构与性质章末整合同步练习新人教版选修3
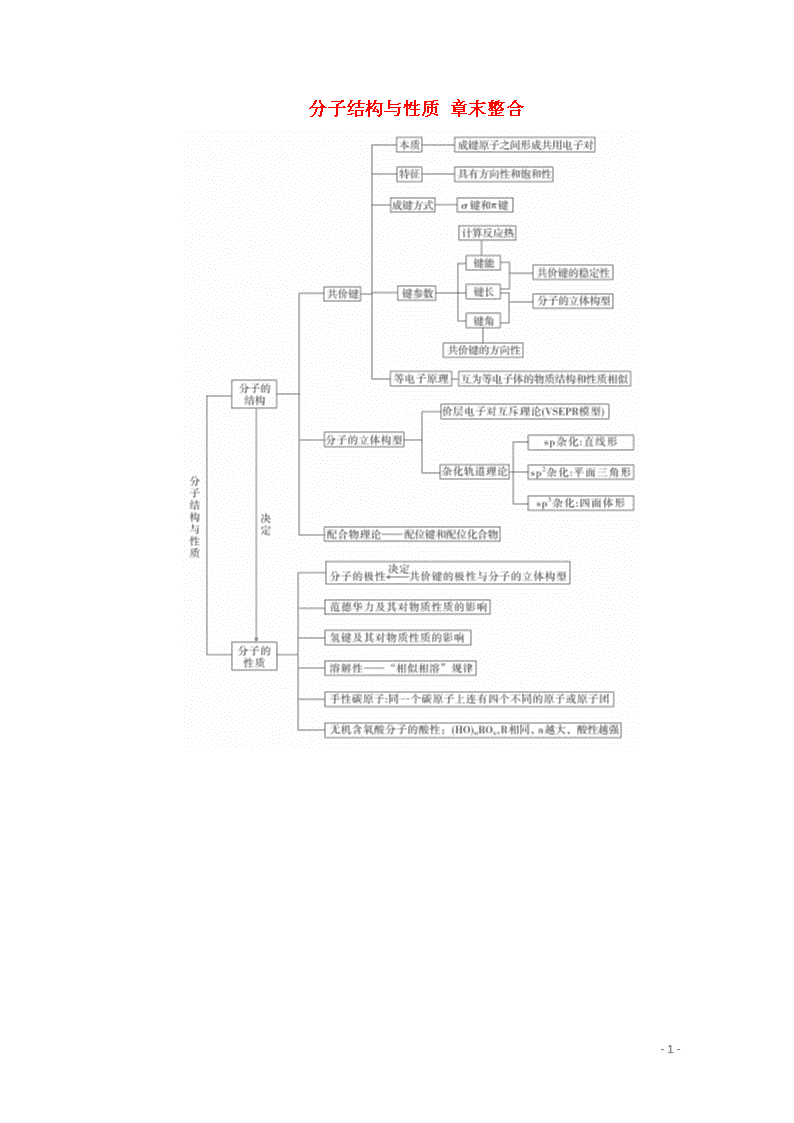
分子结构与性质 章末整合
- 6 -
专题一 共价键及其强弱的判断
1.共价键的知识结构
2.共价键强弱的判断
影响共价键强弱的主要因素是键能、核间距和共用电子对的数目。判断共价键的强弱可依据下列几条:
(1)由原子半径和共用电子对数判断:成键原子的半径越小,共用电子对数越多,则共价键越牢固,含有共价键的分子越稳定。如原子半径:F
H—Cl>H—Br>H—I,稳定性:HF>HCl>HBr>HI。
(2)由键能判断:共价键的键能越大,表示破坏共价键消耗的能量越多,则共价键越牢固。
- 6 -
(3)由键长判断:共价键的键长越短,破坏共价键消耗的能量一般越多,则共价键越牢固。
3.共价键分子中8电子稳定结构的判断
判断分子结构中各原子最外层电子是否满足8电子稳定结构的简捷方法如下:
(1)分子中若含有氢元素,则氢原子不能满足8电子稳定结构。
(2)某元素化合价绝对值与其原子最外层电子数之和等于8,则该元素的原子最外层满足8电子稳定结构。如:
①C原子最外层电子数为4,CO2中C为+4价,二者之和为8;O原子最外层电子数为6,CO2中O为-2价(绝对值是2),二者之和为8,则CO2分子中所有原子都满足最外层8电子稳定结构。
②N原子最外层5个电子,NO2中,N为+4价,二者之和为9,故NO2中N原子不满足最外层8电子稳定结构。
③B原子最外层3个电子,BF3中,B为+3价,二者之和为6,故BF3中B原子不满足最外层8电子稳定结构。
专题二 分子的立体构型及判断方法
1.用价层电子对互斥理论判断
价层电子对互斥模型说明价层电子对的排斥作用对分子空间构型的影响,而分子的空间构型指的是成键电子对的空间构型,不包括孤电子对。
(1)当中心原子无孤对电子时,分子的空间构型与VSEPR模型一致。
(2)当中心原子有孤对电子时,分子的空间构型与VSEPR模型不一致。
2.用杂化轨道理论判断
杂化
类型
杂化轨
道数目
杂化轨道
间夹角
分子立
体构型
实例
sp
2
180°
直线形
BeCl2、CH≡CH
sp2
3
120°
平面三角形
BF3、BCl3
sp3
4
109°28′
四面体形
CH4、CCl4、CH3Cl
3.用键角判断
- 6 -
4.根据等电子原理判断
通常情况下,等电子体的立体构型相同,如SO2与O3均为V形,CH4与NH均为正四面体形。常见的等电子体及立体构型如下表所示:
- 6 -
专题三 配合物的结构和性质
- 6 -
- 6 -