- 2021-08-06 发布 |
- 37.5 KB |
- 10页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高中化学第二章分子结构与性质第二节第1课时价层电子对互斥理论同步练习新人教版选修3
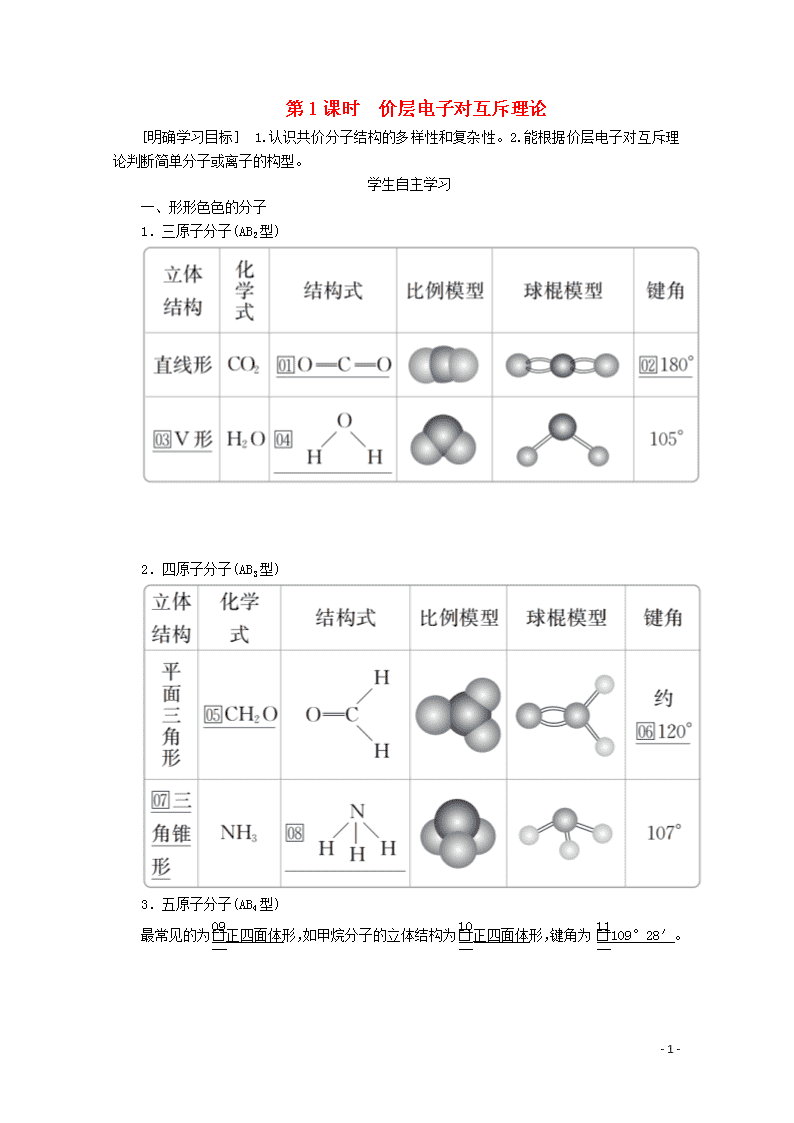
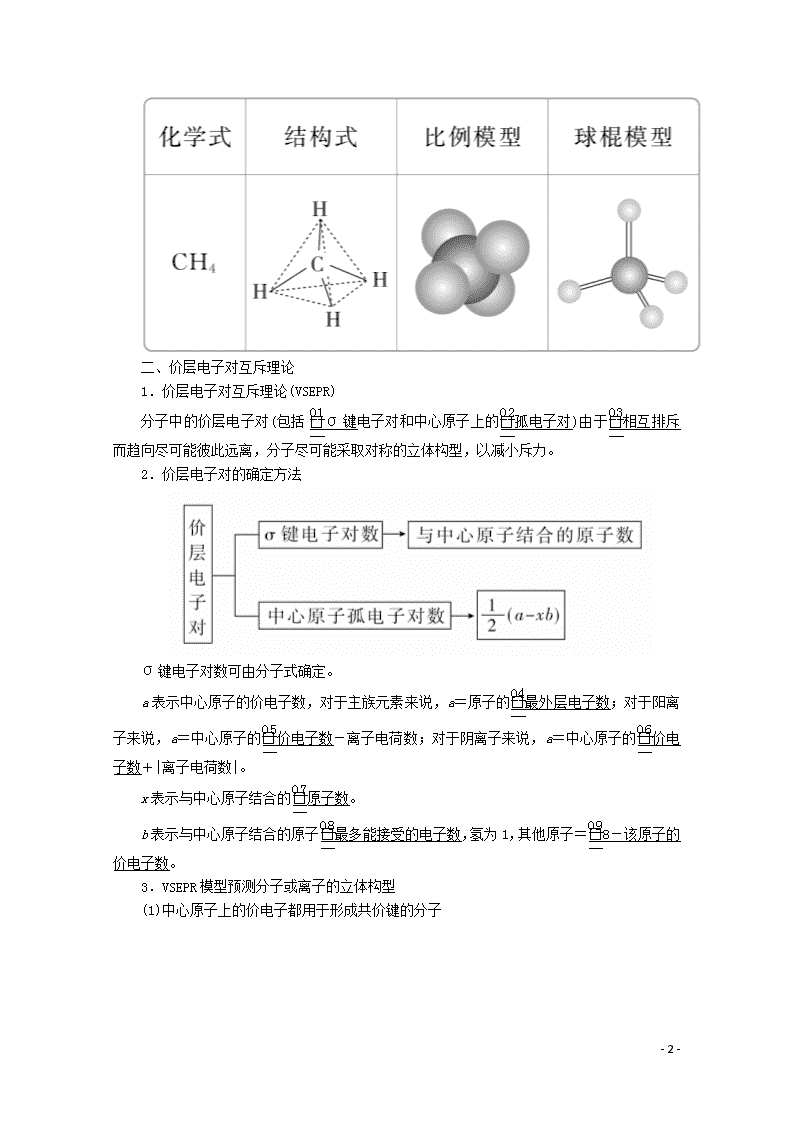
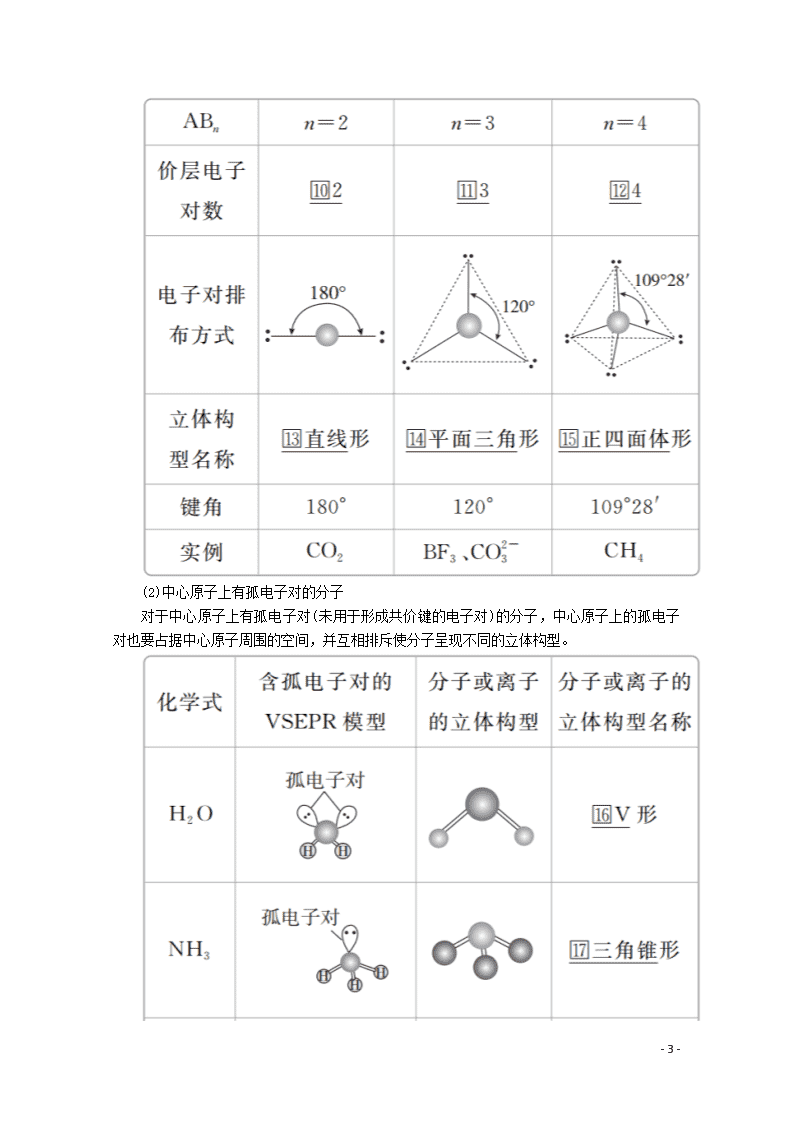
第1课时 价层电子对互斥理论 [明确学习目标] 1.认识共价分子结构的多样性和复杂性。2.能根据价层电子对互斥理论判断简单分子或离子的构型。 学生自主学习 一、形形色色的分子 1.三原子分子(AB2型) 2.四原子分子(AB3型) 3.五原子分子(AB4型) 最常见的为正四面体形,如甲烷分子的立体结构为正四面体形,键角为109°28′。 - 10 - 二、价层电子对互斥理论 1.价层电子对互斥理论(VSEPR) 分子中的价层电子对(包括σ键电子对和中心原子上的孤电子对)由于相互排斥而趋向尽可能彼此远离,分子尽可能采取对称的立体构型,以减小斥力。 2.价层电子对的确定方法 σ键电子对数可由分子式确定。 a表示中心原子的价电子数,对于主族元素来说,a=原子的最外层电子数;对于阳离子来说,a=中心原子的价电子数-离子电荷数;对于阴离子来说,a=中心原子的价电子数+|离子电荷数|。 x表示与中心原子结合的原子数。 b表示与中心原子结合的原子最多能接受的电子数,氢为1,其他原子=8-该原子的价电子数。 3.VSEPR模型预测分子或离子的立体构型 (1)中心原子上的价电子都用于形成共价键的分子 - 10 - (2)中心原子上有孤电子对的分子 对于中心原子上有孤电子对(未用于形成共价键的电子对)的分子,中心原子上的孤电子对也要占据中心原子周围的空间,并互相排斥使分子呈现不同的立体构型。 - 10 - 1.五原子的分子空间构型都是正四面体吗? 提示:不是,只有中心原子所连四个键的键长相等时才为正四面体。如CH3Cl因C—H键和C—Cl键键长不相等,故CH3Cl分子的四面体不再是正四面体。 2.VSEPR模型和分子的立体构型二者相同吗? 提示:不一定相同。(1)VSEPR模型指的是包括σ键电子对和孤电子对在内的空间构型;分子的立体构型指的是组成分子的所有原子(只考虑分子内的σ键)所形成的空间构型。 (2)若分子中没有孤电子对,VSEPR模型和分子立体构型一致;若分子中有孤电子对,VSEPR模型和分子立体构型不一致。 3.如何计算SO2的成键电子对数、孤电子对数、价层电子对数? 提示:SO2分子中的中心原子是S,成键电子对数为2。 孤电子对数=(a-xb)=×(6-2×2)=1, 价层电子对数=2+1=3。 课堂互动探究 一、形形色色的分子 1.四原子分子不一定都是平面三角形或三角锥形。如白磷(P4)分子,四个磷原子位于正四面体的四个顶点,键角为60°。 2.AB4型分子或离子CX4(X为卤素原子或氢原子)、SiCl4、SiH4、NH、SiO属于正四面体构型,AB4型分子(如CH4)中的B原子被其他原子取代后仍为四面体形,但不一定是正四面体形结构。 3.记住一些常见分子的立体构型及键角,则可推测组成相似的其他分子的立体构型。 如CO2与CS2、H2O与H2S、NH3与PH3、CH4与CCl4等。 [即时练] 1.下列分子的立体结构模型正确的是( ) A.CO2的立体结构模型: - 10 - B.H2O的立体结构模型: C.NH3的立体结构模型: D.CH4的立体结构模型: 答案 D 解析 CO2的立体构型为直线形,A不正确;H2O的立体构型为V形,B不正确;NH3的立体构型为三角锥形,C不正确;CH4的立体构型为正四面体形,D正确。 2.下列分子的空间构型是平面三角形的是( ) A.P4 B.C2H2 C.BF3 D.CH3Cl 答案 C 规律方法 常见的立体构型为直线形的分子有BeCl2、HCN、C2H2、CO2等;常见的立体构型为V形的分子有H2O、H2S、SO2等;常见的立体构型为平面三角形的分子有BF3、SO3等;常见的立体构型为三角锥形的分子有PH3、PCl3、NH3等;常见的立体构型为正四面体形的分子有CH4、CCl4、SiH4、SiF4等;是四面体形但不是正四面体形的有CH3Cl、CH2Cl2、CHCl3等。记住常见分子的立体构型可类推出同类别物质的立体构型。 二、根据价层电子对互斥理论判断分子的立体构型 (1)对于ABn型分子,利用VSEPR理论预测分子立体构型的思路:价层电子对数=σ键电子对数+孤电子对数VSEPR模型分子的立体构型。如H2O和NH3的中心原子上的价层电子对数都是4,这些价层电子对相互排斥(中心原子上的孤电子对也要占据中心原子周围的空间,并参与相互排斥),形成四面体形的VSEPR模型,略去该模型中的中心原子上的孤电子对,便可得H2O分子呈V形,NH3分子呈三角锥形,如下图所示。 - 10 - 常见分子的VSEPR模型和分子的立体构型如下表所示: - 10 - (2)当ABn型分子的中心原子上的价电子都用于形成共价键时(如CO2、CH4分子中的碳原子),它们的立体构型也可用中心原子周围的原子数n来预测,概括如下: [即时练] 3.用价层电子对互斥理论判断SO3的立体构型为( ) A.正四面体形 B.V形 C.三角锥形 D.平面三角形 答案 D 解析 SO3的中心原子硫原子的价电子数为6,与中心原子结合的原子数为3,氧原子最多能接受的电子数为2,则中心原子的孤电子对数=(6-3×2)=0,故价层电子对数=σ键电子对数=3,SO3的立体构型与其VSEPR模型一致,为平面三角形,故选D。 4.填写下列空白: - 10 - 答案 本课归纳总结 分子空间构型的确定方法 价层电子对数=σ键电子对数+中心原子上的孤电子对数 VSEPR模型分子的立体构型。 学习效果检测 1.下列分子的空间构型是直线形的是( ) A.CH4 B.C2H2 C.BF3 D.H2O 答案 B 解析 CH4的空间构型是正四面体,BF3的空间构型是平面三角形,H2O的空间构型是V形。 2.下列关于价电子对互斥理论的叙述不正确的是( ) A.价电子对互斥理论可用来预测分子的空间构型 - 10 - B.分子中中心原子的价电子对的相互排斥作用决定了分子的空间构型 C.中心原子上的孤电子对不参与相互排斥作用 D.分子中键角越大,价电子对之间的斥力越小,分子越稳定 答案 C 解析 中心原子上的孤电子对会占据中心原子周围的空间,并参与相互排斥作用。 3.下列常见分子的立体构型最相近的是( ) A.CO2和SO2 B.CH4和NH3 C.CH2O和BCl3 D.H2O和BeCl2 答案 C 解析 CO2和SO2的立体构型分别为直线形和V形,A错误;CH4和NH3的立体构型分别为正四面体形和三角锥形,B错误;CH2O和BCl3的立体构型均为平面三角形,其中后者为正三角形,C正确;H2O和BeCl2的立体构型分别为V形和直线形,D错误。 4.已知:①CS2 ②PCl3 ③H2S ④CH2O ⑤H3O+ ⑥NH ⑦BF3 ⑧SO2。请回答下列问题: (1)中心原子没有孤电子对的是________(填序号,下同)。 (2)立体构型为直线形的分子或离子有________;立体构型为平面三角形的分子或离子有________。 (3)立体构型为V形的分子或离子有________。 (4)立体构型为三角锥形的分子或离子有________。立体构型为正四面体形的分子或离子有________。 答案 (1)①④⑥⑦ (2)① ④⑦ (3)③⑧ (4)②⑤ ⑥ 解析 ①CS2的中心原子的价电子对数=2+=2,不含孤电子对,故为直线形;②PCl3的中心原子的价电子对数=3+=4,含1对孤电子对,故为三角锥形;③H2S的中心原子的价电子对数=2+=4,含2对孤电子对,故为V形结构;④CH2O的中心原子的价电子对数为3,不含孤电子对,故为平面三角形;⑤H3O+的中心原子的价电子对数=3+=4,含1对孤电子对,故为三角锥形;⑥NH的中心原子的价电子对数=4+=4,不含孤电子对,故为正四面体形;⑦BF3的中心原子的价电子对数=3+=3,不含孤电子对,故为平面三角形;⑧SO2的中心原子的价电子对数=2+=3,含1对孤电子对,故为V形结构。 - 10 - - 10 -查看更多