- 2021-07-09 发布 |
- 37.5 KB |
- 13页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
广东省茂名市五校联盟2019-2020学年高二下学期期末联考化学试题 Word版含答案
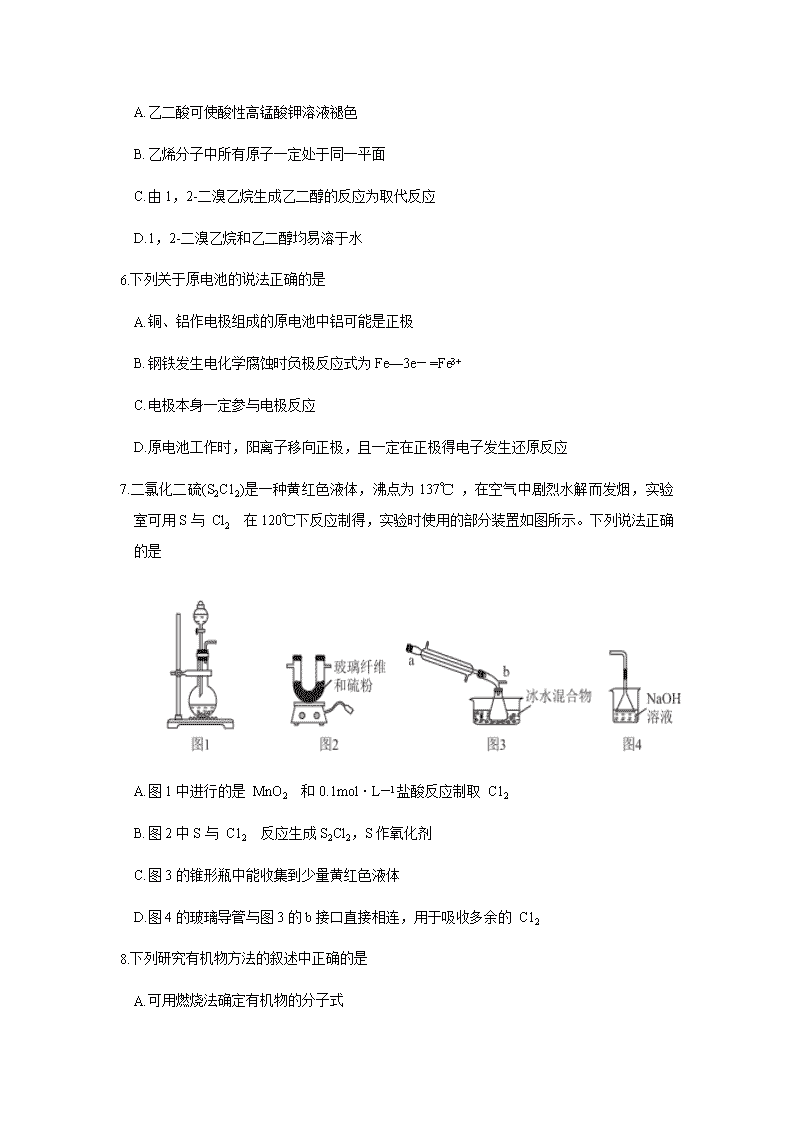
茂名市五校联盟2021届高二级第二学期联考 化学试卷 本试卷共20题。全卷满分100分。考试用时75分钟。 注意事项: 1. 答题前,先将自己的姓名、考号等填写在试题卷和答题卡上,并将准考证号条形码粘贴 在答题卡上的指定位置。 2. 选择题的作答:选出每小题答案后,用2B 铅笔把答题卡上对应题目的答案标号涂黑, 写在试题卷、草稿纸和答题卡上的非答题区域均无效。 3. 非选择题的作答:用签字笔直接写在答题卡上对应的答题区域内,写在试题卷、草稿纸 和答题卡上的非答题区域均无效。 4. 考试结束后,请将本试题卷和答题卡一并上交。 可能用到的相对原子质量:H 1 C 12 O 16 C1 35.5 第I卷 一、选择题:本题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意。 1.化学与科技、社会、生活有着密切联系。下列有关说法正确的是 A. 深度填埋未经分类的生活垃圾可防止环境污染 B. 75%的酒精和生理盐水均可用于餐具消毒以防控新型冠状病毒 C. 生物柴油属于烃类,是典型的“绿色能源” D. 生产医用外科口罩所用熔喷布的原料聚丙烯是有机高分子材料 2.按系统命名法,下列有机物的命名正确的是 A.3-乙基戊烷 B.2-甲基-3-乙基丁烷 C.3-乙基-1-丁炔 D.2,3-二甲基-3-戊烯 3.下列金属单质和金属化合物的应用不正确的是 A. 用热纯碱溶液清洗废铁屑表面的油污 B. 明矾既可用于净水,也可用于治疗胃酸过多 C. 常温下可用钢瓶贮存液氯 D. 生石灰可用作食品干燥剂 4.NO 和CO 都是汽车尾气中的有害物质,它们能缓慢的发生反应,反应的化学方程式为2CO(g)+2NO(g) N2(g)+2CO2(g),反应过程中的能量变化如图所示。下列说法不正确的是 A.该反应的ΔH<0 B.E1和E2分别表示无、有催化剂时反应的活化能 C. 增大压强可减小反应的活化能 D. 适当升高温度可加快反应速率 5.乙二酸是一种重要的化工原料,一种以乙烯为原料制备乙二酸的合成路线如图所示。下列 叙述不正确的是 CH2=CH2CH2BrCH2Br HOOCCOOH A. 乙二酸可使酸性高锰酸钾溶液褪色 B. 乙烯分子中所有原子一定处于同一平面 C. 由1,2-二溴乙烷生成乙二醇的反应为取代反应 D. 1,2-二溴乙烷和乙二醇均易溶于水 6.下列关于原电池的说法正确的是 A.铜、铝作电极组成的原电池中铝可能是正极 B. 钢铁发生电化学腐蚀时负极反应式为Fe—3e— =Fe3+ C. 电极本身一定参与电极反应 D. 原电池工作时,阳离子移向正极,且一定在正极得电子发生还原反应 7.二氯化二硫(S2C12)是一种黄红色液体,沸点为137℃ ,在空气中剧烈水解而发烟,实验室可用S与 Cl2 在120℃下反应制得,实验时使用的部分装置如图所示。下列说法正确的是 A. 图1中进行的是 MnO2 和0.1mol·L—1盐酸反应制取 C12 B. 图2中S与 C12 反应生成S2Cl2,S作氧化剂 C. 图3的锥形瓶中能收集到少量黄红色液体 D. 图4的玻璃导管与图3的b接口直接相连,用于吸收多余的 C12 8.下列研究有机物方法的叙述中正确的是 A. 可用燃烧法确定有机物的分子式 B. 可用蒸馏法分离提纯沸点相差较大的液态有机混合物 C. 可用质谱法测定有机物分子中的官能团 D. 可用核磁共振氢谱确定组成有机物的元素 9. 25℃、101 kPa时,1.00gCH4完全燃烧生成稳定的化合物放出55.6 kJ热量,下列热化学方程式正确正确的是 A. CH4 (g) + 2O2 (g) = CO2 (g) +2H2O (g) △H= - 889.6 kJ·mol- 1 B.CH4 (g)+ O2 (g) =CO2 (g)+ H2O(g) △H= -55.6 kJ·mol- 1 C. CH4 (g) + 2O2 (g) =CO2 (g) + 2H2O (1) △H= -889.6 kJ·mol- 1 D. CH4 (g) +2O2 (g) = CO2 (g) + 2H2O (1) △H= +889.6 kJ·mol- 1 10.关于反应2CH3OH(g)+3O2(g) 2CO2(g)+4H2O(1) △H<0,下列说法正确的是 A. v(CH3OH) : v (O2)=2:3,说明反应达到平衡状态 B. 该反应的 △S<0,所以任何条件下均不能自发进行 C. 该反应可设计成原电池,负极产物一定是 CO2 D. 标准状况下生成11.2 L CO2,转移电子的物质的量为3mo1 11.已知:由CO2制备甲烷的反应为 CO2(g)+4H2(g) CH4(g)+2H2O(g) △H <0。 一定温度下,在一容恒定的密闭容器中充入1mol CO2(g) 和4mo1H2(g)发生上述反应,反应达到平衡后,若要同时增大正反应速率和H2平衡转化率,下列措施合理的是 A. 通入一定量的氦气,增大压强 B. 将产物分离出来 C. 再充入1mo1 CO2(g) 和4mo1 H2(g) D. 适当降低温度 12.下列实验操作能达到实验目的的是 选项 实验目的 实验操作 A 提纯苯甲酸 将粗品溶于水、过滤、蒸发结晶 B 证明酸性:苯酚查看更多