- 2021-07-08 发布 |
- 37.5 KB |
- 8页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020版高考化学二轮复习专题强化训练18化学实验综合含解析
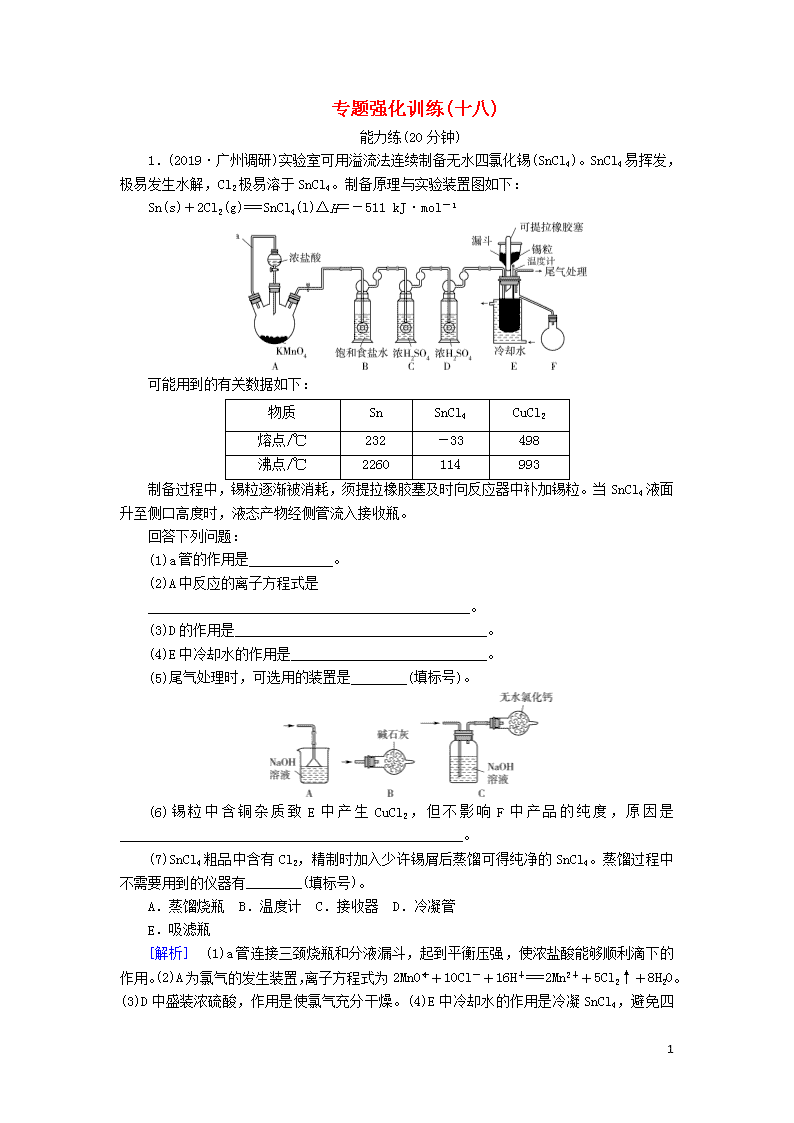
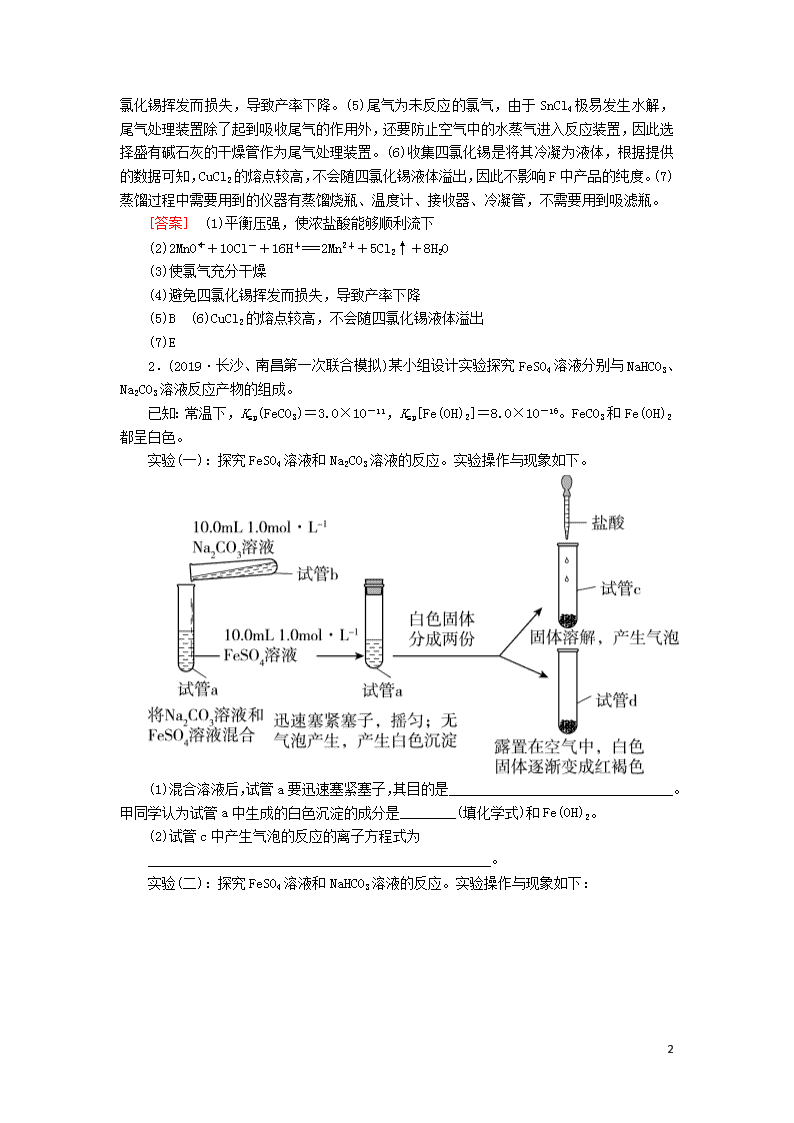
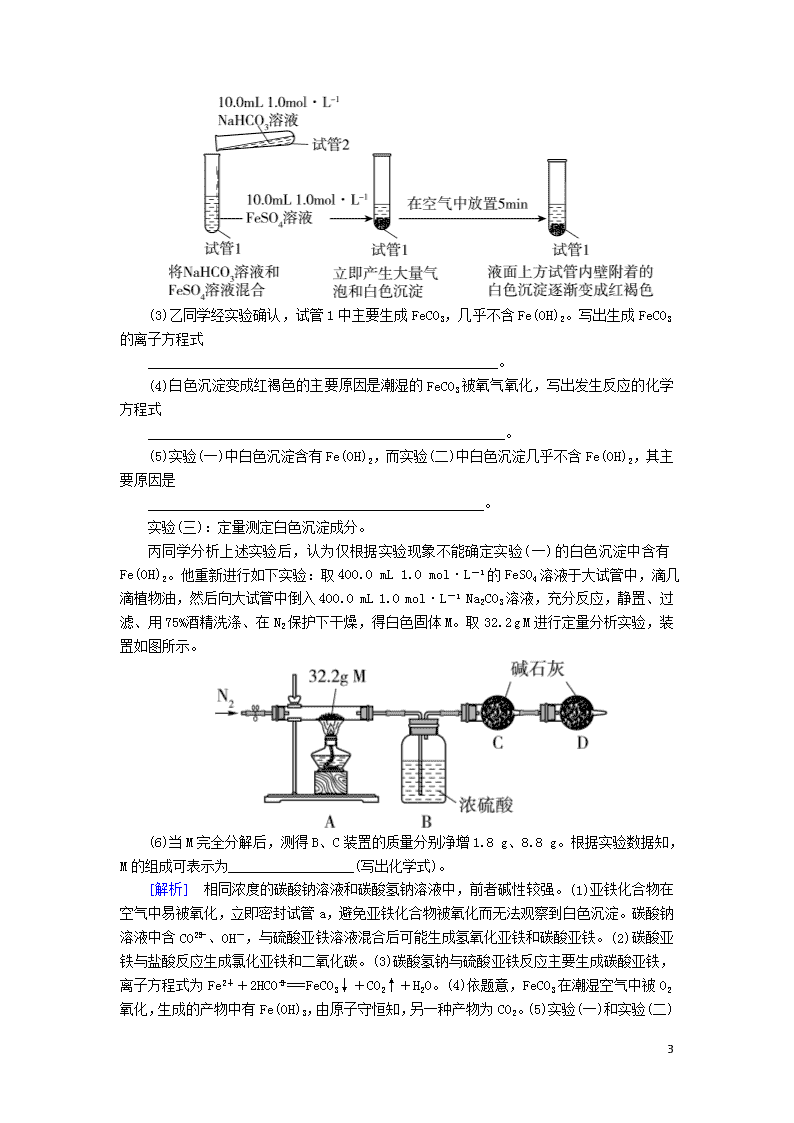
专题强化训练(十八) 能力练(20分钟) 1.(2019·广州调研)实验室可用溢流法连续制备无水四氯化锡(SnCl4)。SnCl4易挥发,极易发生水解,Cl2极易溶于SnCl4。制备原理与实验装置图如下: Sn(s)+2Cl2(g)===SnCl4(l)ΔH=-511 kJ·mol-1 可能用到的有关数据如下: 物质 Sn SnCl4 CuCl2 熔点/℃ 232 -33 498 沸点/℃ 2260 114 993 制备过程中,锡粒逐渐被消耗,须提拉橡胶塞及时向反应器中补加锡粒。当SnCl4液面升至侧口高度时,液态产物经侧管流入接收瓶。 回答下列问题: (1)a管的作用是____________。 (2)A中反应的离子方程式是 ______________________________________________。 (3)D的作用是____________________________________。 (4)E中冷却水的作用是____________________________。 (5)尾气处理时,可选用的装置是________(填标号)。 (6)锡粒中含铜杂质致E中产生CuCl2,但不影响F中产品的纯度,原因是_________________________________________________。 (7)SnCl4粗品中含有Cl2,精制时加入少许锡屑后蒸馏可得纯净的SnCl4。蒸馏过程中不需要用到的仪器有________(填标号)。 A.蒸馏烧瓶 B.温度计 C.接收器 D.冷凝管 E.吸滤瓶 [解析] (1)a管连接三颈烧瓶和分液漏斗,起到平衡压强,使浓盐酸能够顺利滴下的作用。(2)A为氯气的发生装置,离子方程式为2MnO+10Cl-+16H+===2Mn2++5Cl2↑+8H2O。(3)D中盛装浓硫酸,作用是使氯气充分干燥。(4)E中冷却水的作用是冷凝SnCl4 8 ,避免四氯化锡挥发而损失,导致产率下降。(5)尾气为未反应的氯气,由于SnCl4极易发生水解,尾气处理装置除了起到吸收尾气的作用外,还要防止空气中的水蒸气进入反应装置,因此选择盛有碱石灰的干燥管作为尾气处理装置。(6)收集四氯化锡是将其冷凝为液体,根据提供的数据可知,CuCl2的熔点较高,不会随四氯化锡液体溢出,因此不影响F中产品的纯度。(7)蒸馏过程中需要用到的仪器有蒸馏烧瓶、温度计、接收器、冷凝管,不需要用到吸滤瓶。 [答案] (1)平衡压强,使浓盐酸能够顺利流下 (2)2MnO+10Cl-+16H+===2Mn2++5Cl2↑+8H2O (3)使氯气充分干燥 (4)避免四氯化锡挥发而损失,导致产率下降 (5)B (6)CuCl2的熔点较高,不会随四氯化锡液体溢出 (7)E 2.(2019·长沙、南昌第一次联合模拟)某小组设计实验探究FeSO4溶液分别与NaHCO3、Na2CO3溶液反应产物的组成。 已知:常温下,Ksp(FeCO3)=3.0×10-11,Ksp[Fe(OH)2]=8.0×10-16。FeCO3和Fe(OH)2都呈白色。 实验(一):探究FeSO4溶液和Na2CO3溶液的反应。实验操作与现象如下。 (1)混合溶液后,试管a要迅速塞紧塞子,其目的是________________________________。甲同学认为试管a中生成的白色沉淀的成分是________(填化学式)和Fe(OH)2。 (2)试管c中产生气泡的反应的离子方程式为 _________________________________________________。 实验(二):探究FeSO4溶液和NaHCO3溶液的反应。实验操作与现象如下: 8 (3)乙同学经实验确认,试管1中主要生成FeCO3,几乎不含Fe(OH)2。写出生成FeCO3的离子方程式 __________________________________________________。 (4)白色沉淀变成红褐色的主要原因是潮湿的FeCO3被氧气氧化,写出发生反应的化学方程式 ___________________________________________________。 (5)实验(一)中白色沉淀含有Fe(OH)2,而实验(二)中白色沉淀几乎不含Fe(OH)2,其主要原因是 ________________________________________________。 实验(三):定量测定白色沉淀成分。 丙同学分析上述实验后,认为仅根据实验现象不能确定实验(一)的白色沉淀中含有Fe(OH)2。他重新进行如下实验:取400.0 mL 1.0 mol·L-1的FeSO4溶液于大试管中,滴几滴植物油,然后向大试管中倒入400.0 mL 1.0 mol·L-1 Na2CO3溶液,充分反应,静置、过滤、用75%酒精洗涤、在N2保护下干燥,得白色固体M。取32.2 g M进行定量分析实验,装置如图所示。 (6)当M完全分解后,测得B、C装置的质量分别净增1.8 g、8.8 g。根据实验数据知,M的组成可表示为__________________(写出化学式)。 [解析] 相同浓度的碳酸钠溶液和碳酸氢钠溶液中,前者碱性较强。(1)亚铁化合物在空气中易被氧化,立即密封试管a,避免亚铁化合物被氧化而无法观察到白色沉淀。碳酸钠溶液中含CO、OH-,与硫酸亚铁溶液混合后可能生成氢氧化亚铁和碳酸亚铁。(2)碳酸亚铁与盐酸反应生成氯化亚铁和二氧化碳。(3)碳酸氢钠与硫酸亚铁反应主要生成碳酸亚铁,离子方程式为Fe2++2HCO===FeCO3↓+CO2↑+H2O。(4)依题意,FeCO3在潮湿空气中被O2氧化,生成的产物中有Fe(OH)3,由原子守恒知,另一种产物为CO2 8 。(5)实验(一)和实验(二)中白色沉淀的成分不同的主要原因是相同浓度的碳酸钠溶液的碱性比碳酸氢钠强。(6)依题意,n(H2O)=0.1 mol,n(CO2)=0.2 mol,由此推知,A中硬质玻璃管中残留固体n(FeO)==0.3 mol,M的组成可表示为Fe(OH)2·2FeCO3。 [答案] (1)避免空气中氧气的干扰 FeCO3 (2)FeCO3+2H+===Fe2++CO2↑+H2O (3)Fe2++2HCO===FeCO3↓+CO2↑+H2O (4)4FeCO3+O2+6H2O===4Fe(OH)3+4CO2 (5)相同浓度的Na2CO3溶液的碱性比NaHCO3溶液的强(其他合理答案均可) (6)Fe(OH)2·2FeCO3 拔高练(25分钟) 1.(2019·山东九校联考)MMA(甲基丙烯酸甲酯,简称甲甲酯)是合成PMMA(有机玻璃)的单体,某小组拟在实验室制备甲甲酯。已知几种物质的部分信息如表所示: 实验步骤: ①量取86.0 mL甲基丙烯酸倒入烧杯中,在不断搅拌下加入5 mL浓硫酸,冷却至室温; ②取50.0 mL甲醇注入步骤①所得的混合溶液中,并不断搅拌至混合均匀; ③将步骤②所得的混合溶液注入如图装置中,加入几块碎瓷片,控制温度为105℃左右,持续加热,充分反应; 8 ④纯化产品,称得产品质量为70.4 g。 回答下列问题: (1)仪器a的名称是________。 (2)从油水分离器中及时分离出________(填“上”或“下”)层水,其目的是______________________________。如果反应温度控制不好,可能有副产物________(填一种)等产生。 (3)写出制备MMA的化学方程式 ____________________________________________________。 (4)如果油水分离器中油层不再增厚,则表明____________。 (5)纯化产品的流程如下: ①用“饱和碳酸钠溶液洗涤”的目的是____________; ②完成操作C需要下列装置中的________(填字母)。 (6)本实验中甲基丙烯酸甲酯的产率约为________(填字母)。 a.56% b.61% c.70.% d.72% [解析] 8 (1)仪器a的名称是球形冷凝管。(2)利用油水分离器能及时从酯化反应的平衡体系中分离出水,促使酯化反应的平衡向右移动,提高原料利用率(或产率)。反应温度控制不好,甲醇可能会生成二甲醚、CO2等副产物。(3)甲基丙烯酸和甲醇发生酯化反应,酯化反应是可逆反应。(4)观察油水分离器中油层厚度,如果油层厚度不再增加,表明反应达到平衡。(5)①第一次水洗除去产品中大量可溶于水的杂质,用饱和碳酸钠溶液洗涤,除去少量酸性杂质;第二次水洗,除去碳酸钠杂质;用无水硫酸镁吸水后蒸馏得到产品。②操作C是分离两种互不相溶的液体,应采用分液操作。在题给四种装置中,a为过滤装置,b为蒸发装置,c为蒸馏装置,d为分液装置。(6)分析起始加入反应物的量知,甲醇过量,计算产品的理论产量时按甲基丙烯酸的量计算,产品理论质量m=86.0 mL×1.01 g·cm-3×=101 g。甲基丙烯酸甲酯的产率为×100%≈70%。 [答案] (1)球形冷凝管 (2)下 促使酯化反应的平衡向右移动,提高原料利用率(其他合理答案均可) CH3OCH3或CO2 (3)CH2===C(CH3)COOH+CH3OHCH2===C(CH3)COOCH3+H2O (4)酯化反应达到平衡 (5)①除去产品中残留的酸性杂质 ②d (6)c 2.(2019·湖北质量检测二)某实验课题小组的同学在实验室利用新制备的硫酸亚铁溶液制备硫酸亚铁铵(俗名为莫尔盐)[(NH4)2SO4·FeSO4·6H2O](相对分子质量为392),该晶体比一般亚铁盐稳定,易溶于水,不溶于乙醇。 (一)制备硫酸亚铁溶液(实验步骤如下) (1)步骤①,加入稀硫酸的目的是____________。 (2)步骤②,加入还原铁屑后观察到的现象是________________________________。实验前,常用碱溶液洗涤铁屑,其目的是______________________________________。 (二)制备莫尔盐(硫酸亚铁铵) (3)在FeSO4溶液中加入稍过量的硫酸铵饱和溶液。从溶液中提取(NH4)2SO4·FeSO4·6H2O的具体操作是________、用乙醇洗涤、干燥。 (三)检验莫尔盐加热时的分解产物 莫尔盐受热分解,甲同学认为分解产物可能有以下几种情况: a.Fe2O3、SO3、NH3、H2O b.FeO、NH3、SO3、H2O c.FeO、SO2、NH3、H2O d.Fe2O3、NH3、SO2、SO3、H2O (4)经认真分析,推理即可确定猜想________(填序号)不成立。 (5)乙同学认为莫尔盐分解的产物中可能含有SO3(g)、SO2(g)及N2 8 (g)。为验证产物的存在,乙同学用下列装置进行实验: ①乙同学的实验中,装置依次连接的合理顺序为A→H→________→G。 ②证明分解产物中含有SO3的实验现象是 ___________________________________________________。 (四)测定实验(二)所得晶体中(NH4)2SO4·FeSO4·6H2O的纯度称取m g硫酸亚铁铵样品配制成500 mL溶液,取20.00 mL样品溶液进行实验,装置如图所示。 (6)若实验测得NH3的体积为V L(已折算为标准状况下),则该硫酸亚铁铵样品的纯度为________(列出计算式即可)。 [解析] (1)步骤①,加入稀硫酸的目的是抑制Fe3+的水解。(2)步骤②,加入还原铁屑后,铁屑和酸及Fe3+反应,观察到的现象是铁屑逐渐溶解,溶液由黄色逐渐变为浅绿色,有无色气体生成。碱溶液可以洗去铁屑表面的油污。(3)通过蒸发浓缩、冷却结晶、过滤、洗涤、干燥,可以从溶液中获得硫酸亚铁铵。(4)a.如果分解产物是Fe2O3、SO3、NH3、H2O四种物质,则只有Fe元素的化合价升高,没有化合价降低的元素,是不可能的;c.如果分解产物是FeO、SO2、NH3、H2O四种物质,则只有S元素的化合价降低,没有化合价升高的元素,是不可能的,故猜想a、c不 成立。(5)①乙同学认为莫尔盐分解的产物中可能含有SO3(g)、SO2(g)及N2(g),用BaCl2与足量盐酸的混合液检验SO3(g),用品红溶液检验SO2(g),N2难溶于水,用排水法收集;由于SO3能被水溶液吸收,所以应先检验SO3(g),再检验SO2(g),用NaOH溶液除去SO2后,用排水法收集N2,故装置的合理连接顺序为A→H→F→D→E→G。(6)标准状况下V L氨气的物质的量为= mol,m g硫酸亚铁铵样品中N元素的物质的量为× mol= mol,则该硫酸亚铁铵样品的纯度为 8 ×100%=×100%。 [答案] (1)抑制Fe3+的水解 (2)铁粉逐渐溶解,溶液由黄色逐渐变为浅绿色,有无色气体生成 除去铁屑表面的油污 (3)蒸发浓缩、冷却结晶、过滤 (4)ac (5)①F→D→E ②F中出现白色沉淀 (6)×100% 8查看更多