- 2021-07-08 发布 |
- 37.5 KB |
- 24页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届一轮复习苏教版微粒间作用力与物质的性质
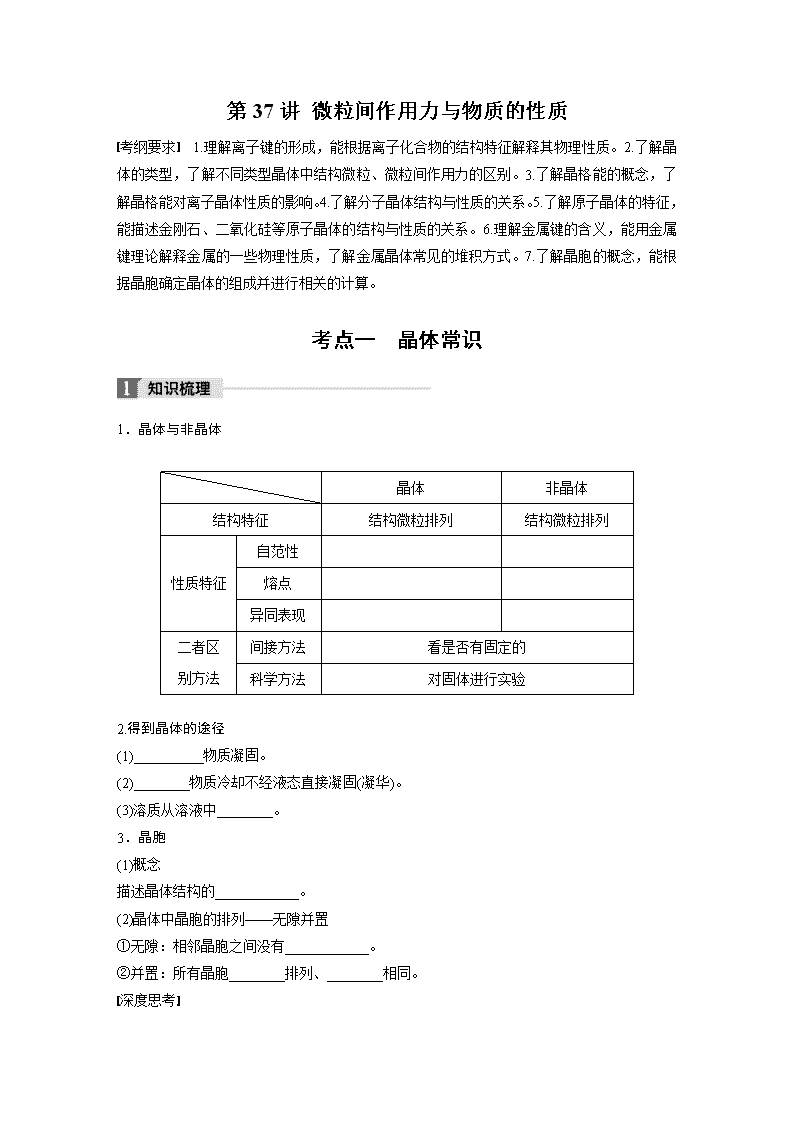
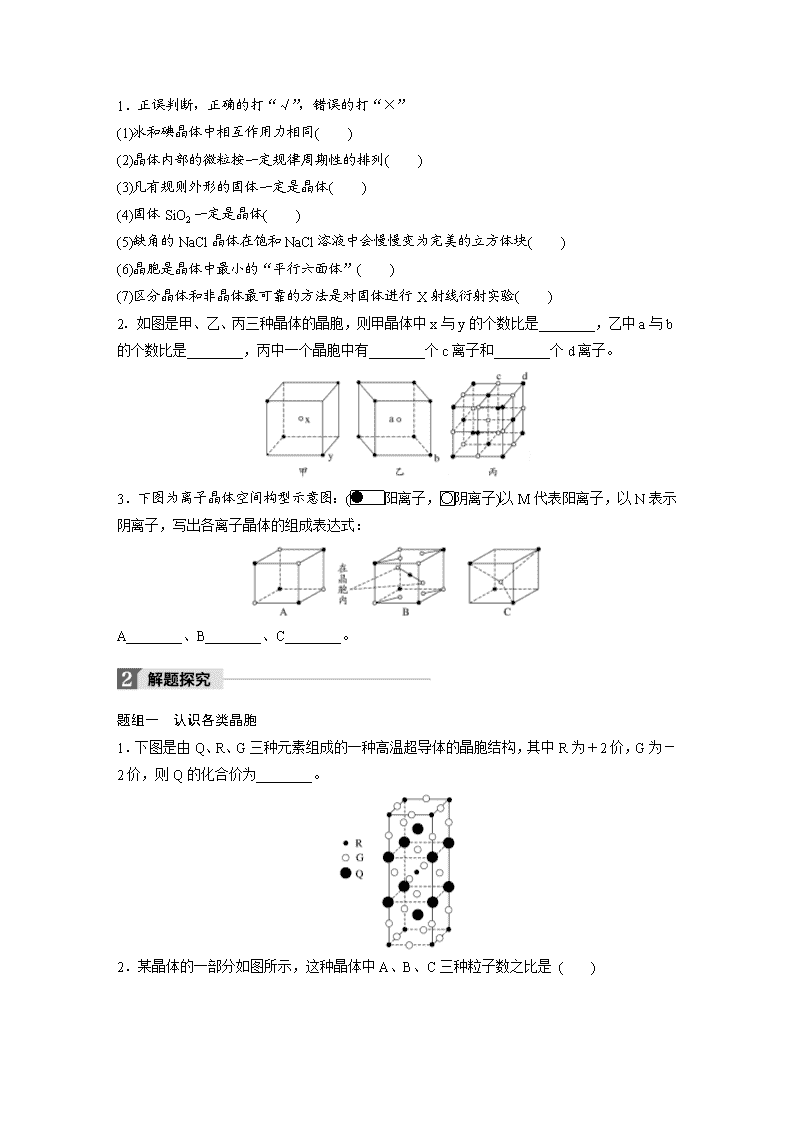
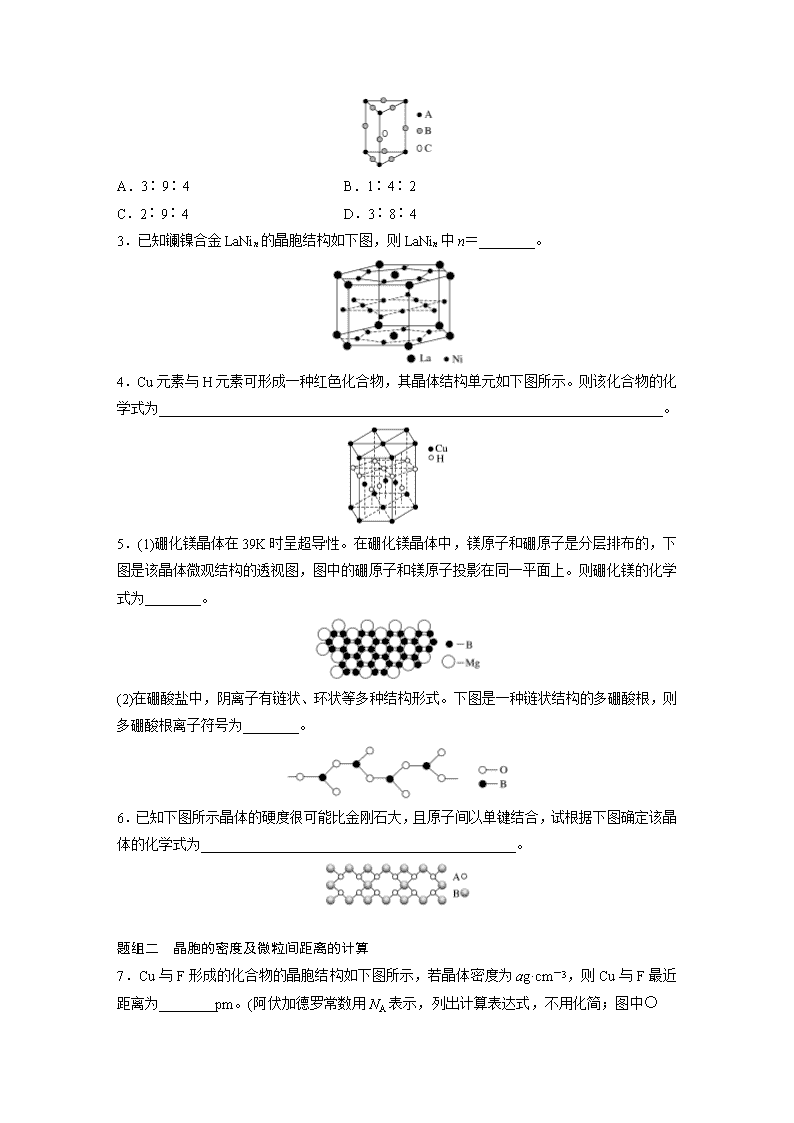
第37讲 微粒间作用力与物质的性质 考纲要求 1.理解离子键的形成,能根据离子化合物的结构特征解释其物理性质。2.了解晶体的类型,了解不同类型晶体中结构微粒、微粒间作用力的区别。3.了解晶格能的概念,了解晶格能对离子晶体性质的影响。4.了解分子晶体结构与性质的关系。5.了解原子晶体的特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。6.理解金属键的含义,能用金属键理论解释金属的一些物理性质,了解金属晶体常见的堆积方式。7.了解晶胞的概念,能根据晶胞确定晶体的组成并进行相关的计算。 考点一 晶体常识 1.晶体与非晶体 晶体 非晶体 结构特征 结构微粒排列 结构微粒排列 性质特征 自范性 熔点 异同表现 二者区 别方法 间接方法 看是否有固定的 科学方法 对固体进行实验 2.得到晶体的途径 (1)__________物质凝固。 (2)________物质冷却不经液态直接凝固(凝华)。 (3)溶质从溶液中________。 3.晶胞 (1)概念 描述晶体结构的____________。 (2)晶体中晶胞的排列——无隙并置 ①无隙:相邻晶胞之间没有____________。 ②并置:所有晶胞________排列、________相同。 深度思考 1.正误判断,正确的打“√”,错误的打“×” (1)冰和碘晶体中相互作用力相同( ) (2)晶体内部的微粒按一定规律周期性的排列( ) (3)凡有规则外形的固体一定是晶体( ) (4)固体SiO2一定是晶体( ) (5)缺角的NaCl晶体在饱和NaCl溶液中会慢慢变为完美的立方体块( ) (6)晶胞是晶体中最小的“平行六面体”( ) (7)区分晶体和非晶体最可靠的方法是对固体进行X射线衍射实验( ) 2.如图是甲、乙、丙三种晶体的晶胞,则甲晶体中x与y的个数比是________,乙中a与b的个数比是________,丙中一个晶胞中有________个c离子和________个d离子。 3.下图为离子晶体空间构型示意图:(阳离子,阴离子)以M代表阳离子,以N表示阴离子,写出各离子晶体的组成表达式: A________、B________、C________。 题组一 认识各类晶胞 1.下图是由Q、R、G三种元素组成的一种高温超导体的晶胞结构,其中R为+2价,G为-2价,则Q的化合价为________。 2.某晶体的一部分如图所示,这种晶体中A、B、C三种粒子数之比是 ( ) A.3∶9∶4 B.1∶4∶2 C.2∶9∶4 D.3∶8∶4 3.已知镧镍合金LaNin的晶胞结构如下图,则LaNin中n=________。 4.Cu元素与H元素可形成一种红色化合物,其晶体结构单元如下图所示。则该化合物的化学式为________________________________________________________________________。 5.(1)硼化镁晶体在39K时呈超导性。在硼化镁晶体中,镁原子和硼原子是分层排布的,下图是该晶体微观结构的透视图,图中的硼原子和镁原子投影在同一平面上。则硼化镁的化学式为________。 (2)在硼酸盐中,阴离子有链状、环状等多种结构形式。下图是一种链状结构的多硼酸根,则多硼酸根离子符号为________。 6.已知下图所示晶体的硬度很可能比金刚石大,且原子间以单键结合,试根据下图确定该晶体的化学式为_____________________________________________。 题组二 晶胞的密度及微粒间距离的计算 7.Cu与F形成的化合物的晶胞结构如下图所示,若晶体密度为ag·cm-3,则Cu与F最近距离为________pm。(阿伏加德罗常数用NA表示,列出计算表达式,不用化简;图中为 Cu,为F) 8.如图为Na2S的晶胞,该晶胞与CaF2晶胞结构相似,设晶体密度是ρg·cm-3,试计算Na+与S2-的最短距离为________cm(阿伏加德罗常数用NA表示,只写出计算式)。 晶胞计算的思维方法 (1)晶胞计算是晶体考查的重要知识点之一,也是考查学生分析问题、解决问题能力的较好素材。晶体结构的计算常常涉及如下数据:晶体密度、NA、M、晶体体积、微粒间距离、微粒半径、夹角等,密度的表达式往往是列等式的依据。解决这类题,一是要掌握晶体“切割法”的原理,二是要有扎实的立体几何知识,三是要熟悉常见晶体的结构特征,并能融会贯通,举一反三。 (2)“切割法”原理 特别提醒 ①在使用切割法计算晶胞中微粒个数时,要注意晶胞的形状,不同形状的晶胞,应先分析任意位置上的一个粒子被几个晶胞所共有,如六棱柱晶胞中,顶点、侧棱、底面上的棱、面心依次被6、3、4、2个晶胞所共有。 ②在计算晶胞中粒子个数的过程中,不是任何晶胞都可用均摊法。 (3)晶体微粒与M、ρ之间的关系 若1个晶胞中含有x个微粒,则1mol晶胞中含有xmol微粒,其质量为xMg(M为微粒的相对“分子”质量);1个晶胞的质量为ρa3g(a3为晶胞的体积,ρ为晶胞的密度),则1mol晶胞的质量为ρa3NAg,因此有xM=ρa3NA。 考点二 晶体的组成和性质 1.四类晶体的比较 类型 比较 分子晶体 原子晶体 金属晶体 离子晶体 构成粒子 粒子间的相互作用力 硬度 有的,有的 熔、沸点 有的,有的 溶解性 相似相溶 难溶于任何溶剂 常见溶剂难溶 大多数易溶于水等极性溶剂 导电、导热性 一般不导电,溶于水后有的导电 一般不具有导电性,个别为半导体 电和热的良导体 晶体不导电,水溶液或熔融态导电 物质类 别及举例 所有非金属氢化物(如水、硫化氢)、部分非金属单质(如卤素X2)、部分非金属氧化物(如CO2、SO2)、几乎所有的酸、绝大多数有机物(有机盐除外) 部分非金属单质(如金刚石、硅、晶体硼),部分非金属化合物(如SiC、SiO2) 金属单质与合金(如Na、Al、Fe、青铜) 金属氧化物(如K2O、Na2O)、强碱(如KOH、NaOH)、绝大部分盐(如NaCl) 2.离子晶体的晶格能 (1)定义 气态离子形成1mol离子晶体释放的能量,通常取正值,单位:____________。 (2)影响因素 ①离子所带电荷数:离子所带电荷数越多,晶格能越________。 ②离子的半径:离子的半径越________,晶格能越大。 (3)与离子晶体性质的关系 晶格能越大,形成的离子晶体越________,且熔点越高,硬度越________。 深度思考 1.正误判断,正确的打“√”,错误的打“×” (1)在晶体中只要有阴离子就一定有阳离子( ) (2)在晶体中只要有阳离子就一定有阴离子( ) (3)原子晶体的熔点一定比金属晶体的高( ) (4)分子晶体的熔点一定比金属晶体的低( ) (5)离子晶体一定都含有金属元素( ) (6)金属元素和非金属元素组成的晶体不一定是离子晶体( ) (7)原子晶体的熔点一定比离子晶体的高( ) (8)金属晶体的熔点不一定比分子晶体的高( ) 2.在下列物质中:NaCl、NaOH、Na2S、H2O2、Na2S2、(NH4)2S、CO2、CCl4、C2H2、SiO2、SiC、晶体硅、金刚石,晶体氩。 (1)其中只含有离子键的离子晶体是_______________________________________。 (2)其中既含有离子键又含有极性共价键的离子晶体是________________________。 (3)其中既含有离子键又含有极性共价键和配位键的离子晶体是__________。 (4)其中既含有离子键又含有非极性共价键的离子晶体是__________。 (5)其中含有极性共价键的非极性分子是______________________________。 (6)其中含有极性共价键和非极性共价键的非极性分子是________。 (7)其中含有极性共价键和非极性共价键的极性分子是________________________。 (8)其中含有极性共价键的原子晶体是_________________________________________。 (9)不含共价键的分子晶体是__________,只含非极性键的原子晶体是____________。 题组一 晶体类型的判断 1.分析下列物质的物理性质,判断其晶体类型。 (1)碳化铝,黄色晶体,熔点2200℃,熔融态不导电:________。 (2)溴化铝,无色晶体,熔点98℃,熔融态不导电:______________________________。 (3)五氟化矾,无色晶体,熔点19.5℃,易溶于乙醇、氯仿、丙酮等:________。 (4)溴化钾,无色晶体,熔融时或溶于水中都能导电:________。 (5)SiI4:熔点120.5℃,沸点287.4℃,易水解:_____________________________________。 (6)硼:熔点2300℃,沸点2550℃,硬度大:__________________________________________。 (7)硒:熔点217℃,沸点685℃,溶于氯仿:____________________________________。 (8)锑:熔点630.74℃,沸点1750℃,导电:_______________________________________。 2.现有几组物质的熔点(℃)数据: A组 B组 C组 D组 金刚石:3550℃ Li:181℃ HF:-83℃ NaCl:801℃ 硅晶体:1410℃ Na:98℃ HCl:-115℃ KCl:776℃ 硼晶体:2300℃ K:64℃ HBr:-89℃ RbCl:718℃ 二氧化硅:1723℃ Rb:39℃ HI:-51℃ CsCl:645℃ 据此回答下列问题: (1)A组属于________晶体,其熔化时克服的微粒间的作用力是________。 (2)B组晶体共同的物理性质是________(填序号)。 ①有金属光泽 ②导电性 ③导热性 ④延展性 (3)C组中HF熔点反常是由于__________________________________________________。 (4)D组晶体可能具有的性质是__________(填序号)。 ①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电 (5)D组晶体的熔点由高到低的顺序为NaCl>KCl>RbCl>CsCl,其原因为_________________________________________。 晶体类型的5种判断方法 (1)依据构成晶体的微粒和微粒间的作用判断 ①离子晶体的构成微粒是阴、阳离子,微粒间的作用是离子键。 ②原子晶体的构成微粒是原子,微粒间的作用是共价键。 ③分子晶体的构成微粒是分子,微粒间的作用为分子间作用力。 ④金属晶体的构成微粒是金属阳离子和自由电子,微粒间的作用是金属键。 (2)依据物质的分类判断 ①金属氧化物(如K2O、Na2O2等)、强碱(NaOH、KOH等)和绝大多数的盐类是离子晶体。 ②大多数非金属单质(除金刚石、石墨、晶体硅等)、非金属氢化物、非金属氧化物(除SiO2外)、几乎所有的酸、绝大多数有机物(除有机盐外)是分子晶体。 ③常见的单质类原子晶体有金刚石、晶体硅、晶体硼等,常见的化合类原子晶体有碳化硅、二氧化硅等。 ④金属单质是金属晶体。 (3)依据晶体的熔点判断 ①离子晶体的熔点较高。 ②原子晶体的熔点很高。 ③分子晶体的熔点低。 ④金属晶体多数熔点高,但也有少数熔点相当低。 (4)依据导电性判断 ①离子晶体溶于水及熔融状态时能导电。 ②原子晶体一般为非导体。 ③分子晶体为非导体,而分子晶体中的电解质(主要是酸和强极性非金属氢化物)溶于水,使分子内的化学键断裂形成自由移动的离子,也能导电。 ④金属晶体是电的良导体。 (5)依据硬度和机械性能判断 ①离子晶体硬度较大、硬而脆。 ②原子晶体硬度大。 ③分子晶体硬度小且较脆。 ④金属晶体多数硬度大,但也有较低的,且具有延展性。 注意 (1)常温下为气态或液态的物质,其晶体应属于分子晶体(Hg除外)。 (2)石墨属于混合型晶体,但因层内原子之间碳碳共价键的键长为1.42×10-10m,比金刚石中碳碳共价键的键长(键长为1.54×10-10m)短,所以熔、沸点高于金刚石。 (3)AlCl3晶体中虽含有金属元素,但属于分子晶体,熔、沸点低(熔点190℃)。 (4)合金的硬度比其成分金属大,熔、沸点比其成分金属低。 题组二 晶体熔、沸点的比较 3.下列分子晶体中,关于熔、沸点高低的叙述中,正确的是( ) A.Cl2>I2 B.SiCl4<CCl4 C.NH3>PH3 D.C(CH3)4>CH3CH2CH2CH2CH3 4.离子晶体熔点的高低取决于晶体中晶格能的大小。判断KCl、NaCl、CaO、BaO四种晶体熔点的高低顺序是 ( ) A.KCl>NaCl>BaO>CaO B.NaCl>KCl>CaO>BaO C.CaO>BaO>NaCl>KCl D.CaO>BaO>KCl>NaCl 5.下列各组物质中,按熔点由低到高的顺序排列正确的是( ) ①O2、I2、Hg ②CO、KCl、SiO2 ③Na、K、Rb ④Na、Mg、Al A.①③ B.①④ C.②③ D.②④ 分类比较晶体的熔、沸点 (1)不同类型晶体的熔、沸点高低的一般规律 原子晶体>离子晶体>分子晶体。 金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,如汞、镓、铯等熔、沸点很低,金属晶体一般不参与比较。 (2)原子晶体 由共价键形成的原子晶体中,原子半径小的键长短,键能大,晶体的熔、沸点高。如熔点:金刚石>石英>碳化硅>硅。 (3)离子晶体 一般地说,阴、阳离子所带电荷数越多,离子半径越小,则离子间的作用就越强,其离子晶体的熔、沸点就越高,如熔点:MgO>MgCl2>NaCl>CsCl。 (4)分子晶体 ①分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体,熔、沸点反常的高。如H2O>H2Te>H2Se>H2S。 ②组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高,如SnH4>GeH4>SiH4>CH4,F2<Cl2<Br2<I2。 ③组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高,如CO>N2,CH3OH>CH3CH3。 ④同分异构体,支链越多,熔、沸点越低。 如:CH3—CH2—CH2—CH2—CH3> 。 考点三 突破五类晶体模型 1.原子晶体(金刚石和二氧化硅) (1)金刚石晶体中,每个C与另外____个C形成共价键,C—C键之间的夹角是109.5°,最小的环是______元环。含有1molC的金刚石中,形成的共价键有________mol。 (2)SiO2晶体中,每个Si原子与________个O成键,每个O原子与________个硅原子成键,最小的环是________元环,在“硅氧”四面体中,处于中心的是________原子,1molSiO2中含有________molSi—O键。 2.分子晶体 (1)干冰晶体中,每个CO2分子周围等距且紧邻的CO2分子有________个。 (2)冰的结构模型中,每个水分子与相邻的________个水分子以氢键相连接,含1molH2O的冰中,最多可形成________mol“氢键”。 3.离子晶体 (1)NaCl型:在晶体中,每个Na+同时吸引______个Cl-,每个Cl-同时吸引______个Na+,配位数为______。每个晶胞含________个Na+和________个Cl-。 (2)CsCl型:在晶体中,每个Cl-吸引________个Cs+,每个Cs+吸引________个Cl-,配位数为________。 4.石墨晶体 石墨层状晶体中,层与层之间的作用是______________,平均每个正六边形拥有的碳原子个数是________,C原子采取的杂化方式是________。 5.常见金属晶体的原子堆积模型 结构型式 常见金属 配位数 晶胞 面心立方最密堆积 Cu、Ag、Au 12 体心立 方堆积 Na、K、Fe 8 六方最 密堆积 Mg、Zn、Ti 12 特别提醒 (1)判断某种微粒周围等距且紧邻的微粒数目时,要注意运用三维想象法。如NaCl晶体中,Na+周围的Na+数目(Na+用“○”表示): 每个面上有4个,共计12个。 (2)常考的几种晶体主要有干冰、冰、金刚石、SiO2、石墨、CsCl、NaCl、K、Cu等,要熟悉以上代表物的空间结构。当题中信息给出与某种晶体空间结构相同时,可以直接套用某种结构。 深度思考 1.正误判断,正确的打“√”,错误的打“×” (1)在金属钠形成的晶体中,每个钠原子周围与其距离最近的钠原子有8个( ) (2)在NaCl晶体中,每个Na+周围与其距离最近的Na+有12个( ) (3)在CsCl晶体中,每个Cs+周围与其距离最近的Cl-有8个( ) (4)金属镁形成的晶体中,每个镁原子周围与其最近的镁原子有6个( ) 2.在晶体模型中,金刚石中的“棍”和干冰中的“棍” 表示的意义一样吗?分子晶体中有化学键吗? 3.下列排列方式中:A.ABCABCABC B.ABABABABAB C.ABBAABBA D.ABCCBAABCCBA,属于镁型堆积型式的是________;属于铜型堆积型式的是_____________________________________________。 题组一 强化记忆晶体结构 1.判断下列物质的晶胞结构,将对应序号填在线上。 (1)干冰晶体________; (2)氯化钠晶体________; (3)金刚石________; (4)碘晶体________; (5)氟化钙________; (6)钠________; (7)冰晶体________; (8)水合铜离子________; (9)H3BO3晶体________; (10)铜晶体________。 2.碳的第三种同素异形体——金刚石,其晶胞如图丁所示。已知金属钠的晶胞(体心立方堆积)沿其体对角线垂直在纸平面上的投影图如图A所示,则金刚石晶胞沿其体对角线垂直在纸平面上的投影图应该是图________(从A~D图中选填)。 题组二 晶胞中原子半径及空间利用率的计算 3.用晶体的X射线衍射法对Cu的测定得到以下结果:Cu的晶胞为面心立方最密堆积(如下图),已知该晶体的密度为9.00g·cm-3,晶胞中该原子的配位数为________;Cu的原子半径为________cm(阿伏加德罗常数为NA,要求列式计算)。 4.[2016·全国卷Ⅲ,37(5)]GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGag·mol-1和MAsg·mol-1,原子半径分别为rGapm和rAspm,阿伏加德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为________________________________________________________________________。 晶体结构的相关计算 (1)晶胞质量=晶胞占有的微粒的质量=晶胞占有的微粒数×。 (2)空间利用率=。 (3)金属晶体中体心立方堆积、面心立方堆积中的几组公式(设棱长为a,原子半径为r) ①面对角线长=a。 ②体对角线长=a。 ③体心立方堆积4r=a ④面心立方堆积4r=a。 1.[2016·全国卷Ⅰ,37(6)]晶胞有两个基本要素: ①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(,0,);C为(,,0)。则D原子的坐标参数为________。 ②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76pm,其密度为________________________________________________________________________ g·cm-3(列出计算式即可)。 2.[2016·全国卷Ⅱ,37(4)]某镍白铜合金的立方晶胞结构如图所示。 ①晶胞中铜原子与镍原子的数量比为________。 ②若合金的密度为dg·cm-3,晶胞参数a=________nm。 3.[2016·全国卷Ⅲ,37(4)]GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是________________________________________________________________________。 4.(2016·四川理综,8)M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s轨道电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。请回答下列问题: (1)R基态原子的电子排布式是___________,X和Y中电负性较大的是________(填元素符号)。 (2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是________________________________________________________。 (3)X与M形成的XM3分子的空间构型是________。 (4)M和R所形成的一种离子化合物R2M晶体的晶胞如图所示,则图中黑球代表的离子是________(填离子符号)。 (5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是_______________________________________。 5.(2016·海南,19-Ⅱ)M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题: (1)单质M的晶体类型为________,晶体中原子间通过________作用形成面心立方密堆积,其中M原子的配位数为________。 (2)元素Y基态原子的核外电子排布式为_____________________________________, 其同周期元素中,第一电离能最大的是________(写元素符号)。元素Y的含氧酸中,酸性最强的是________(写化学式),该酸根离子的立体构型为________。 (3)M与Y形成的一种化合物的立方晶胞如图所示。 ①该化合物的化学式为________,已知晶胞参数a=0.542nm,此晶体的密度为__________________________________________________g·cm-3。 (写出计算式,不要求计算结果。阿伏加德罗常数为NA) ②该化合物难溶于水但易溶于氨水,其原因是____________________________________。 此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为________________________________________________________________________。 6.[2015·全国卷Ⅰ,37(4)(5)]碳及其化合物广泛存在于自然界中,回答下列问题: (4)CO能与金属Fe形成Fe(CO)5,该化合物熔点为253K,沸点为376K,其固体属于________晶体。 (5)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示: ①在石墨烯晶体中,每个C原子连接________个六元环,每个六元环占有________个C原子。 ②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接________个六元环,六元环中最多有________个C原子在同一平面。 7.[2015·海南,19—Ⅱ(2)(3)(4)](2)钒的某种氧化物的晶胞结构如图1所示。晶胞中实际拥有的阴、阳离子个数分别为________、________。 (3)V2O5常用作SO2转化为SO3的催化剂。SO2分子中S原子价层电子对数是________对,分子的立体构型为________;SO3气态为单分子,该分子中S原子的杂化轨道类型为________;SO3的三聚体环状结构如图2所示,该结构中S原子的杂化轨道类型为________;该结构中S—O键长有两类,一类键长约140pm,另一类键长约160pm,较短的键为________(填图2 中字母),该分子中含有________个σ键。 (4)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为________;也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构,则偏钒酸钠的化学式为 ________________________________________________________________________。 8.[2014·新课标全国卷Ⅰ,37(3)(4)节选](3)Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有______个铜原子。 (4)Al单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为______。列式表示Al单质的密度____________________________g·cm-3(不必计算出结果)。 9.[2014·新课标全国卷Ⅱ,37(4)(5)]周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。回答下列问题: (4)e和c形成的一种离子化合物的晶体结构如图1,则e离子的电荷为________。 (5)这5种元素形成的一种1∶1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构(如图2所示)。 该化合物中,阴离子为________,阳离子中存在的化学键类型有__________________;该化合物加热时首先失去的组分是________,判断理由是_____________________________。 10.[2013·新课标全国卷Ⅰ,37(3)(6)](3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以____________相结合,其晶胞中共有8个原子,其中在面心位置贡献____________个原子。 (6)在硅酸盐中,SiO四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根:其中Si原子的杂化形式为______________,Si与O的原子数之比为______________,化学式为________________________________________________________________________。 11.(2015·全国卷Ⅱ,37)A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型,C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题: (1)四种元素中电负性最大的是________(填元素符号),其中C原子的核外电子排布式为________________________________________________________________________。 (2)单质A有两种同素异形体,其中沸点高的是________(填分子式),原因是________________________________________________________________________; A和B的氢化物所属的晶体类型分别为____________和____________。 (3)C和D反应可生成组成比为1∶3的化合物E,E的立体构型为____________,中心原子的杂化轨道类型为________。 (4)化合物D2A的立体构型为________,中心原子的价层电子对数为________,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 ________________________________________________________________________。 (5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为________________________________________________________________________; 晶胞中A原子的配位数为________;列式计算晶体F的密度(g·cm-3 )_____________________________________________。 答案精析 考点一 知识梳理 1.(从左到右,从上到下)周期性有序 无序 有 无 固定 不固定 各向异性 各向同性 熔点 X射线衍射 2.(1)熔融态 (2)气态 (3)析出 3.(1)基本单元 (2)①任何间隙 ②平行 取向 深度思考 1.(1)× (2)√ (3)× (4)× (5)√ (6)× (7)√ 2.2∶1 1∶1 4 4 3.MN MN3 MN2 解题探究 1.+3价 解析 R:8×+1=2 G:8×+8×+4×+2=8 Q:8×+2=4 R、G、Q的个数之比为1∶4∶2,则其化学式为RQ2G4。由于R为+2价,G为-2价,所以Q为+3价。 2.B 3.5 4.CuH 解析 根据晶胞结构可以判断:Cu():2×+12×+3=6;H():6×+1+3=6,所以化学式为CuH。 5.(1)MgB2 (2)BO 解析 (1)每个Mg周围有6个B,而每个B周围有3个Mg,所以其化学式为MgB2。(2)从图可看出,每个单元中,都有一个B和一个O完全属于这个单元,剩余的2个O分别被两个结构单元共用,所以B∶O=1∶(1+2/2)=1∶2,化学式为BO。 6.B3A4 7.×1010 解析 设晶胞的棱长为xcm,在晶胞中,Cu:8×+6×=4;F:4,其化学式为CuF。a·x3·NA=4M(CuF), x=。最短距离为小立方体体对角线的一半,小立方体的体对角线为=x。所以最短距离为x·=·×1010pm。 8. 解析 晶胞中,个数为8×+6×=4,○个数为8, 其个数之比为1∶2,所以代表S2-,○代表Na+。 设晶胞边长为acm,则a3·ρ·NA=4×78 a= 面对角线为×cm 面对角线的为×cm 边长的为×cm 所以其最短距离为 cm =cm。 考点二 知识梳理 1.(从左到右,从上到下)分子 原子 金属阳离子、自由电子 阴、阳离子 分子间作用力 共价键 金属键 离子键 较小 很大 很大 很小 较大 较低 很高 很高 很低 较高 2.(1)kJ·mol-1 (2)①大 ②小 (3)稳定 大 深度思考 1.(1)√ (2)× (3)× (4)× (5)× (6)√ (7)× (8)√ 2.(1)NaCl、Na2S (2)NaOH、(NH4)2S (3)(NH4)2S (4)Na2S2 (5)CO2、CCl4、C2H2 (6)C2H2 (7)H2O2 (8)SiO2、SiC (9)晶体氩 晶体硅、金刚石 解题探究 1.(1)原子晶体 (2)分子晶体 (3)分子晶体 (4)离子晶体 (5)分子晶体 (6)原子晶体 (7)分子晶体 (8)金属晶体 2.(1)原子 共价键 (2)①②③④ (3)HF分子间能形成氢键,其熔化时需要消耗的能量更多(只要答出HF分子间能形成氢键即可) (4)②④ (5)D组晶体都为离子晶体,r(Na+)<r(K+)<r(Rb+)<r(Cs+),在离子所带电荷数相同的情况下,半径越小,晶格能越大,熔点就越高 3.C 4.C 5.D 考点三 知识梳理 1.(1)4 六 2 (2)4 2 十二 Si 4 2.(1)12 (2)4 2 3.(1)6 6 6 4 4 (2)8 8 8 4.分子间作用力 2 sp2 深度思考 1.(1)√ (2)√ (3)√ (4)× 2.不一样,金刚石中表示的是C—C共价键,而干冰中的“棍”表示分子间作用力;分子晶体中多数含有化学键(如CO2中的C===O键),少数则无(如稀有气体形成的晶体)。 3.B A 解题探究 1.(1)② (2)① (3)④ (4)③ (5)⑥ (6)⑤ (7)⑧ (8)⑦ (9)⑩ (10)⑨ 2.D 3.12 ×≈1.27×10-8 4.原子晶体 共价 ×100% 考能提升 1.①(,,) ②×107 2.①3∶1 ②×107 解析 ①根据均摊法计算,晶胞中铜原子个数为6×=3,镍原子的个数为8×=1 ,则铜和镍的数量比为3∶1;②根据上述分析,该晶胞的组成为Cu3Ni,若合金的密度为dg·cm-3,根据ρ=,则晶胞参数a=×107nm。 3.GaF3为离子晶体,GaCl3为分子晶体 4.(1)1s22s22p63s1(或[Ne]3s1) Cl (2)H2S分子间不存在氢键,H2O分子间存在氢键 (3)平面三角形 (4)Na+ (5)3H2O2+K2Cr2O7+4H2SO4===3O2↑+K2SO4+Cr2(SO4)3+7H2O 解析 M基态原子的核外电子排布式为1s22s22p4,为氧元素,R为钠元素,X的原子序数大于R,为硫元素,则Y为氯元素,Z基态原子的核外电子排布式为[Ar]3d54s1,为24号元素铬。(1)11号元素钠的基态原子的电子排布式为1s22s22p63s1。同一周期元素,随原子序数递增,电负性增大,Cl的电负性强于S。(2)H2S分子间不存在氢键,H2O分子间存在氢键,所以H2O的沸点高于H2S。(3)SO3的价层电子对数为3,无孤电子对,为平面三角形。(4)Na2S晶胞中黑球个数为8,白球个数为8×+6×=4,所以黑球表示Na+。(5)+6价铬中K2Cr2O7呈橙色,将H2O2氧化为O2,自身被还原为Cr2(SO4)3,注意溶液呈酸性,配平。 5.(1)金属晶体 金属键 12 (2)1s22s22p63s23p5 Ar HClO4 正四面体 (3)①CuCl 或 ②Cu+可与氨形成易溶于水的配位化合物(或配离子) [Cu(NH3)4]2+ 6.(4)分子 (5)①3 2 ②12 4 7.(2)4 2 (3)3 V形 sp2杂化 sp3杂化 a 12 (4)正四面体形 NaVO3 解析 (2)分析钒的某种氧化物的晶胞结构可利用切割法计算,晶胞中实际拥有的阴离子数目为4×+2=4,阳离子个数为8×+1=2。 (3)SO2分子中S原子价电子排布式为3s23p4,价层电子对数是3对,分子的立体构型为V形;SO3气态为单分子,该分子中S原子的杂化轨道类型为sp2杂化;根据题中SO3的三聚体环状结构图,可知该结构中S原子形成了四个共价键,则杂化轨道类型为sp3杂化;该结构中S—O键长有两类,一类键长约140pm,另一类键长约160pm,a键除了σ键外还有π键的成分,b键为σ键,故较短的键为a,由图可知该分子中含有12个σ键。 (4)钒酸钠(Na3VO4)中的阴离子VO的中心原子(V)有4对价层电子对,且与4个O原子形成了4个共价键,故其立体构型为正四面体形;由偏钒酸钠的阴离子呈如题中图3所示的无限链状结构,可知偏钒酸钠的阴离子为VO,则偏钒酸钠的化学式为NaVO3。 8.(3)16 (4)12 9.(4)+1 (5)SO 共价键和配位键 H2O H2O与Cu2+的配位键比NH3与Cu2+的弱 10.(3)共价键 3 (6)sp3杂化 1∶3 [SiO3]或SiO 解析 (3)金刚石晶胞的面心上各有一个原子,面上的原子对晶胞的贡献是。 (6)在多硅酸根中每个硅原子都与4个O形成4个Si—O单键,因而Si原子都是sp3杂化;观察图(b)可知,每个四面体通过两个氧原子与其他四面体连接形成链状结构,因而每个四面体中硅原子数是1,氧原子数=2+2×=3,即Si与O的原子个数比为1∶3,化学式为[SiO3]。 11.(1)O 1s22s22p63s23p3(或[Ne]3s23p3) (2)O3 O3相对分子质量较大,范德华力较大 分子晶体 离子晶体 (3)三角锥形 sp3杂化 (4)V形 4 2Cl2+2Na2CO3+H2O===Cl2O+2NaHCO3+2NaCl(或2Cl2+Na2CO3===Cl2O+CO2+2NaCl) (5)Na2O 8 ≈ 2.27g·cm-3 解析 由C元素原子核外电子总数是最外层电子数的3倍可知,C是磷元素;由A2-和B+具有相同的电子构型,且A、B原子序数小于15可知,A是氧元素,B是钠元素;A、B、C、D四种元素的原子序数依次增大,C、D为同周期元素,且D元素最外层有一个未成对电子,因此D是氯元素。(1)元素的非金属性O>Cl>P,则电负性O>Cl>P,Na是金属元素,其电负性最小;P的电子数是15,根据构造原理可写出其核外电子排布式。(2)氧元素有O2和O3两种同素异形体,相对分子质量O3>O2,范德华力O3>O2,则沸点O3>O2。A和B的氢化物分别是H2O和NaH,所属晶体类型分别为分子晶体和离子晶体。(3)PCl3分子中P含有一对孤电子对,其价层电子对数为4,因此其立体构型为三角锥形,中心原子P的杂化轨道类型为sp3杂化。(4)Cl2O分子的中心原子O原子含有2对孤电子对,其价层电子对数为4,因此其立体构型为V形;根据电子守恒和质量守恒可写出Cl2与湿润的Na2CO3反应的化学方程式。(5)根据化合物F的晶胞结构,利用均摊法可计算出氧原子个数:N(O)=8×+6×=4 ,钠原子全部在晶胞内,N(Na)=8,因此F的化学式为Na2O;以顶角氧原子为中心,与氧原子距离最近且等距离的钠原子有8个,即晶胞中A原子的配位数为8;晶胞参数即晶胞的棱长a=0.566nm,晶体F的密度ρ==≈2.27g·cm-3。查看更多