- 2021-07-08 发布 |
- 37.5 KB |
- 13页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020版高考一轮复习化学通用版学案:第三章第4课时 难点专攻——铁、铜重要化合物的性质探究
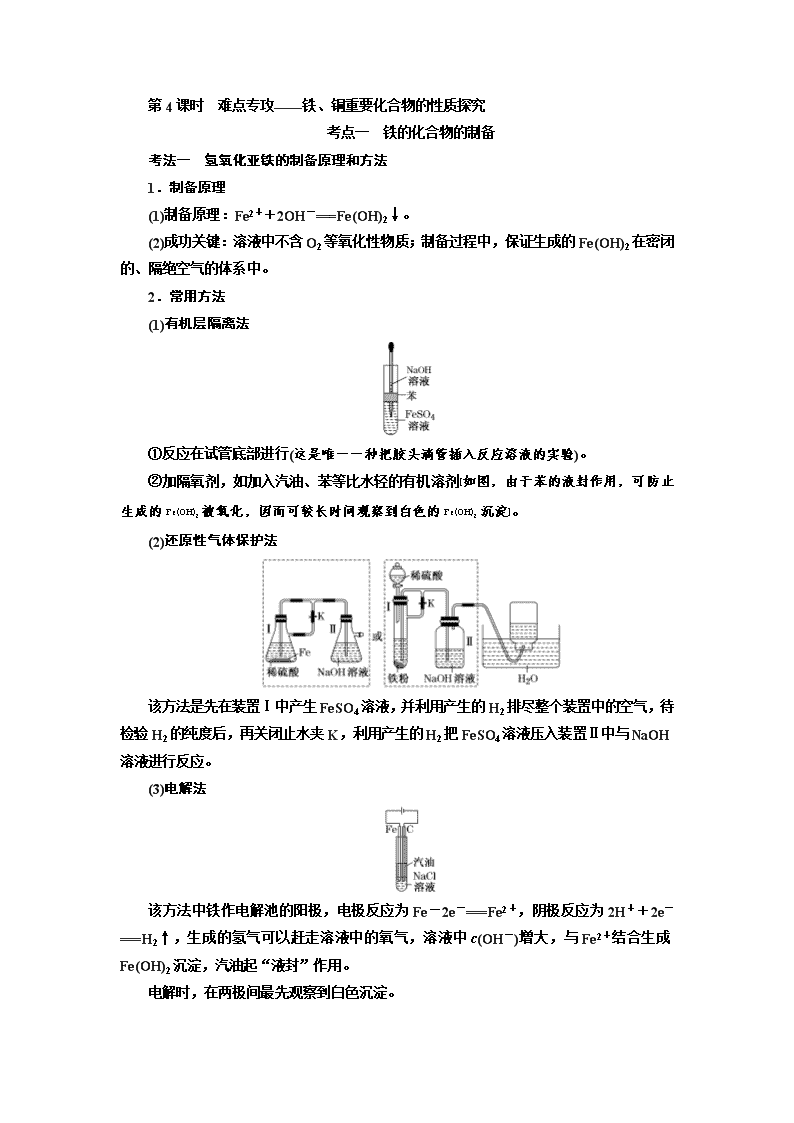
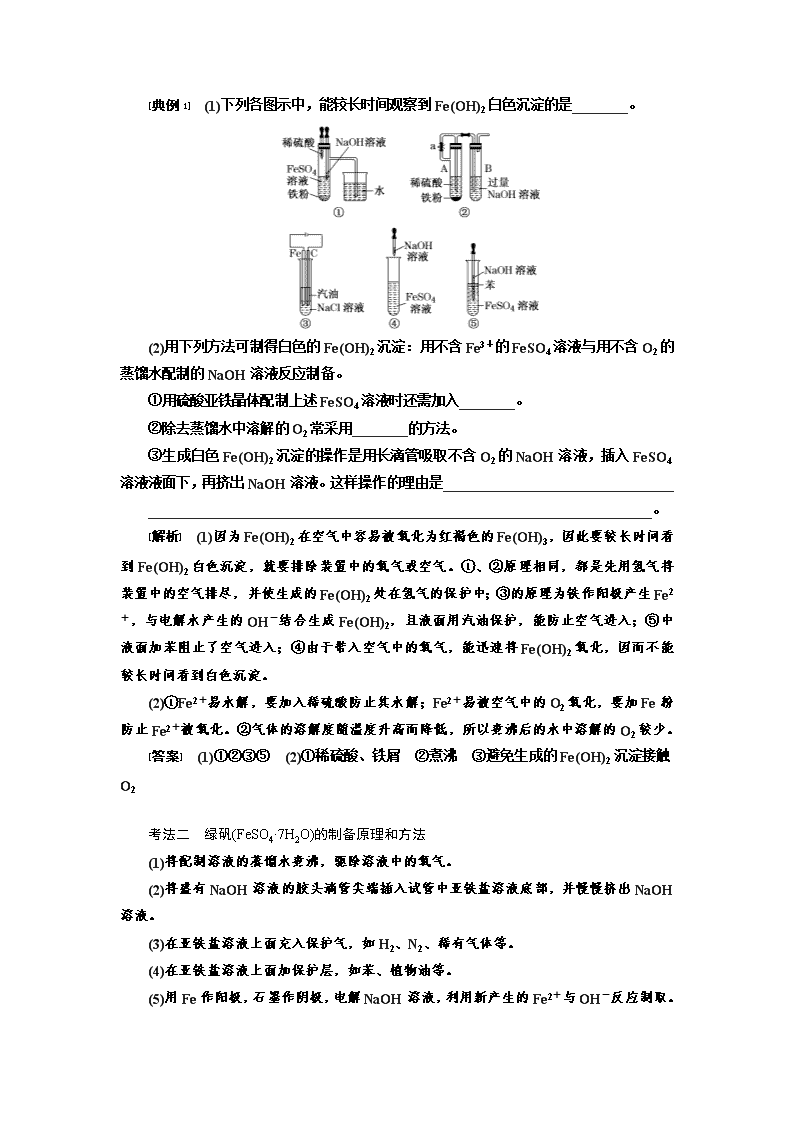
第4课时 难点专攻——铁、铜重要化合物的性质探究 考点一 铁的化合物的制备 考法一 氢氧化亚铁的制备原理和方法 1.制备原理 (1)制备原理:Fe2++2OH-===Fe(OH)2↓。 (2)成功关键:溶液中不含O2等氧化性物质;制备过程中,保证生成的Fe(OH)2在密闭的、隔绝空气的体系中。 2.常用方法 (1)有机层隔离法 ①反应在试管底部进行(这是唯一一种把胶头滴管插入反应溶液的实验)。 ②加隔氧剂,如加入汽油、苯等比水轻的有机溶剂[如图,由于苯的液封作用,可防止生成的Fe(OH)2被氧化,因而可较长时间观察到白色的Fe(OH)2沉淀]。 (2)还原性气体保护法 该方法是先在装置Ⅰ中产生FeSO4溶液,并利用产生的H2排尽整个装置中的空气,待检验H2的纯度后,再关闭止水夹K,利用产生的H2把FeSO4溶液压入装置Ⅱ中与NaOH溶液进行反应。 (3)电解法 该方法中铁作电解池的阳极,电极反应为Fe-2e-===Fe2+,阴极反应为2H++2e-===H2↑,生成的氢气可以赶走溶液中的氧气,溶液中c(OH-)增大,与Fe2+结合生成Fe(OH)2沉淀,汽油起“液封”作用。 电解时,在两极间最先观察到白色沉淀。 [典例1] (1)下列各图示中,能较长时间观察到Fe(OH)2白色沉淀的是________。 (2)用下列方法可制得白色的Fe(OH)2沉淀:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。 ①用硫酸亚铁晶体配制上述FeSO4溶液时还需加入________。 ②除去蒸馏水中溶解的O2常采用________的方法。 ③生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是_________________________________ ________________________________________________________________________。 [解析] (1)因为Fe(OH)2在空气中容易被氧化为红褐色的Fe(OH)3,因此要较长时间看到Fe(OH)2白色沉淀,就要排除装置中的氧气或空气。①、②原理相同,都是先用氢气将装置中的空气排尽,并使生成的Fe(OH)2处在氢气的保护中;③的原理为铁作阳极产生Fe2+,与电解水产生的OH-结合生成Fe(OH)2,且液面用汽油保护,能防止空气进入;⑤中液面加苯阻止了空气进入;④由于带入空气中的氧气,能迅速将Fe(OH)2氧化,因而不能较长时间看到白色沉淀。 (2)①Fe2+易水解,要加入稀硫酸防止其水解;Fe2+易被空气中的O2氧化,要加Fe粉防止Fe2+被氧化。②气体的溶解度随温度升高而降低,所以煮沸后的水中溶解的O2较少。 [答案] (1)①②③⑤ (2)①稀硫酸、铁屑 ②煮沸 ③避免生成的Fe(OH)2沉淀接触O2 考法二 绿矾(FeSO4·7H2O)的制备原理和方法 (1)将配制溶液的蒸馏水煮沸,驱除溶液中的氧气。 (2)将盛有NaOH溶液的胶头滴管尖端插入试管中亚铁盐溶液底部,并慢慢挤出NaOH溶液。 (3)在亚铁盐溶液上面充入保护气,如H2、N2、稀有气体等。 (4)在亚铁盐溶液上面加保护层,如苯、植物油等。 (5)用Fe作阳极,石墨作阴极,电解NaOH溶液,利用新产生的Fe2+与OH-反应制取。 考法(二) 绿矾(FeSO4·7H2O)的制备 1.用废铁屑(含少量SiO2和氧化铁)制取绿矾 从FeSO4溶液中获得FeSO4·7H2O,需要经过蒸发浓缩、冷却结晶、过滤、冰水洗涤、低温干燥等操作。 其中,冰水洗涤的目的是减少晶体的溶解损耗; 低温干燥的目的是防止晶体受热失去结晶水。 以上结晶过程最好是在氮气的环境中进行,其中N2的作用是防止绿矾在空气中被O2氧化而变质。 2.用烧渣制备绿矾 (烧渣中主要含FeO、Fe2O3,还有一定量的SiO2) 试剂X可以是SO2,也可以是Fe,其目的是将溶液中Fe3+还原为Fe2+。 若试剂X为SO2,其转化原理为: SO2+Fe2(SO4)3+2H2O===2FeSO4+2H2SO4 若试剂X为Fe,其转化原理为: Fe+Fe2(SO4)3===3FeSO4 测得“还原”后溶液的pH明显增大,其原因是Fe消耗过量的H2SO4,溶液酸性减弱。 [典例2] 绿矾被广泛用于医药和工业领域,工业上两种制备绿矾(FeSO4·7H2O)的流程如图所示,根据题意回答下列问题: 方法一:利用黄铜矿粉(主要成分为CuFeS2)制取绿矾 (1)试剂a和试剂b分别是________________,操作1的名称是________。 (2)有一种细菌在有氧气存在的稀硫酸中,可以将CuFeS2氧化成硫酸盐,写出该反应的化学方程式:________________________________________________________________ ________________________________________________________________________。 方法二:利用工业废铁屑制取绿矾 (3)加入适量Na2CO3溶液的作用是____________。 (4)操作Ⅰ需要用到的玻璃仪器名称有____________________________________。 (5)通过检验CO来判断操作Ⅰ是否洗涤干净,检验的方法是______________________ ________________________________________________________________________。 [解析] (1)由流程图可知滤渣2为Fe(OH)3,而目标产物为绿矾(FeSO4·7H2O),所以试剂a为稀H2SO4,起溶解作用,b为铁粉,起还原作用;由流程图可知操作1为过滤,其作用为除去过量的铁粉。(2)由题意可知,在细菌的作用下,氧气氧化黄铜矿的反应方程式为4CuFeS2+17O2+2H2SO4===4CuSO4+2Fe2(SO4)3+2H2O。(3)CO水解时使溶液呈碱性,可以除去油污。(4)因为操作Ⅰ为过滤与洗涤,所用的玻璃仪器有烧杯、玻璃棒、漏斗。 [答案] (1)稀H2SO4、铁粉 过滤 (2)4CuFeS2+17O2+2H2SO4===4CuSO4+2Fe2(SO4)3+2H2O (3)除去油污 (4)烧杯、玻璃棒、漏斗 (5)取少量最后一次的洗涤液于试管中,滴加BaCl2溶液,若无白色沉淀生成,则已经洗涤干净;若有白色沉淀生成,则未洗涤干净 [综合训练] 1.硫酸亚铁是一种重要的化工原料,可以用来制备一系列物质(如图所示)。下列说法错误的是( ) A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂 B.为防止NH4HCO3分解,制备FeCO3需在较低温度下进行 C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化 D.常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大 解析:选D 碱式硫酸铁电离产生Fe3+,Fe3+能发生水解反应生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附性,可用作净水剂,故A项正确;NH4HCO3不稳定,受热易分解,为防止NH4HCO3分解,制备FeCO3需在较低温度下进行,故B项正确;KSCN溶液遇Fe2+溶液无现象,(NH4)2Fe(SO4)2中Fe2+被氧化则生成Fe3+,KSCN溶液遇Fe3+溶液变红,故C项正确;(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的小,FeSO4才能与(NH4)2SO4 反应生成(NH4)2Fe(SO4)2,故D项错误。 2.绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法: 查询资料,得有关物质的数据如下表: 25 ℃时 饱和H2S溶液 SnS沉淀完全 FeS开始沉淀 FeS沉淀完全 pH 3.9 1.6 3.0 5.5 (1)检验制得的绿矾晶体中是否含有Fe3+,最好选用的试剂为________。 A.KSCN溶液 B.NaOH溶液 C.KMnO4溶液 (2)操作Ⅱ中,通入硫化氢至饱和的目的是(写两点)________________、________________。 (3)操作Ⅳ的顺序依次为________、冷却结晶、过滤。 (4)测定绿矾产品中Fe2+含量的方法是: a.称取3.72 g绿矾产品,溶解,在250 mL容量瓶中定容; b.量取25.00 mL待测溶液于锥形瓶中; c.用硫酸酸化的0.010 00 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00 mL。 ①滴定时盛放KMnO4溶液的仪器为________(填仪器名称)。 ②计算上述样品中FeSO4·7H2O的质量分数为________。 ③上述测定中,若滴定管规格为50 mL,则步骤a中称取样品的质量不能超过______g。(保留4位小数) 解析:(1)检验所得绿矾晶体中是否含有Fe3+的实验操作是利用三价铁离子检验方法:Fe3+和SCN-会反应生成红色的Fe(SCN)3,从而证明了Fe3+的存在。(2)通入硫化氢至饱和的目的是:硫化氢具有强还原性,可以将Fe3+还原为Fe2+。H2S在溶液中饱和,可以增大溶液中的S2-浓度,尽量保证将Sn2+转化为SnS沉淀,以便于过滤除去Sn杂质。(3)溶液中得到晶体,需要对溶液进行加热蒸发浓缩,冷却结晶,过滤,洗涤,干燥等,所以操作Ⅳ的顺序依次为:蒸发浓缩、冷却结晶、过滤。(4)①高锰酸钾溶液具有强氧化性,所以会氧化碱式滴定管尖嘴处的橡胶管,所以滴定时盛放KMnO4溶液的仪器为酸式滴定管。②用硫酸酸化的0.010 00 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00 mL,则根据方程式:5Fe2++MnO4+8H+===5Fe3++Mn2++4H2O得到:n(Fe2+)=0.010 00 mol·L-1×0.020 0 L×5=0.001 mol。所以250 mL溶液中有n(Fe2+)=0.01 mol。则 FeSO4·7H2O物质的量也是0.01 mol,质量为0.01 mol×278 g·mol-1=2.78 g,质量分数为:2.78 g÷3.72 g==74.73%=75%。③若滴定管规格为50 mL,则最多能量出50 mL的高锰酸钾溶液,根据方程式:5Fe2++MnO+8H+===5Fe3++Mn2++4H2O得到最多反应的n(Fe2+)=0.010 00 mol·L-1×0.050 0 L×5=0.002 5 mol,所以250 mL溶液中有n(Fe2+)=0.025 mol,则FeSO4·7H2O物质的量最多是0.025 mol,质量为0.025 mol×278 g·mol-1=6.95 g,因为样品中FeSO4·7H2O的质量分数为,所以样品质量为6.95 g÷=9.3 g,题目要求保留4位小数,所以为9.300 0 g。 答案:(1)A (2)除去溶液中的Sn2+ 将Fe3+还原成Fe2+ (3)蒸发浓缩 (4)①酸式滴定管 ②75% ③9.300 0 考点二 含铁化合物的分离提纯与性质探究 考法一 化工生产中Fe3+、Fe2+的除杂方法 1.除去CuCl2溶液中的FeCl2 (1)示例说明 已知不同金属离子生成氢氧化物沉淀所需的pH如下表: 金属离子 Fe3+ Cu2+ Fe2+ Ni2+ Mg2+ 开始沉淀的pH 2.7 4.4 7.0 7.1 9.3 沉淀完全的pH 3.7 6.4 9.6 9.2 10.8 除杂的流程图: (2)注意事项 ①若直接调节溶液的pH,待Fe2+沉淀完全,Cu2+也已沉淀完全,不能除去Fe2+,不可行。 ②先将Fe2+氧化成Fe3+,再调溶液的pH为3.7≤pH<4.4,此时Fe3+沉淀完全,Cu2+未沉淀,过滤除去Fe(OH)3沉淀。 ③加入的氧化剂可以是双氧水或氯气等,注意不能引入新的杂质。 ④调节溶液pH的物质,要消耗氢离子,但不能引入新杂质,可为CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3。 2.常见的其他物质中铁的除杂方法 所加试剂 说明 除去Mg2+中混有的Fe3+ Mg、MgO、MgCO3或Mg(OH)2 加MgO等调pH为3.7≤pH<9.3,将Fe3+转化为Fe(OH)3沉淀,过滤除去 除去Cu2+中混有的Fe3+ CuO、CuCO3、Cu(OH)2或Cu2(OH)2CO3 加CuO等调pH为3.7≤pH<4.4,将Fe3+转化为Fe(OH)3沉淀,过滤除去 除去Mg2+中混有的Fe2+ 先加入氧化剂(如H2O2等)将Fe2+氧化成Fe3+,再加Mg、MgO、MgCO3或Mg(OH)2 加MgO等调pH为3.7≤pH<9.3,将Fe3+转化为Fe(OH)3沉淀,过滤除去 除去Ni2+中混有的Fe2+ 先加入氧化剂(如H2O2等)将Fe2+氧化成Fe3+,再加NiO等物质 加NiO等调pH为3.7≤pH<7.1,将Fe3+转化为Fe(OH)3沉淀,过滤除去 [典例1] 炼锌厂的铜镉废渣中含有铜、锌、镉、铁、砷等元素,其含量依次减少。对这些元素进行提取分离能减少环境污染,同时制得ZnSO4·7H2O实现资源的再利用。其流程图如下。已知FeAsO4难溶于水;ZnSO4·7H2O易溶于水,难溶于酒精。 金属离子 Fe3+ Zn2+ Mn2+ Cu2+ Cd2+ 开始沉淀pH 2.7 6.5 7.7 5.2 6.9 沉淀完全pH 3.2 8.0 9.8 6.4 9.4 请回答下列问题: (1)提高浸出率可以采用的方法是(写出其中一点即可)_________________________。 (2)滤液Ⅰ中有少量的AsO,若不除去,则AsO与Cd反应会产生一种有毒氢化物气体,该气体的分子式为______。向滤液Ⅰ中逐滴滴入酸性KMnO4溶液可与AsO反应生成FeAsO4,完成该反应的离子方程式: ___Fe2++___AsO+___MnO+____===____Mn2++____FeAsO4↓+____,判断该滴定终点的现象是_________________________________________________。 (3)流程中②调节pH时可以选用的试剂为__________,滤渣Ⅱ的主要成分为 __________。 (4)常温下Zn(OH)2的溶度积Ksp=________。 (5)制得的ZnSO4·7H2O需洗涤,洗涤晶体时应选用试剂为____________________。 [解析] (4)当Zn2+沉淀完全时溶液中c(Zn2+)≤10-5 mol·L-1,则Ksp[Zn(OH)2]=c(Zn2+)·c2(OH-)=10-5×(10-6)2=10-17。 [答案] (1)适当增大硫酸浓度、升高溶液温度、搅拌、将铜镉渣磨碎成小颗粒等(合理答案均可) (2)AsH3 5Fe2++5AsO+3MnO+14H+===3Mn2++5FeAsO4↓+7H2O 滴最后一滴KMnO4,溶液变为粉红色且半分钟内不恢复为原色,则反应滴定到终点 (3)ZnO、ZnCO3、Zn(OH)2等合理答案均可 FeAsO4、Fe(OH)3 (4)10-17 (5)乙醇(或饱和硫酸锌溶液) 考法二 探究Fe2+、Fe3+的性质 [典例2] (2016·全国卷Ⅱ)某班同学用如下实验探究Fe2+、Fe3+的性质。 回答下列问题: (1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L-1的溶液。在FeCl2溶液中需加入少量铁屑,其目的是________________________________________________。 (2)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为______________________。 (3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是________________________。 (4)丙组同学取10 mL 0.1 mol·L-1 KI溶液,加入6 mL 0.1 mol·L-1 FeCl3溶液混合。分别取2 mL此溶液于3支试管中进行如下实验: ①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层显紫色; ②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀; ③第三支试管中加入1滴KSCN溶液,溶液变红。 实验②检验的离子是________(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有________(填离子符号),由此可以证明该氧化还原反应为________。 (5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为________________________________;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是________________;生成沉淀的原因是________________________________________________________________________ (用平衡移动原理解释)。 [解析] (1)Fe2+具有很强的还原性,易被空气中的O2氧化为Fe3+,在FeCl2溶液中加入少量铁屑,可防止Fe2+被氧化。 (2)Fe2+被氧化为Fe3+,Cl2被还原为Cl-,反应的离子方程式为2Fe2++Cl2===2Fe3++2Cl-。 (3)O2难溶于煤油,加入煤油能隔绝空气,排除O2对实验的影响。 (4)KI溶液与FeCl3溶液反应的离子方程式为2I-+2Fe3+===I2+2Fe2+。K3[Fe(CN)6]是检验Fe2+的试剂。实验③溶液变红,说明溶液中仍存在Fe3+,由此可说明该氧化还原反应为可逆反应。 (5)酸化的FeCl2溶液与H2O2反应,Fe2+被氧化为Fe3+,H2O2被还原为H2O,反应的离子方程式为H2O2+2Fe2++2H+===2Fe3++2H2O。Fe3+对H2O2的分解起催化作用,当反应一段时间后,会发生反应:2H2O22H2O+O2↑,故溶液中产生气泡。由于H2O2分解反应放热,促使Fe3++3H2OFe(OH)3+3H+平衡右移,最终出现Fe(OH)3红褐色沉淀。 [答案] (1)防止Fe2+被氧化 (2)2Fe2++Cl2===2Fe3++2Cl- (3)隔绝空气(排除氧气对实验的影响) (4)Fe2+ Fe3+ 可逆反应 (5)2Fe2++H2O2+2H+===2Fe3++2H2O Fe3+催化H2O2分解产生O2 H2O2分解反应放热,促进Fe3+的水解平衡正向移动 [综合训练] 1.(2017·北京高考)某小组在验证反应“Fe+2Ag+===Fe2++2Ag”的实验中检测到Fe3+,发现和探究过程如下。 向硝酸酸化的0.05 mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。 (1)检验产物 ①取出少量黑色固体,洗涤后,________________________________________(填操作和现象),证明黑色固体中含有Ag。 ②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有__________。 (2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是__________________________________(用离子方程式表示)。针对两种观点继续实验: ①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下: 序号 取样时间/min 现象 ⅰ 3 产生大量白色沉淀;溶液呈红色 ⅱ 30 产生白色沉淀,较3 min时量少;溶液红色较3 min时加深 ⅲ 120 产生白色沉淀,较30 min时量少;溶液红色较30 min时变浅 (资料:Ag+与SCN-生成白色沉淀AgSCN) ②对Fe3+产生的原因作出如下假设: 假设a:可能是铁粉表面有氧化层,能产生Fe3+; 假设b:空气中存在O2,由于________________________________(用离子方程式表示),可产生Fe3+; 假设c:酸性溶液中的NO具有氧化性,可产生Fe3+; 假设d:根据____________________________________________现象,判断溶液中存在Ag+,可产生Fe3+。 ③下述实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。 实验Ⅰ:向硝酸酸化的________溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液。3 min时溶液呈浅红色,30 min后溶液几乎无色。 实验Ⅱ:装置如下图。其中甲溶液是________,操作及现象是____________________。 (3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因:________________________________________________________________________。 解析:(1)①黑色固体溶于热的硝酸溶液后,向其中加入稀盐酸,产生白色沉淀,可证明黑色固体中含有Ag。②可利用K3[Fe(CN)6]检验Fe2+的存在。(2)Fe3+具有较强的氧化性,过量的铁粉会与Fe3+反应:Fe+2Fe3+===3Fe2+。②空气中的O2会与Fe2+发生氧化还原反应,产生Fe3+;加入KSCN溶液后产生白色沉淀,说明溶液中存在Ag+,Ag+可与Fe2+反应产生Fe3+。③实验Ⅰ可证明假设a、b、c不是产生Fe3+的主要原因,只要将原实验反应体系中的Ag+替换,其他微粒的种类及浓度保持不变,做对比实验即可,所以可选用0.05 mol·L-1 NaNO3溶液(pH≈2);实验Ⅱ利用原电池装置证明反应Ag++Fe2+===Ag+Fe3+能发生,所以甲溶液是FeSO4溶液。操作和现象:分别取电池工作前与工作一段时间后左侧烧杯中的溶液,同时滴加KSCN溶液,后者红色会更深。 答案:(1)①加硝酸加热溶解固体,再滴加稀盐酸,产生白色沉淀 ②Fe2+ (2)2Fe3++Fe===3Fe2+ ②4Fe2++O2+4H+===4Fe3++2H2O 加入KSCN溶液后产生白色沉淀 ③0.05 mol·L-1NaNO3 FeSO4溶液 分别取电池工作前与工作一段时间后左侧烧杯中溶液,同时滴加KSCN溶液,后者红色更深 (3)溶液中存在反应:①2Ag++Fe===Fe2++2Ag, ②Ag++Fe2+===Fe3++Ag,③Fe+2Fe3+===3Fe2+。反应开始时,c(Ag+)大,以反应①、②为主,c(Fe3+)增大。约30 min后,c(Ag+)小,以反应③为主,c(Fe3+)减小 2.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下: 已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表: 沉淀物 Fe(OH)3 Fe(OH)2 Al(OH)3 开始沉淀 2.3 7.5 3.4 完全沉淀 3.2 9.7 4.4 回答下列问题: (1)反应Ⅰ中发生的氧化还原反应的化学方程式为__________________________ ________________________________________________________________________, ________________________________________________________________________。 (2)加入少量NaHCO3的目的是调节pH,使溶液中的____(填“Fe3+”、“Fe2+”或“Al3+”)沉淀。该工艺流程中“搅拌”的作用是________________。 (3)反应Ⅱ的离子方程式为________________________。在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作____________。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为____________。 (4)碱式硫酸铁溶于水后产生的[Fe(OH)]2+,可部分水解生成[Fe2(OH)4]2+聚合离子。该水解反应的离子方程式为__________________________________________________。 (5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO。为检验所得产品中是否含有Fe2+,应使用的试剂为__________(填字母)。 A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液 解析:(1)根据题意及流程图分析知,反应Ⅰ中发生的反应为Al2O3+3H2SO4===Al2(SO4)3+3H2O、Fe2O3+3H2SO4===Fe2(SO4)3+3H2O,Fe+ Fe2(SO4)3===3FeSO4,Fe+H2SO4(稀)===FeSO4+H2↑,其中属于氧化还原反应的为Fe+Fe2(SO4)3===3FeSO4、Fe+H2SO4(稀)===FeSO4+H2↑;(2)根据题意及流程图分析知,反应Ⅰ后溶液的成分为FeSO4和Al2(SO4)3的混合溶液,经搅拌、过滤后得FeSO4溶液,所以加入少量NaHCO3的目的是调节pH,使溶液中的Al3+沉淀,该工艺流程中“搅拌”的作用是加快反应速率;(3)由题给信息知,反应Ⅱ中NaNO2中氮元素的化合价由反应前的+3价降为反应后NO中的+2,则FeSO4中铁元素的化合价必然升高,由Fe2+转化为Fe3+,反应的离子方程式为Fe2++NO+2H+===Fe3++NO↑+H2O,反应Ⅱ的目的是利用氧化剂将Fe2+氧化为Fe3+,O2与NaNO2在反应中作氧化剂;n(O2)=0.5 mol,则得到电子0.5 mol×4=2 mol,1 mol NaNO2被还原生成NO,化合价由+3价降低到+2价,得到1 mol电子,根据得失电子数目相等知,节约 NaNO2的物质的量为2 mol;(4)[Fe(OH)]2+可部分水解生成[Fe2(OH)4]2+聚合离子,根据电荷守恒和质量守恒可写出反应的离子方程式为2[Fe(OH)]2++2H2O[Fe2(OH)4]2++2H+;(5)氯水可以氧化Fe2+生成Fe3+,溶液颜色变化不明显,不能检验Fe2+,A错误;KSCN溶液和Fe2+混合无现象发生,不能检验Fe2+,B错误;加入NaOH溶液和Fe3+反应生成红褐色沉淀,不能检验是否存在Fe2+,C错误;在含有Fe3+的溶液中检验Fe2+,应选用酸性KMnO4溶液,酸性KMnO4溶液氧化Fe2+时溶液褪色,现象明显,D正确。 答案:(1)Fe+H2SO4===FeSO4+H2↑ Fe+Fe2(SO4)3===3FeSO4 (2)Al3+ 加快反应速率(或使反应物充分接触) (3)Fe2++NO+2H+===Fe3++NO↑+H2O 氧化剂 2 mol (4)2[Fe(OH)]2++2H2O[Fe2(OH)4]2++2H+ (5)D 考点三 迁移“氢气还原氧化铜”的实验装置模型 1.实验装置 2.装置的作用 装置 作用 A 制取H2 B 除去H2中混有的HCl(若采用稀硫酸制取氢气,无需使用该装置) C 除去H2中混有的水蒸气(也可将B、C装置用盛有碱石灰的U形干燥管代替) E 检验氢气还原氧化铜生成的水 F 防止外界空气中的水蒸气进入装置E中,干扰产物水的检验 3.实验操作 [提醒] 先熄灭酒精灯再停止通入氢气的目的是使被还原生成的Cu在氢气的氛围中冷却,以防止空气进入,使Cu在较高温度下被氧化。 [典例] (2017·全国卷Ⅰ)实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气)。下列说法正确的是( ) A.①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液 B.管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度 C.结束反应时,先关闭活塞K,再停止加热 D.装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气 [解析] 制得的氢气中含有H2S、O2、HCl、H2O等杂质,由于酸性高锰酸钾溶液氧化氯化氢生成氯气,所以,应先用焦性没食子酸溶液吸收氧气,同时除去氯化氢(易溶于水),再用酸性高锰酸钾溶液吸收硫化氢,最后用浓硫酸干燥,A项错误;氢气中混有空气加热易发生爆炸,故加热管式炉前需对氢气进行验纯,其操作为在④处收集气体并点燃,发出“噗”声,则证明制取的氢气较纯,B项正确;类似氢气还原氧化铜,实验完毕后,先停止加热,再继续通入氢气一段时间,C项错误;启普发生器不能加热,适合块状固体与液体在常温下反应,而实验室用二氧化锰与浓盐酸反应制氯气需要加热,且二氧化锰是粉末状固体,故不能用装置Q制备氯气,D项错误。 [答案] B [备考方略] H2(或CO)还原金属氧化物的实验流程查看更多