2021届高考化学一轮复习化学反应速率和化学平衡作业
专题十三 化学反应速率和化学平衡
探考情 悟真题
【考情探究】
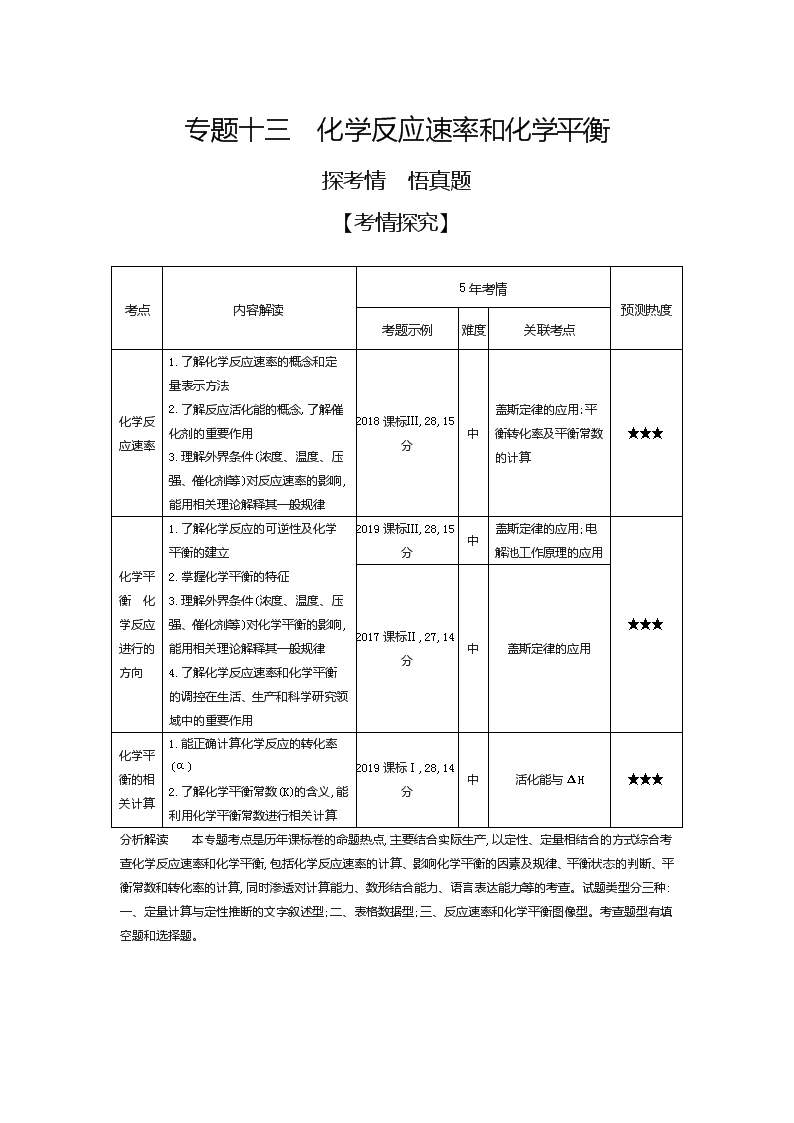
考点
内容解读
5年考情
预测热度
考题示例
难度
关联考点
化学反应速率
1.了解化学反应速率的概念和定量表示方法
2.了解反应活化能的概念,了解催化剂的重要作用
3.理解外界条件(浓度、温度、压强、催化剂等)对反应速率的影响,能用相关理论解释其一般规律
2018课标Ⅲ,28,15分
中
盖斯定律的应用;平衡转化率及平衡常数的计算
★★★
化学平衡 化学反应进行的方向
1.了解化学反应的可逆性及化学平衡的建立
2.掌握化学平衡的特征
3.理解外界条件(浓度、温度、压强、催化剂等)对化学平衡的影响,能用相关理论解释其一般规律
4.了解化学反应速率和化学平衡的调控在生活、生产和科学研究领域中的重要作用
2019课标Ⅲ,28,15分
中
盖斯定律的应用;电解池工作原理的应用
★★★
2017课标Ⅱ,27,14分
中
盖斯定律的应用
化学平衡的相关计算
1.能正确计算化学反应的转化率(α)
2.了解化学平衡常数(K)的含义,能利用化学平衡常数进行相关计算
2019课标Ⅰ,28,14分
中
活化能与ΔH
★★★
分析解读 本专题考点是历年课标卷的命题热点,主要结合实际生产,以定性、定量相结合的方式综合考查化学反应速率和化学平衡,包括化学反应速率的计算、影响化学平衡的因素及规律、平衡状态的判断、平衡常数和转化率的计算,同时渗透对计算能力、数形结合能力、语言表达能力等的考查。试题类型分三种:一、定量计算与定性推断的文字叙述型;二、表格数据型;三、反应速率和化学平衡图像型。考查题型有填空题和选择题。
【真题探秘】
破考点 练考向
【考点集训】
考点一 化学反应速率
1.(2018吉林长春普通高中一模,13)已知反应A2(g)+2B2(g) 2AB2(g) ΔH<0,下列说法正确的是( )
A.升高温度,正反应速率增大,逆反应速率减小
B.升高温度有利于反应速率增大,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
答案 B
2.(2020届贵州贵阳摸底,12)已知:X(g)+2Y(g)3Z(g) ΔH=-a kJ·mol-1(a>0)。下列说法不正确的是( )
A.达到化学平衡状态时,反应放出的总热量可能达到a kJ
B.升高反应温度,逆反应速率增大,正反应速率减小
C.达到化学平衡状态时,X、Y、Z的浓度不再发生变化
D.0.1 mol X和0.2 mol Y充分反应生成Z的物质的量一定小于0.3 mol
答案 B
3.(2020届河北邢台摸底,10)在两个容积均为2 L的恒容密闭容器中,起始时均充入a mol H2S,以温度、Al2O3催化剂为实验条件变量,进行H2S的分解实验[反应为2H2S(g)2H2(g)+S2(g)]。测得的结果如图所示(曲线Ⅱ、Ⅲ表示经过相同时间且未达到化学平衡时H2S的转化率)。
下列说法正确的是( )
A.温度升高,H2S分解的速率增大,S2的含量减少
B.由曲线Ⅱ、Ⅲ可知,加入Al2O3可提高H2S的平衡转化率
C.900 ℃时,t s后达到平衡,则H2的生成速率为a2t mol·L-1·s-1
D.约1 100 ℃时,曲线Ⅱ、Ⅲ几乎重合,说明Al2O3可能几乎失去催化活性
答案 D
4.(2019湖北石首一中一调,4)可逆反应mA(g)+nB(g)pC(g)+qD(g)的v-t图像如图1所示,若其他条件不变,只是在反应前加入合适的催化剂,则其v-t图像如图2所示。以下说法中正确的是( )
①a1>a2 ②a1
b2 ④b1t2 ⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧图2中阴影部分面积更大
A.②③⑤⑧ B.①④⑥⑧
C.②④⑤⑦ D.①③⑥⑦
答案 C
5.(2019湖北部分重点中学起点考试,10)工业上利用Ga与NH3在高温条件下合成固态半导体材料氮化镓(GaN)的同时有氢气生成。反应中,每生成3 mol H2放出30.8 kJ的热量。在恒温恒容密闭体系内进行上述反应,下列有关表达正确的是( )
A.Ⅰ图像中如果纵轴为正反应速率,则t时刻改变的条件可以为升温或加压
B.Ⅱ图像中纵轴可以为镓的转化率
C.Ⅲ图像中纵轴可以为化学反应速率
D.Ⅳ图像中纵轴可以为体系内混合气体的平均相对分子质量
答案 A
6.(2018福建厦门质检,7)2SO2(g)+O2(g) 2SO3(g) ΔH=-198 kJ·mol-1,在V2O5存在时,该反应的机理为:V2O5+SO2 2VO2+SO3(快),4VO2+O2 2V2O5(慢)。
下列说法中正确的是( )
A.反应速率主要取决于V2O5的质量
B.VO2是该反应的催化剂
C.逆反应的活化能大于198 kJ·mol-1
D.增大SO2的浓度可显著提高反应速率
答案 C
考点二 化学平衡 化学反应进行的方向
1.(2020届湖北部分重点中学起点联考,12)下列事实不能用勒夏特列原理解释的是( )
A.将FeCl3溶液加热蒸干最终得不到无水FeCl3固体
B.实验室制取乙酸乙酯时,将乙酸乙酯不断蒸出
C.实验室用排饱和食盐水的方法收集氯气
D.使用催化剂,提高合成氨的生产效率
答案 D
2.(2020届安徽A10联盟摸底,12)在一个密闭容器中,A与B在一定条件下发生反应:A(s)+B(g)C(g) ΔH<0,改变B的物质的量并使之达到平衡,得到如下图所示的平衡曲线,下列说法不正确的是( )
A.增加少量A物质,平衡不移动
B.斜率(tan θ)为平衡常数,且随温度升高而减小
C.恒温恒容时,加入少量He气,容器内气体密度不变
D.缩小容器体积,气体平均相对分子质量不变
答案 C
3.(2019安徽江南片摸底,10)在恒温、恒容条件下,能说明可逆反应:H2(g)+I2(g)2HI(g)达到平衡状态的是( )
A.气体的压强保持不变 B.v正(H2)=2v逆(HI)
C.气体的密度保持不变 D.气体的颜色保持不变
答案 D
4.(2019河北邯郸重点高中开学检测,21)在恒温、恒容条件下发生下列反应:2X2O5(g)4XO2(g)+O2(g) ΔH>0,T温度下的部分实验数据为:
t(s)
0
50
100
150
c(X2O5)(mol/L)
4.00
2.50
2.00
2.00
下列说法不正确的是( )
A.T温度下的平衡常数K=64(mol/L)3,100 s时X2O5的转化率为50%
B.50 s内X2O5的分解速率为0.03 mol/(L·s)
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2
D.若只将恒容改变为恒压,其他条件都不变,则平衡时X2O5的转化率和平衡常数都不变
答案 D
5.(2018湖北鄂东南省级示范高中联盟学校联考,11)向某密闭容器中加入0.3 mol A、0.1 mol C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如甲图所示[t0~t1阶段c(B)未画出]。乙图为t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知,t3~t4阶段使用催化剂。下列说法中不正确的是 ( )
A.若t1=15 min,则用C的浓度变化表示在t0~t1时间段的平均反应速率为0.004 mol·L-1·min-1
B.t4~t5阶段改变的条件一定是减小压强
C.B的起始物质的量为0.02 mol
D.t5~t6阶段,若容器内A的物质的量减少了0.03 mol,而此过程中容器与外界的热交换总量为a kJ,则该反应的热化学方程式为3A(g) B(g)+2C(g) ΔH=+100a kJ·mol-1
答案 C
6.(2020届四川成都七中入学调研,18)以煤为原料可合成一系列燃料。
(1)已知:①2H2(g)+O2(g)2H2O(g)
ΔH=-483.6 kJ/mol
②CH3OH(g)+H2O(g)CO2(g)+3H2(g)
ΔH=+49.0 kJ/mol
请写出甲醇燃烧生成H2O(g)的热化学方程式: 。
(2)向1 L密闭容器中加入2 mol CO、4 mol H2,在适当的催化剂作用下,发生反应:2CO(g)+4H2(g)CH3OCH3(l)+H2O(l) ΔH=+71 kJ/mol。
①该反应 自发进行(填“能”“不能”或“无法判断”)。
②下列叙述能说明此反应达到平衡状态的是 。
a.混合气体的平均相对分子质量保持不变
b.CO和H2的转化率相等
c.CO和H2的体积分数保持不变
d.混合气体的密度保持不变
e.1 mol CO生成的同时有1 mol O—H键断裂
(3)CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH<0,在一定条件下,该反应过程中部分数据如下表:
反应条件
反应
时间
CO2(mol)
H2(mol)
CH3OH(mol)
H2O(mol)
恒温恒容
(T1 ℃、2 L)
0 min
2
6
0
0
10 min
4.5
20 min
1
30 min
1
①0~10 min内,用H2O(g)表示的化学反应速率v(H2O)= mol/(L·min)。
②达到平衡时,该反应的平衡常数K= (用分数表示),平衡时H2的转化率是 。
③在其他条件不变的情况下,若30 min时改变温度为T2 ℃,此时H2的物质的量为3.2 mol,则T1 T2(填“>”“<”或“=”),理由是 。在其他条件不变的情况下,若30 min时向容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡 移动(填“正向”“逆向”或“不”)。
(4)用甲醚(CH3OCH3)作为燃料电池的原料,请写出在碱性介质中电池负极反应式: 。
答案 (1)CH3OH(g)+32O2(g)CO2(g)+2H2O(g) ΔH=-676.4 kJ/mol
或2CH3OH(g)+3O2(g)2CO2(g)+4H2O(g)
ΔH=-1 352.8 kJ/mol
(2)不能 d
(3)①0.025 ②4/27 50% ③< 该反应的正反应是放热反应,温度升高,平衡逆向移动 不
(4)CH3OCH3-12e-+16OH-2CO32-+11H2O
考点三 化学平衡的相关计算
1.(2020届湖北部分重点中学起点联考,13)高炉炼铁过程中发生反应:13Fe2O3(s)+CO(g)23Fe(s)+CO2(g),该反应在不同温度下的平衡常数见下表。
温度T/℃
1 000
1 150
1 300
平衡常数K
4.0
3.7
3.5
下列说法正确的是( )
A.由表中数据可判断该反应:反应物的总能量<生成物的总能量
B.1 000 ℃下Fe2O3与CO反应,t min达到平衡时c(CO)=2×10-3 mol·L-1,则用CO2表示该反应的平均速率为2×10-3/t mol·L-1·min-1
C.为了使该反应的K增大,可以在其他条件不变时,增大c(CO)
D.其他条件不变时,增加Fe2O3的用量,不能有效降低炼铁尾气中CO的含量
答案 D
2.(2019四川成都顶级名校零诊,17)某温度下,对于反应N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ/mol,N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是( )
A.将1 mol氮气、3 mol氢气置于1 L密闭容器中发生反应,放出的热量为92.4 kJ
B.平衡状态由A变到B时,平衡常数K(A)T2 ℃>T1 ℃
②1∶1 1(50a×13)2MPa-2(答案合理即可)
炼技法 提能力
【方法集训】
方法1 化学反应速率及化学平衡图像的分析方法
1.(2020届安徽江淮十校一联,16)以CO2和NH3为原料可合成尿素[CO(NH2)2],反应为2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g)。达到平衡时,NH3的转化率α(NH3)随温度变化的情况如下图。下列说法不正确的是( )
A.该反应的ΔH<0
B.若y为压强,则y1>y2
C.若y表示反应起始时的水碳比(nH2OnCO2),则y1>y2
D.在恒温恒容(2 L)的容器和绝热恒容(2 L)容器中,分别加入2 mL NH3(g)和1 mol CO2(g),达到平衡时,恒温恒容体系中氨气的转化率大于绝热恒容体系中氨气的转化率
答案 C
2.(2019四川成都毕业班摸底,16)一定温度下,在一密闭容器中发生反应:2SO2(g)+O2(g)2SO3(g),c(SO2)随时间(t)的变化如图所示。
400 ℃时压强对SO2的转化率的影响如下表。
压强
0.1 MPa
0.5 MPa
1 MPa
10 MPa
SO2转化率
99.2%
99.6%
99.7%
99.9%
下列说法正确的是( )
A.a点的v逆大于b点的v逆
B.t2时刻改变的条件一定是增大n(SO2)
C.化学平衡常数d点与e点相等
D.硫酸工业中,SO2催化氧化制SO3时采用高压提高生产效益
答案 C
3.(2018安徽皖江名校联盟联考,14)科学家研究以太阳能为热源分解Fe3O4,最终循环分解水制H2,其中一步重要反应为:2Fe3O4(s) 6FeO(s)+O2(g) ΔH=a kJ·mol-1。在一定压强下,Fe3O4的平衡转化率随温度变化的曲线如图所示。下列有关说法中不正确的是( )
A.a>0
B.压强p1>p2
C.升高温度,该反应的平衡常数增大
D将体系中O2分离出去,能提高Fe3O4的转化率
答案 B
方法2 化学平衡的计算方法——“三段式”法
1.(2020届山西霍州一中开学模拟,19)甲醇是重要的化工原料。在催化剂的作用下,利用合成气(主要成分为CO、CO2和H2)合成甲醇的主要化学反应如下:
Ⅰ.CO(g)+2H2(g) CH3OH(g)
Ⅱ.CO2(g)+3H2(g) CH3OH(g)+H2O(g)
Ⅲ.CO2(g)+H2(g) CO(g)+H2O(g)
请回答下列问题:
(1)已知三种物质的标准燃烧热如下表:
物质
CO(g)
H2(g)
CH3OH(g)
燃烧热ΔH(kJ·mol-1)
-283.0
-285.8
-726.51
①书写25 ℃、101 kPa条件时表示CO燃烧热的热化学方程式: 。
②计算25 ℃、101 kPa条件时反应Ⅰ的ΔH= kJ·mol-1。
(2)在一定条件下由甲醇可以制备甲醚。一定温度下,在三个体积均为1 L的恒容密闭容器中发生反应2CH3OH(g)CH3OCH3(g)+H2O(g),实验数据见下表:
编号
温度
/℃
起始物质的量/mol
平衡物质的量/mol
CH3OH(g)
CH3OCH3(g)
H2O(g)
CH3OCH3(g)
H2O(g)
a
387
0.2
0
0
0.08
0.08
b
387
0.4
0
0
c
207
0.2
0
0
0.09
0.09
①平衡时容器中CH3OH的体积分数大小:φ(a) φ(b)(填“>”“<”或“=”)。
②该反应的正反应是 反应(填“吸热”或“放热”)。
③平衡时容器a中反应平衡常数K(a)= 。若起始时向容器a中充入0.15 mol CH3OH(g)、0.15 mol CH3OCH3(g)和0.1 mol H2O(g),则反应向 (填“正”或“逆”)反应方向进行。
(3)直接甲醇燃料电池(Direct Methanol Fuel Cell,DMFC)属于质子交换膜燃料电池,其工作原理如图所示:
①c处产生的气体是 。
②负极的电极反应式是 。
答案 (1)①CO(g)+12O2(g)CO2(g) ΔH=-283.0 kJ·mol-1 ②-128.09
(2)①= ②放热 ③4 正 (3)①CO2 ②CH3OH+H2O-6e- CO2↑+6H+
2.(2018安徽皖南八校第二次联考,28节选)化学反应原理在科研和生产中有广泛应用。
(2)CO可用于合成甲醇,一定温度下,向体积为2 L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g) CH3OH(g),达到平衡后测得各组分的浓度如下:
物质
CO
H2
CH3OH
浓度(mol·L-1)
0.9
1.0
0.6
①反应达到平衡时,CO的转化率为 。
②该反应的平衡常数K= 。
③恒温恒容条件下,可以说明反应已达到平衡状态的是 (填标号)。
A.v正(CO)=2v逆(H2)
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
④若将容器体积压缩到1 L,则达到新平衡时c(H2)的取值范围是 。
⑤若保持容器体积不变,再充入0.6 mol CO和0.4 mol CH3OH,此时v正 v逆(填“>”“<”或“=”)。
答案 (2)①40% ②23(或0.67) ③CD ④1.0 mol·L-1v(第二步反应)
B.反应的中间产物只有NO3
C.第二步中NO2与NO3的碰撞仅部分有效
D.第三步反应活化能较高
答案 (1)O2 (2)①53.1 ②30.0 6.0×10-2 ③大于 温度提高,体积不变,总压强提高;NO2二聚为放热反应,温度提高,平衡左移,体系物质的量增加,总压强提高 ④13.4
(3)AC
4.(2017课标Ⅱ,27,14分)丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
反应①的ΔH1为 kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x 0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是 (填标号)。
A.升高温度 B.降低温度
C.增大压强 D.降低压强
(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是
。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590 ℃之前随温度升高而增大的原因可能是 、 ;590 ℃之后,丁烯产率快速降低的主要原因可能是 。
答案 (1)123 小于 AD
(2)氢气是产物之一,随着n(氢气)/n(丁烷)增大,逆反应速率增大
(3)升高温度有利于反应向吸热方向进行 温度升高反应速率加快 丁烯高温裂解生成短链烃类
5.(2016课标Ⅱ,27,14分)丙烯腈(CH2CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2CHCHO)和乙腈(CH3CN)等。回答下列问题:
(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下:
①C3H6(g)+NH3(g)+32O2(g) C3H3N(g)+3H2O(g)
ΔH=-515 kJ·mol-1
②C3H6(g)+O2(g) C3H4O(g)+H2O(g)
ΔH=-353 kJ·mol-1
两个反应在热力学上趋势均很大,其原因是 ;有利于提高丙烯腈平衡产率的反应条件是 ;提高丙烯腈反应选择性的关键因素是 。
(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应的温度为460 ℃。低于460 ℃时,丙烯腈的产率 (填“是”或“不是”)对应温度下的平衡产率,判断理由是 ;高于460 ℃时,丙烯腈产率降低的可能原因是 (双选,填标号)。
A.催化剂活性降低 B.平衡常数变大
C.副反应增多 D.反应活化能增大
(3)丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图(b)所示。由图可知,最佳n(氨)/n(丙烯)约为 ,理由是 。进料气氨、空气、丙烯的理论体积比约为 。
答案 (14分)(1)两个反应均为放热量大的反应 降低温度降低压强 催化剂
(2)不是 该反应为放热反应,平衡产率应随温度升高而降低 AC
(3)1 该比例下丙烯腈产率最高,而副产物丙烯醛产率最低 1∶7.5∶1
6.(2016课标Ⅲ,27,15分)煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:
(1)NaClO2的化学名称为 。
(2)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度323 K,NaClO2溶液浓度为5×10-3 mol·L-1。反应一段时间后溶液中离子浓度的分析结果如下表。
离子
SO42-
SO32-
NO3-
NO2-
Cl-
c/(mol·L-1)
8.35×10-4
6.87×10-6
1.5×10-4
1.2×10-5
3.4×10-3
①写出NaClO2溶液脱硝过程中主要反应的离子方程式 。增加压强,NO的转化率 (填“提高”“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐 (填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率 脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是 。
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中SO2和NO的平衡分压pc如图所示。
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均 (填“增大”“不变”或“减小”)。
②反应ClO2-+2SO32- 2SO42-+Cl-的平衡常数K表达式为 。
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是 。
②已知下列反应:
SO2(g)+2OH-(aq) SO32-(aq)+H2O(l) ΔH1
ClO-(aq)+SO32-(aq) SO42-(aq)+Cl-(aq) ΔH2
CaSO4(s) Ca2+(aq)+SO42-(aq) ΔH3
则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq) CaSO4(s)+H2O(l)+Cl-(aq)的ΔH= 。
答案 (1)亚氯酸钠(2分)
(2)①4NO+3ClO2-+4OH- 4NO3-+2H2O+3Cl-(2分) 提高(1分) ②减小(1分)
③大于(1分) NO溶解度较低或脱硝反应活化能较高(1分)
(3)①减小(1分) ②c2(SO42-)·c(Cl-)c2(SO32-)·c(ClO2-)(2分)
(4)①形成CaSO4沉淀,反应平衡向产物方向移动,SO2转化率提高(2分)
②ΔH1+ΔH2-ΔH3(2分)
7.(2015课标Ⅰ,28,15分)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2。该反应的还原产物为 。
(2)上述浓缩液中主要含有I-、Cl-等离子。取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中c(I-)c(Cl-)为 。已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
(3)已知反应2HI(g) H2(g)+I2(g)的ΔH=+11 kJ·mol-1,1 mol H2(g)、1 mol I2(g)分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1 mol HI(g)分子中化学键断裂时需吸收的能量为 kJ。
(4)Bodensteins研究了下列反应:
2HI(g) H2(g)+I2(g)
在716 K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min
0
20
40
60
80
120
x(HI)
1
0.91
0.85
0.815
0.795
0.784
x(HI)
0
0.60
0.73
0.773
0.780
0.784
①根据上述实验结果,该反应的平衡常数K的计算式为 。
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为 (以K和k正表示)。若k正=0.002 7 min-1,在t=40 min时,v正= min-1。
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为 (填字母)。
答案 (15分)(1)MnSO4(或Mn2+)(1分)
(2)4.7×10-7(2分)
(3)299(2分)
(4)①0.108×0.1080.7842(2分) ②k正/K 1.95×10-3(每空2分,共4分) ③A、E(4分)
考点三 化学平衡的相关计算
8.(2019课标Ⅰ,28,14分)水煤气变换[CO(g)+H2O(g) CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:
(1)Shibata曾做过下列实验:①使纯H2缓慢地通过处于721 ℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴Co(s),平衡后气体中H2的物质的量分数为0.025 0。②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.019 2。
根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO H2(填“大于”或“小于”)。
(2)721 ℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为 (填标号)。
A.<0.25 B.0.25 C.0.25~0.50 D.0.50 E.>0.50
(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。
可知水煤气变换的ΔH 0(填“大于”“等于”或“小于”)。该历程中最大能垒(活化能)E正= eV,写出该步骤的化学方程式 。
(4)Shoichi研究了467 ℃、489 ℃时水煤气变换中CO和H2分压随时间变化关系(如下图所示),催化剂为氧化铁,实验初始时体系中的pH2O和pCO相等、pCO2和pH2相等。
计算曲线a的反应在30~90 min内的平均速率v(a)= kPa·min-1。467 ℃时pH2和pCO随时间变化关系的曲线分别是 、 。489 ℃时pH2和pCO随时间变化关系的曲线分别是 、 。
答案 (1)大于
(2)C
(3)小于 2.02 COOH*+H*+H2O* COOH*+2H*+OH*(或H2O* H*+OH*)
(4)0.004 7 b c a d
9.(2019课标Ⅱ,27,15分)环戊二烯()是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知:(g) (g)+H2(g)
ΔH1=100.3 kJ·mol-1 ①
H2(g)+I2(g) 2HI(g) ΔH2=-11.0 kJ·mol-1 ②
对于反应:(g)+I2(g) (g)+2HI(g) ③ ΔH3= kJ·mol-1。
(2)某温度下,等物质的量的碘和环戊烯()在刚性容器内发生反应③,起始总压为105 Pa,平衡时总压增加了20%,环戊烯的转化率为 ,该反应的平衡常数Kp= Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有 (填标号)。
A.通入惰性气体 B.提高温度
C.增加环戊烯浓度 D.增加碘浓度
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是 (填标号)。
A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L-1
(4)环戊二烯可用于制备二茂铁[Fe(C5H5)2,结构简式为],后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
该电解池的阳极为 ,总反应为 。电解制备需要在无水条件下进行,原因为 。
答案 (1)89.3
(2)40% 3.56×104 BD
(3)CD
(4)Fe电极
水会阻碍中间物Na的生成;水会电解生成OH-,进一步与Fe2+反应生成Fe(OH)2
10.(2017课标Ⅲ,28,14分)砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图 。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式 。该反应需要在加压下进行,原因是 。
(3)已知:As(s)+32H2(g)+2O2(g) H3AsO4(s) ΔH1
H2(g)+12O2(g) H2O(l) ΔH2
2As(s)+52O2(g) As2O5(s) ΔH3
则反应As2O5(s)+3H2O(l) 2H3AsO4(s)的ΔH= 。
(4)298 K时,将20 mL 3x mol·L-1 Na3AsO3、20 mL 3x mol·L-1 I2和20 mL NaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-(aq) AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
①下列可判断反应达到平衡的是 (填标号)。
a.溶液的pH不再变化
b.v(I-)=2v(AsO33-)
c.c(AsO43-)/c(AsO33-)不再变化
d.c(I-)=y mol·L-1
②tm时,v正 v逆(填“大于”“小于”或“等于”)。
③tm时v逆 tn时v逆(填“大于”“小于”或“等于”),理由是 。
④若平衡时溶液的pH=14,则该反应的平衡常数K为 。
答案 (1)
(2)2As2S3+5O2+6H2O 4H3AsO4+6S
增加反应物O2的浓度,提高As2S3的转化速率
(3)2ΔH1-3ΔH2-ΔH3
(4)①a、c ②大于 ③小于 tm时生成物浓度较低
④4y3(x-y)2(mol·L-1)-1
B组 自主命题·省(区、市)卷题组
考点一 化学反应速率
1.(2018江苏单科,10,2分)下列说法正确的是( )
A.氢氧燃料电池放电时化学能全部转化为电能
B.反应4Fe(s)+3O2(g)2Fe2O3(s)常温下可自发进行,该反应为吸热反应
C.3 mol H2与1 mol N2混合反应生成NH3,转移电子的数目小于6×6.02×1023
D.在酶催化淀粉水解反应中,温度越高淀粉水解速率越快
答案 C
2.(2017江苏单科,10,2分)H2O2分解速率受多种因素影响。实验测得70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是( )
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
答案 D
3.(2015安徽理综,11,6分)汽车尾气中NO产生的反应为:N2(g)+O2(g)2NO(g)。一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是( )
A.温度T下,该反应的平衡常数K=4(c0-c1)2c12
B.温度T下,随着反应的进行,混合气体的密度减小
C.曲线b对应的条件改变可能是加入了催化剂
D.若曲线b对应的条件改变是温度,可判断该反应的ΔH<0
答案 A
4.(2015福建理综,12,6分)在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表。下列判断不正确···的是 ( )
c/mol·L-1 v/mmol·L-1·min-1 T/K
0.600
0.500
0.400
0.300
318.2
3.60
3.00
2.40
1.80
328.2
9.00
7.50
a
4.50
b
2.16
1.80
1.44
1.08
A.a=6.00
B.同时改变反应温度和蔗糖的浓度,v可能不变
C.b<318.2
D.不同温度时,蔗糖浓度减少一半所需的时间相同
答案 D
考点二 化学平衡 化学反应进行的方向
5.(2018天津理综,5,6分)室温下,向圆底烧瓶中加入1 mol C2H5OH和含1 mol HBr的氢溴酸,溶液中发生反应:C2H5OH+HBr C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4 ℃和78.5 ℃。下列有关叙述错误的是( )
A.加入NaOH,可增大乙醇的物质的量
B.增大HBr浓度,有利于生成C2H5Br
C.若反应物均增大至2 mol,则两种反应物平衡转化率之比不变
D.若起始温度提高至60 ℃,可缩短反应达到平衡的时间
答案 D
6.(2017天津理综,6,6分)常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g) Ni(CO)4(g)。230 ℃时,该反应的平衡常数K=2×10-5。已知:Ni(CO)4的沸点为42.2 ℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230 ℃制得高纯镍。
下列判断正确的是( )
A.增加c(CO),平衡向正向移动,反应的平衡常数增大
B.第一阶段,在30 ℃和50 ℃两者之间选择反应温度,选50 ℃
C.第二阶段,Ni(CO)4分解率较低
D.该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
答案 B
7.(2015四川理综,7,6分)一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g) 2CO(g),平衡时,体系中气体体积分数与温度的关系如下图所示:
已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是( )
A.550 ℃时,若充入惰性气体,v正、v逆均减小,平衡不移动
B.650 ℃时,反应达平衡后CO2的转化率为25.0%
C.T ℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D.925 ℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=24.0p总
答案 B
考点三 化学平衡的相关计算
8.(2015天津理综,6,6分)某温度下,在2 L的密闭容器中,加入1 mol X(g)和2 mol Y(g)发生反应:
X(g)+mY(g) 3Z(g)
平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1 mol Z(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是( )
A.m=2
B.两次平衡的平衡常数相同
C.X与Y的平衡转化率之比为1∶1
D.第二次平衡时,Z的浓度为0.4 mol·L-1
答案 D
9.(2015重庆理综,7,6分)羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:
CO(g)+H2S(g) COS(g)+H2(g) K=0.1
反应前CO物质的量为10 mol,平衡后CO物质的量为8 mol。下列说法正确的是( )
A.升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,正反应速率逐渐增大
C.反应前H2S物质的量为7 mol
D.CO的平衡转化率为80%
答案 C
C组 教师专用题组
考点一 化学反应速率
1.(2016北京理综,8,6分)下列食品添加剂中,其使用目的与反应速率有关的是( )
A.抗氧化剂 B.调味剂
C.着色剂 D.增稠剂
答案 A
2.(2014课标Ⅰ,9,6分)已知分解1 mol H2O2放出热量98 kJ。在含少量I-的溶液中,H2O2分解的机理为:
H2O2+I- H2O+IO- 慢
H2O2+IO- H2O+O2+I- 快
下列有关该反应的说法正确的是( )
A.反应速率与I-浓度有关
B.IO-也是该反应的催化剂
C.反应活化能等于98 kJ·mol-1
D.v(H2O2)=v(H2O)=v(O2)
答案 A
3.(2014北京理综,12,6分)一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min
0
2
4
6
8
10
V(O2)/mL
0.0
9.9
17.2
22.4
26.5
29.9
下列叙述不正确···的是(溶液体积变化忽略不计)( )
A.0~6 min的平均反应速率:v(H2O2)≈3.3×10-2 mol/(L·min)
B.6~10 min的平均反应速率:v(H2O2)<3.3×10-2 mol/(L·min)
C.反应至6 min时,c(H2O2)=0.30 mol/L
D.反应至6 min时,H2O2分解了50%
答案 C4.(2014四川理综,7,6分)在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) M(g)+N(g),所得实验数据如下表:
实验编号
温度/℃
起始时物质的量/mol
平衡时物质的量/mol
n(X)
n(Y)
n(M)
①
700
0.40
0.10
0.090
②
800
0.10
0.40
0.080
③
800
0.20
0.30
a
④
900
0.10
0.15
b
下列说法正确的是( )
A.实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol/(L·min)
B.实验②中,该反应的平衡常数K=2.0
C.实验③中,达到平衡时,X的转化率为60%
D.实验④中,达到平衡时,b>0.060
答案 C
5.(2014天津理综,3,6分)运用相关化学知识进行判断,下列结论错误··的是( )
A.某吸热反应能自发进行,因此该反应是熵增反应
B.NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中
C.可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底
D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率
答案 D
6.(2014安徽理综,10,6分)臭氧是理想的烟气脱硝试剂,其脱硝反应为:2NO2(g)+O3(g) N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A
B
升高温度,平衡常数减小
0~3 s内,反应速率为:
v(NO2)=0.2 mol·L-1
C
D
t1时仅加入催化剂,平衡正向移动
达平衡时,仅改变x,则x为c(O2)
答案 A
7.(2012课标,27,15分)光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)实验室中常用来制备氯气的化学方程式为 ;
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2和CO的燃烧热(ΔH)分别为-890.3 kJ·mol-1、-285.8 kJ·mol-1和-283.0 kJ·mol-1,则生成1 m3(标准状况)CO所需热量为 ;
(3)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气,其反应的化学方程式为 ;
(4)COCl2的分解反应为COCl2(g) Cl2(g)+CO(g) ΔH=+108 kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未示出):
①计算反应在第8 min时的平衡常数K= ;
②比较第2 min反应温度T(2)与第8 min反应温度T(8)的高低:T(2) T(8)(填“<”“>”或“=”);
③若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)= mol·L-1;
④比较产物CO在2—3 min、5—6 min和12—13 min时平均反应速率[平均反应速率分别以v(2—3)、v(5—6)、v(12—13)表示]的大小 ;
⑤比较反应物COCl2在5—6 min和15—16 min时平均反应速率的大小:v(5—6) v(15—16)(填“<”“>”或“=”),原因是 。
答案 (1)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
(2)5.52×103 kJ
(3)CHCl3+H2O2 HCl+H2O+COCl2
(4)①0.234 mol·L-1
②<
③0.031
④v(5—6)>v(2—3)=v(12—13)
⑤> 在相同温度时,该反应的反应物浓度越高,反应速率越大
考点二 化学平衡 化学反应进行的方向
8.(2013北京理综,11,6分)下列实验事实不能用···平衡移动原理解释的是( )
A.
B.
t/℃
25
50
100
KW/10-14
1.01
5.47
55.0
C.
D.
c(氨水)/(mol·L-1)
0.1
0.01
pH
11.1
10.6
答案 C
9.(2013大纲全国,7,6分)反应X(g)+Y(g) 2Z(g) ΔH<0,达到平衡时,下列说法正确的是( )
A.减小容器体积,平衡向右移动
B.加入催化剂,Z的产率增大
C.增大c(X),X的转化率增大
D.降低温度,Y的转化率增大
答案 D
10.(2013重庆理综,7,6分)将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
压强/MPa 体积分数/%温度/℃
1.0
2.0
3.0
810
54.0
a
b
915
c
75.0
d
1 000
e
f
83.0
①b0
④K(1 000 ℃)>K(810 ℃)
上述①~④中正确的有( )
A.4个 B.3个 C.2个 D.1个
答案 A
11.(2015北京理综,26,12分)氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
(1)反应Ⅰ的化学方程式是 。
(2)反应Ⅰ得到的产物用I2进行分离。该产物的溶液在过量I2的存在下会分成两层——含低浓度I2的H2SO4层和含高浓度I2的HI层。
①根据上述事实,下列说法正确的是 (选填序号)。
a.两层溶液的密度存在差异
b.加I2前,H2SO4溶液和HI溶液不互溶
c.I2在HI溶液中比在H2SO4溶液中易溶
②辨别两层溶液的方法是
。
③经检测,H2SO4层中c(H+)∶c(SO42-)=2.06∶1。其比值大于2的原因是 。
(3)反应Ⅱ:2H2SO4(l) 2SO2(g)+O2(g)+2H2O(g)
ΔH=+550 kJ·mol-1。
它由两步反应组成:ⅰ.H2SO4(l) SO3(g)+H2O(g) ΔH=+177 kJ·mol-1;ⅱ.SO3(g)分解。
L(L1、L2)、X可分别代表压强或温度。如图表示L一定时,ⅱ中SO3(g)的平衡转化率随X的变化关系。
①X代表的物理量是 。
②判断L1、L2的大小关系,并简述理由:
。
答案 (12分)(1)SO2+I2+2H2O H2SO4+2HI
(2)①a、c
②观察颜色,颜色深的是HI层,颜色浅的是H2SO4层
③H2SO4层中含有少量HI
(3)①压强
②L1”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”)。若要使K2减小,可采取的措施是 。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1 L溶液A,溶液B为0.1 mol·L-1的CH3COONa溶液,则两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为 。(已知HNO2的电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1)
可使溶液A和溶液B的pH相等的方法是 。
a.向溶液A中加适量水
b.向溶液A中加适量NaOH
c.向溶液B中加适量水
d.向溶液B中加适量NaOH
答案 (1)K12K2
(2)2.5×10-2 75% > 不变 升高温度
(3)c(NO3-)>c(NO2-)>c(CH3COO-) b、c
17.(2013课标Ⅱ,28,14分)在1.0 L密闭容器中放入0.10 mol A(g),在一定温度进行如下反应:
A(g) B(g)+C(g) ΔH=+85.1 kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/h
0
1
2
4
8
16
20
25
30
总压强p/100 kPa
4.91
5.58
6.32
7.31
8.54
9.50
9.52
9.53
9.53
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为 。
(2)由总压强p和起始压强p0计算反应物A的转化率α(A)的表达式为 ,平衡时A的转化率为 ,列式并计算反应的平衡常数K
。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n总= mol,n(A)= mol。
②下表为反应物A浓度与反应时间的数据,计算:a= 。
反应时间t/h
0
4
8
16
c(A)/(mol·L-1)
0.10
a
0.026
0.006 5
分析该反应中反应物的浓度c(A)变化与时间间隔(Δt)的规律,得出的结论是 ,由此规律推出反应在12 h时反应物的浓度c(A)为 mol·L-1。
答案 (1)升高温度、降低压强(2分)
(2)(pp0-1)×100% 94.1%(每空1分,共2分)
A(g) B(g) + C(g)
0.10 0 0
0.10×(1-94.1%) 0.10×94.1% 0.10×94.1%
K=(0.094 1mol·L-1)20.005 9mol·L-1=1.5 mol·L-1(3分)
(3)①0.10×pp0 0.10×(2-pp0)(每空1分,共2分)
②0.051(2分) 达到平衡前每间隔4 h,c(A)减少约一半(2分) 0.013(1分)
【三年模拟】
时间:45分钟 分值:90分
一、选择题(每题6分,共42分)
1.(2020届安徽合肥八校一联,13)氢气可用于烟气的脱氮、脱硫,反应为4H2(g)+2NO(g)+SO2(g)N2(g)+S(l)+4H2O(g) ΔH<0。下列有关该反应说法正确的是( )
A.氧化剂是NO,还原剂是H2
B.升高温度,正、逆反应速率均增大
C.当v(H2)=v(H2O)时,反应达到平衡
D.使用高效催化剂可提高NO的平衡转化率
答案 B
2.(2018吉林长春普通高中一模,11)一定条件下,将TiO2和焦炭放入真空密闭容器中,反应TiO2(s)+C(s) Ti(s)+CO2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡。下列说法中一定正确的是( )
A.平衡常数减小 B.TiO2的质量不变
C.CO2的浓度不变 D.Ti的质量增大
答案 C
3.(2019安徽定远重点中学月考,11)在密闭容器中,反应X2(g)+Y2(g)2XY(g) ΔH>0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是( )
A.图Ⅰ是升高温度的变化情况
B.图Ⅱ是扩大容器体积的变化情况
C.图Ⅲ是增大压强的变化情况
D.图Ⅲ是升高温度的变化情况
答案 A
4.(2019山西太原期末,19)以反应5H2C2O4+2MnO4-+6H+ 10CO2↑+2Mn2++8H2O为例探究“外界条件对化学反应速率的影响”。实验时,分别量取H2C2O4溶液和酸性KMnO4溶液,迅速混合并开始计时,通过测定溶液褪色所需时间来判断反应的快慢。
编号
H2C2O4溶液
酸性KMnO4溶液
温度/℃
浓度/mol·L-1
体积/mL
浓度/mol·L-l
体积/mL
①
0.10
2.0
0.010
4.0
25
②
0.20
2.0
0.010
4.0
25
③
0.20
2.0
0.010
4.0
50
下列说法不正确的是( )
A.实验①、②、③所加的H2C2O4溶液均要过量
B.实验①测得KMnO4溶液的褪色时间为40 s,则这段时间内v(KMnO4)=2.5×10-4 mol·L-1·s-1
C.实验①和②是探究浓度对化学反应速率的影响,实验②和③是探究温度对化学反应速率的影响
D.实验①和②起初反应均很慢,过了一会儿速率突然增大,可能是生成的Mn2+对反应起催化作用
答案 B
5.(2019山西吕梁期末,12)臭氧是理想的烟气脱硝剂,其脱硝反应为2NO2(g)+O3(g)N2O5(g)+O2(g),在T温度下,向2.0 L 恒容密闭容器中充入2.0 mol NO2和1.0 mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s
0
3
6
12
24
n(O2)/mol
0
0.36
0.60
0.80
0.80
下列有关说法正确的是( )
A.反应在0~3 s内的平均速率v(NO2)=0.24 mol·L-1·s-1
B.在T温度下,起始时向容器中充入1.0 mol NO2、0.5 mol O3和0.5 mol N2O5、0.5 mol O2,反应达到平衡时,压强为起始时的0.88倍
C.24 s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44 mol·L-1,则反应的ΔH>0
D.在T温度下,起始时向容器中充入2.0 mol N2O5和2.0 mol O2,达到平衡时,N2O5的转化率大于20%
答案 B
6.(2020届安徽合肥八校一联,18)在容积一定的密闭容器中发生可逆反应A(g)+B(g)C(g) ΔH>0,平衡移动关系如下图所示。下列说法正确的是( )
选项
压强
纵坐标
A
p1>p2
B的转化率
B
p1p2
A的质量分数
答案 A
7.(2020届四川成都七中入学调研,8)在盛有足量A的体积可变的密闭容器中加入B,发生反应:A(s)+2B(g)4C(g)+D(g) ΔH<0。在一定温度、压强下达到平衡,平衡时C的物质的量与加入的B的物质的量的变化关系如图。下列说法正确的是( )
A.当温度升高后,则图中θ>45°
B.若再加入B,再次达到平衡状态时,正、逆反应速率均增大
C.平衡时B的转化率为50%
D.若再加入B,则平衡后反应体系气体密度减小
答案 C
二、非选择题(共48分)
8.(2020届安徽江淮十校一联,18)(12分)含氮化合物的种类非常丰富,请回答下列问题:
(1)已知:2NO2(g)N2O4(g) ΔH1=-55.3 kJ·mol-1
N2O5(g)2NO2(g)+12O2(g) ΔH2=+53.1 kJ·mol-1
则2N2O5(g)2N2O4(g)+O2(g) ΔH= 。
(2)T1温度时在容积为2 L的恒容密闭容器中充入4 mol NO和2 mol O2发生反应:2NO(g)+O2(g)2NO2(g) ΔH<0,4 min时达到平衡,此时O2转化率为80%。
①0~4 min内该反应的平均反应速率v(NO2)= ;
②T1温度时该反应的化学平衡常数K= ;
③若不改变外界条件,向平衡后的容器中再通入1 mol NO2(g),重新达到平衡后,NO2(g)在体系中的百分含量 (填“变大”“变小”或“不变”)。
(3)工业合成氨的反应原理为:N2(g)+3H2(g) 2NH3(g) ΔH<0。对于该反应,既可以提高平衡体系中NH3的百分含量,又能加快反应速率的措施是 (填序号)。
a.升高温度
b.将平衡体系中的氨气分离出来
c.增大体系压强
d.加入合适的催化剂
(4)如图所示,T1温度时,NO和O2的投料比与平衡时NO2的体积分数的关系(不考虑NO2与N2O4之间的相互转化)。
横坐标代表NO和O2的投料比,纵坐标代表平衡时NO2体积分数,计算最高点(2,0.85)时NO的平衡体积分数为 。
答案 (每空2分)(1)-4.4 kJ·mol-1
(2)①0.4 mol·L-1·min-1 ②80 ③变大 (3)c (4)10%
9.(2020届江西南昌开学摸底,21)(10分)机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知:C(s)+O2(g)CO2(g) ΔH1=-393.5 kJ·mol-1
2C(s)+O2(g)2CO(g) ΔH2=-221.0 kJ·mol-1
N2(g)+O2(g)2NO(g) ΔH3=+180.5 kJ·mol-1
则反应2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH= 。
(2)科学家研究出了一种高效催化剂,可以将CO和NO发生反应生成N2(g)和CO2(g)。在T ℃下,向某恒容密闭容器中通入a mol·L-1 NO、b mol·L-1 CO,使其发生上述反应,测得NO的平衡转化率与投料比X(表示a、b两者的比值)的关系如图1中曲线所示。
图1
若X1=1.0、a=2,反应开始到达平衡所用时间是2 min,则反应发生2 min内N2的平均反应速率v(N2)= ,平衡态A点的平衡常数K= 。
(3)柴油燃油车是通过尿素—选择性催化还原(Urea-SCR)法处理氮氧化物。
Urea-SCR的工作原理为:尿素[CO(NH2)2]水溶液通过喷嘴喷入排气管中,当温度高于160 ℃时尿素水解产生NH3,生成的NH3与尾气混合后,加入适合的催化剂,使氮氧化物得以处理。
图2
图2为在不同投料比[n(尿素)n(NO)]时NO转化效率随温度变化的曲线。
①尿素与NO物质的量之比:a b(填“>”“=”或“<”)。
②由图可知,下列说法错误的是 。
A.400 ℃以下,随着温度升高,尿素水解释放氨气的速率加快,NO转化效率升高
B.400 ℃以下,温度升高,反应活化能降低,导致化学反应速率加快
C.440 ℃以上,温度过高,可能使催化剂活性降低,导致NO转化效率下降
答案 (每空2分)(1)-746.5 kJ·mol-1
(2)0.4 mol·L-1·min-1 80.0
(3)①> ②B
10.(2020届江西名师联盟入学调研,20节选)(12分)甲醇是一种可再生的绿色能源,CO2是一种温室气体,都是重要的化工原料。
(1)已知CO的燃烧热ΔH为-283 kJ·mol-1,CO(g)+2H2(g)CH3OH(l) ΔH=-129 kJ·mol-1,欲求出CH3OH(l)的燃烧热,则需要知道一个反应,该反应的热化学方程式为 (无需写出ΔH的具体数值)。
(2)向温度不同容积均为1 L的a、b、c、d、e五个恒容密闭容器中各充入3 mol CO2、7 mol H2的混合气体,控制适当条件使其同时发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH=Q kJ·mol-1,反应过程中维持各容器温度不变,测得t1时刻各容器中H2O的体积分数φ(H2O)如图所示。
①Q (填“>”或“<”)0,五个容器中肯定处于非平衡状态的是 。
②t1时刻时,容器a中正反应速率 (填“大于”“小于”或“等于”)容器e中正反应速率。
③Td ℃时,该反应的平衡常数K= 。
④欲提高H2的转化率,可采取的措施有 (写出两种)。
答案 (每空2分)(1)2H2(g)+O2(g)2H2O(l) ΔH
(2)①< a、b ②小于 ③4 ④降低温度或者增大二氧化碳的量或者增大压强
11.(2018福建厦门质量检测,28节选)(14分)甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,可能发生的反应如下:
ⅰ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
ⅱ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2
ⅲ.CH3OH(g) CO(g)+2H2(g) ΔH3
回答下列问题:
(1)已知反应ⅱ中相关化学键键能数据如下:
化学键
H—H
CO
H—O
E(kJ·mol-1)
436
803
1 076
465
由此计算ΔH2= kJ·mol-1。已知ΔH3=+99 kJ·mol-1,则ΔH1= kJ·mol-1。
(2)一定比例的合成气在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如下图所示。
①温度为470 K时,图中P点 (填“是”或“不是”)处于平衡状态。在490 K之前,甲醇产率随着温度升高而增大的原因是 ;490 K之后,甲醇产率减小的原因是 。
②一定能提高甲醇产率的措施是 。
A.增大压强 B.升高温度
C.选择合适催化剂 D.加入大量催化剂
答案 (1)+36(2分) -63(2分)
(2)①不是(2分) 温度越高化学反应速率越快(3分) 升高温度,反应ⅰ逆向移动,催化剂活性降低(3分)
②AC(2分)